Разновидности гемоглобина у человека

Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник
Клинический анализ крови – важная составляющая общеклинической диагностики пациентов с патологиями различного характера. В данное исследование входит анализ уровня красных кровяных телец и железосодержащего белка (ЖБ) в сыворотке крови. Данный показатель очень чувствителен к различным изменениям в работе внутренних органов.
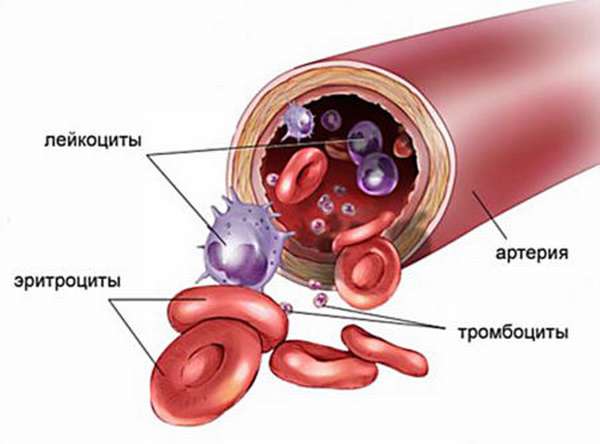
Внимание! Эритроциты обеспечивают внутриклеточное дыхание в человеческом организме. Они выполняют жизненно важные функции – выводят углекислый газ из тела и поставляют кислород к органам. Красные кровяные тельца содержат гемоглобин, который транспортирует молекулы этих веществ.
Что такое гемоглобин?
Гемоглобин – пептидное соединение (ПС), содержащее железо, которое транспортирует кислород ко всем тканям человеческого организма. У всех позвоночных зверей данное белковое соединение содержится в красных кровяных клетках, а у беспозвоночных – в плазме. Как упоминалось выше, его функция заключается в том, чтобы выводить диоксид углерода и заниматься поставкой кислорода в органы.
Железосодержащий ген состоит из четырех базовых субъединиц – альфа и бета 1,2. Стоит отметить, что данное ПС имеет формулу тетрамера. Основными компонентами гемоглобина принято считать железосодержащий гем и белок глобин.
Виды гемоглобина:
- Дезоксигемоглобин,
- Карбоксигемоглобин (окрашивает кровь в синеватый цвет),
- Метгемоглобин,
- Фетальный ЖБ (присутствует у плода и исчезает в процессе онтогенеза),
- Оксигемоглобин (окрашивает кровь в светло-красный цвет),
- Миоглобин.
Дезоксигемоглобин – это свободный гемоглобин в крови человека. В такой форме это ПС способно присоединять к себе различные молекулы – углекислый/угарный газ, кислород.
Если дезоксигемоглобин связывается с кислородом, образуется оксигемоглобин. Этот тип белка поставляет кислород ко всем тканям. При наличие различных оксилителей железо в ЖБ из двухвалентного состояния переходит в трехвалентное. Такое соединение принято называть метгемоглобином, оно выполняет важную роль в физиологии органов.

Если восстановленный гемоглобин связывается с угарным газом, образуется токсичное соединение – карбоксигемоглобин. Необходимо отметить, что такое соединение связывается в 250 раз эффективнее, чем диоксид углерода. Карбоксигемоглобин имеет длительный период полураспада, поэтому способен сталь причиной сильного отравления.
Витамин С помогает восстанавливать ЖБ, благодаря чему применяется свободно в медицине для лечения отравлений угарными испрениями. Как правило, интоксикация оксидом углерода проявляется цианозом.
Миоглобин по структуре похож на гемоглобин и в большом количестве содержится в миоцитах, особенно кардиомиоцитах. Он связывает молекулы О₂ «на черный день», который впоследствии используется организмом при состояниях, вызывающих гипоксию. Миоглобин обеспечивает работающие мышцы кислородом.
Все вышеперечисленные типы имеют жизненно важное значения в организме человека, однако существуют патологические формы данного пептидного соединения.
Какие опасные разновидности гемоглобина существуют?
Патологические виды гемоглобина у человека, которые приводят к различным болезням:
- Гемоглобин D-Пенджаб,
- Гемоглобин S – форма, обнаруженная у людей с серповидно-клеточной анемией,
- Гемоглобин С – эта форма вызывает хроническую гемолитическую анемию,
- Гемоглобин H – тип гемоглобина, образованный тетрамером β-цепей, который может присутствовать при α-талассемии.
ЖБ D-Пенджаб является одним из вариантов гемоглобина. Он так назван из-за его высокой распространенности в Пенджабском районе Индии и Пакистана. Это также самый распространенный аномальный вариант железосодержащего белка в Синьцзян-Уйгурском автономном районе Китая. Исследования показывают, что D-Пенджаб составляет более 55% от общего числа патологического гемоглобина.
Он был впервые обнаружен в начале 1950-х годов в смешанной британской и американской семье индийского происхождения из района Лос-Анджелеса, поэтому его иногда называют D Los Angeles. ЖБ D является наиболее распространенным вариантом данного вещества. Он появился в результате распространенности малярии в разных частях Азии.
Гемоглобин S возник в Западной Африке, где распространен больше всего. Он присутствует в меньшей степени в Индии и Средиземноморском регионе. Полиморфизм гена бета S указывает на то, что он возник из пяти отдельных мутаций: четырех в Африке и одного в Индии и на Ближнем Востоке. Наиболее распространенной является аллель, обнаруженная в Бенине в Западной Африке. Другие гаплотипы обнаружены в Сенегале и Банту.
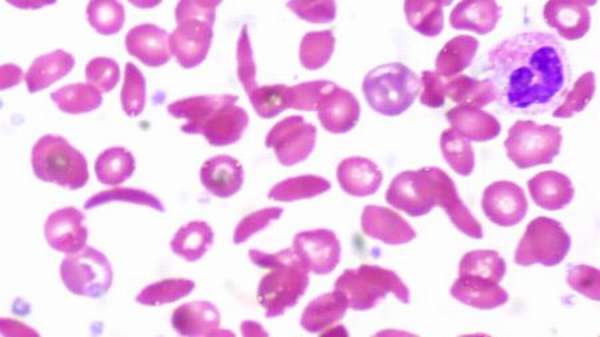
Важно! Ген HbS, присутствующий в гомозиготной форме, является нежелательной мутацией. Малярия, возможно, является фактором отбора, поскольку существует четкая корреляция между распространенностью этой болезни и серповидно-клеточной анемией. Дети с серповидно-клеточной характеристикой Hb SA, переносят малярию гораздо легче и чаще выздоравливают.
Железосодержащий белок C (Hb C) является одним из наиболее распространенных структурных вариантов гемоглобина. Люди со «здоровым» С (Hb C) фенотипически нормальны, тогда как пациенты с патологическим (Hb CC) могут страдать от гемолитической анемии. Хотя клинические осложнения, связанные с патологическим С, не являются серьезными.
Гемоглобин H вызывает тяжелое заболевание – альфа-талассемию. α-талассемия приводит к снижению продукции альфа-глобина, поэтому образуется меньше альфа-глобиновых цепей, что приводит к избытку β-цепей у взрослых и у новорожденных. Избыточные β-цепи образуют нестабильные тетрамеры, называемые гемоглобином H или HbH четырех бета-цепей. Избыточные γ-цепи образуют тетрамеры, которые слабо связываются с кислородом, поскольку их сродство к O2 слишком велико, поэтому оно не диссоциируется на периферии.
Как диагностируют патологические формы железосодержащего белка в крови?
Как упоминалось выше, анализ на содержание гемоглобина входит в клиническое исследование сыворотки крови. В некоторых случаях показано проведение биохимии крови для точного определения патологий данного ПС.
Кровь на анализ сдается натощак и в утреннее время. Рекомендуется не употреблять пищу за 12 часов до забора биологического материала (кала, мочи, крови), чтобы не исказить результаты анализов обследования. В особенности нежелательно заниматься физическими нагрузками, употреблять психотропные вещества или другие лекарственные средства. Диеты придерживаться не нужно, однако от жирной или жареной пищи воздержаться следует, чтобы не повлиять на различные параметры в кале.

Нормальные показатели железосодержащего белка
Расшифровкой анализа общеклинического исследования сыворотки крови должен заниматься только врач. Однако выделяют некоторые общие нормы гемоглобина, присущие всем людям. Уровень данного ПС измеряется в г/л (граммы на литр). В зависимости от лаборатории методики анализа могут различаться.
Норма дезоксигемоглобина в крови у различных возрастных групп:
- Мужчины от 18 лет – 120-150 г/л,
- Женщины от 18 лет – 110-130,
- Маленький ребенок – 200,
Повышение или снижение уровня свободного гемоглобина может приводить к патологиям. Первичная гемоглобинопатия обусловлена наследственными причинами, поэтому не лечится на любых этапах развития. Однако существуют методы стабилизации пациентов, поэтому в любом случае нужно обратиться к врачу. При серьезном снижении уровня данного ПС в кровеносном русле показан искусственный кровезаменитель.
Совет! Синтетическое соединение «перфторан» способно улучшить качество жизни больных с анемией. Искусственно повышать гемоглобин нужно с осторожностью, так как в некоторых случаях кровезаменители могут вызывать серьезные побочные эффекты.
Малокровие: негативные последствия и лечение явления
У взрослого пациента снижение гемоглобина провоцирует кислородный дефицит. Игнорирование этого может привести к:
- Снижению иммунитета. В итоге, человек начинает чаще болеть инфекционными недугами.
- Быстрой утомляемости и хронической слабости.
- Деформации эпителиальных тканей человека (слизистых, ротовой полости, ЖКТ, верхних слоев кожного покрова).
- Нарушению функциональности НС. Пациент может страдать от раздражительности, беспричинных перепадов настроения, пониженной концентрации внимания.
Также малокровие может стать причиной:
- трещин на губах,
- резких мышечных болей,
- выпадения волос,
- ломкости ногтевой пластины,
- пристрастия к неприятным запахам.
При беременности
Малокровие при вынашивании ребенка – частое явление среди женщин. Если отклонение от нормы очень большое, оно может спровоцировать:
- маточную гипотонию,
- гипоксию,
- задержку развития и роста будущего малыша,
- низкий вес ребенка при рождении,
- нарушения функциональности НС и системы дыхания.
Специалисты считают, что ребенок, родившейся у женщины с таким нарушением, будет неважно учиться, часто болеть и страдать от патологии внутренних органов.
Лечение
Для поднятия гемоглобина важно узнать причину его снижения. Можно заняться самолечением и добавить в свой рацион железосодержащие продукты и витамин В. Но если они не будут полноценно абсорбироваться в ЖКТ, эффекта придется ждать очень долго.
Чаще всего врачи прибегают к консервативной терапии и назначают пациенту железосодержащие медикаменты. Хороший результат показывают «Хеферол», «Ферроплекс» и «Ферлатум». Большинство пациентов потребляет лекарства перорально, но если это проблематично, врачи используют парентеральное введение.
Если пациент склонен к дисфункции ЖКТ, он может параллельно употреблять ферментные и обволакивающие лекарственные средства.
Если медикаментозная терапия не помогает, пациенту могут перелить цельную кровь или эритроцитарную массу.
Высокий гемоглобин: негативные последствия и лечение явления
Высокая концентрация эритроцитов провоцирует нарушение работы всего организма. В первую очередь, это влияет на головной мозг и кровоснабжение тканей. Селезенка, печень и печенка начинают увеличиваться в размерах. Человеческий организм не успевает справляться с негативным влиянием большого количества эритроцитов. Если не предпринимать ни каких действий, человек может умереть.
Лечение
Чтобы подобрать подходящее лечение, пациент должен описать врачу свой образ жизни.
В первую очередь, больному прописывают пить много чистой воды. Употребление воды с высоким содержанием хлора будет только способствовать росту гемоглобина. «Водный» рацион можно разбавлять компотами и соками без сахара.
В меню обязательно должны быть овощи и фрукты, обогащенные клетчаткой.
Важно! Клетчатка нормализует пищеварительные процессы, нарушение которых приводит к накоплению токсинов и самоотравлению организма. Ответной реакцией на это явление считается продуцирование мозгом большого количества эритроцитов.
Человек с высоким гемоглобином должен отказаться от:
- красного мяса,
- печени,
- гречки,
- красных овощей, фруктов и ягод.

Употребление жирных блюд и сладостей должно быть минимальным.
Пациентам нужно больше двигаться и пребывать на свежем воздухе.
Загрузка…
Источник
