Роль гемоглобина в транспорте кислорода и углекислого газа
Гемоглобин. Роль гемоглобина в транспорте кислородаОбычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином. Химический состав гемоглобина представлен в наших остальных статьях, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком Ро2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком Р02, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани. Кривая диссоциации оксигемоглобина. На рисунке приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении Ро2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови. При прохождении через капилляры ткани этот объем снижается до 14,4 мл (Р02 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению Р02 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст. При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 – 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое. Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение Ро2 в мышечной ткани. – Также рекомендуем “Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях” Оглавление темы “Кислород и его доставка в организме”: |
Источник
Одной из основных функций, которые выполняет кровь в организме животного и человека, является дыхательная функция. Кровь, осуществляя транспорт кислорода воздуха от капилляров легочных альвеол к тканевым капиллярам, обеспечивает таким образом бесперебойную доставку кислорода, необходимого для нормального течения жизненно важных процессов в организме.
Переносимый кислород находится в крови в двух состояниях. Небольшая часть кислорода находится в растворенном состоянии в плазме. Коэффициент растворимости кислорода в крови невелик и составляет (при температуре 370 и парциальном давлении кислорода 100 мм ртутного столба) 0,3 об.%. Это значит, что каждые 100 мл нормальной крови могут переносить в растворенном состоянии лишь 0,3 мл кислорода, что явно недостаточно для поддержания жизнедеятельности организма человека.
В процессе эволюции был выработан принципиально другой механизм переноса кислорода кровью. Этот механизм связан с наличием в крови специального сложного белка (хромопротеида), способного обратимо присоединять молекулярный кислород. В организме человека и высших животных таким хромопротеидом является гемоглобин, содержащийся в эритроцитах.
Под обратимым присоединением кислорода понимают способность гемоглобина образовывать с кислородом лабильное соединение (оксигемоглобин).
Гемоглобин присоединяет кислород в среде с высоким парциальным давлением кислорода и отдает кислород в среде с низким парциальным давлением. Каждый грамм гемоглобина в нормальных условиях может присоединять 1,34 мл кислорода. Поскольку нормальное содержание гемоглобина составляет 14,5 – 16 г.%, то 100 мл крови могут переносить в связанном с гемоглобином состоянии 19 – 21 мл кислорода.
Для того чтобы рассмотреть путь кислорода от легких к тканям, необходимо уточнить вопрос о парциальном давлении кислорода.
Парциальное давление кислорода в воздухе равно 152 мм ртутного столба. Это означает, что из 760 мм нормального атмосферного давления, создаваемого смесью газов воздуха, на долю кислорода приходится приблизительно 1/5 часть. Состав альвеолярного воздуха несколько отличается от состава атмосферного воздуха, главным образом за счет повышения содержания углекислоты. Поэтому содержание кислорода и, следовательно, его парциальное давление в альвеолярном воздухе ниже, чем в атмосферном. Парциальное давление кислорода в альвеолярном воздухе равно 106 – 107 мм ртутного столба. В строгом смысле этого слова понятие «парциальное давление» применимо лишь к смесям газов. В литературе, однако, принято говорить о парциальном давлении кислорода в жидкостях (крови, плазме и т.д.). Под этим подразумевается следующее. Растворимость газа в жидкости зависит от парциального давления данного газа над жидкостью. Для идеальных газов растворимость прямо пропорциональна парциальному давлению газов (закон Генри). Во всяком случае каждому значению содержания газа в жидкости соответствует определенное значение его парциального давления над жидкостью, при котором происходило растворение. Поэтому, когда говорят, например, о том, что парциальное давление кислорода в плазме при каких-то условиях равно 90 мм ртутного столба, это означает, что в плазме в растворенном состоянии содержится столько кислорода, сколько его могло раствориться, если бы плазма находилась в контакте с воздухом, в котором парциальное давление кислорода составляло 90 мм ртутного столба. Аналогичные рассуждения справедливы и для кислорода, связываемого гемоглобином, и для кислорода тканевой жидкости. Это следует иметь в виду при рассмотрении значений парциального давления кислорода в тканях и жидкостях организма.
Парциальное давление кислорода в артериальной крови равно 100-85 мм, парциальное давление кислорода в тканевых жидкостях – 10-20 мм, парциальное давление кислорода в венозной крови – 40-50 мм ртутного столба. Из этих цифр становится ясным, что между тканевой жидкостью и кровью, проходящей по тканевым капиллярам, полное равновесие установиться не успевает.
Рассмотрим теперь, как происходит процесс переноса кислорода. В притекающей к альвеолам венозной крови парциальное давление кислорода составляет около 40 мм ртутного столба. Сквозь мембрану капилляров легочных альвеол кровь соприкасается с кислородом при парциальном давлении 106 мм ртутного столба. Поэтому за время прохождения крови по легочным капиллярам происходит диффузия кислорода в кровь. Следует отметить, что при этом весь кислород должен пройти через стадию растворения в плазме.
Действительно, можно считать, что непосредственно с газообразным кислородом (через мембраны) контактирует плазма. Количество кислорода в плазме венозной крови меньше, чем то количество его, которое может раствориться при парциальном давлении кислорода в альвеолярном воздухе. Поэтому в плазме растворяются дополнительные количества кислорода. В результате нарушается динамическое равновесие между кислородом, растворенным в плазме, и кислородом, связанным гемоглобином в эритроцитах. Кислород из плазмы, диффундируя через мембрану эритроцита, дополнительно связывается с гемоглобином. Если бы этот процесс мог идти достаточно долго, то количество кислорода в оттекающей от альвеол артериальной крови должно было бы соответствовать парциальному давлению в альвеолярном воздухе. Однако за время прохождения крови через альвеолы равновесие установиться полностью не успевает, и парциальное давление кислорода в артериальной крови не превышает 100 мм ртутного столба. Как мы увидим в дальнейшем, этот процесс тесно связан с транспортом углекислоты.
Очевидно, оксигенация крови в альвеолах зависит от большого числа фактороз: скорости кровотока, проницаемости мембраны капилляров и эритроцитов, парциального давления кислорода во вдыхаемом воздухе. В норме толщина мембраны легочной альвеолы равна 4m.
В тканевых капиллярах в процессе отдачи кислорода тканям он также проходит стадию растворения в плазме. С тканевой жидкостью через мембрану контактирует непосредственно плазма крови. В связи с тем что в плазме кислорода содержится больше, чем в тканевой жидкости, диффузия кислорода из крови в ткань превышает диффузию из ткани в кровь, и содержание кислорода в плазме уменьшается. Это приводит к нарушению динамического равновесия между содержанием кислорода в плазме и количеством его, связанным с гемоглобином в эритроцитах.
Равновесие оксигемоглобин – гемоглобин смешается в сторону увеличения количества восстановленного гемоглобина. Таким образом, в результате прохождения крови через тканевые капилляры часть кислорода уходит из крови в ткань.
Разница в содержании кислорода в артериальной и венозной крови носит название артерио-венозного различия и для большинства тканей составляет 5-6 об.%.
Максимальное количество кислорода, которое может связать 100 мл крови за счет как связывания гемоглобином, так и растворения в плазме, равно в норме 21 мл. Эта величина носит название кислородной емкости крови и зависит прежде всего от содержания гемоглобина.
Кроме емкости, показателем дыхательной функции крови является содержание кислорода в крови. Как и емкость, эта величина выражается в объемных процентах и соответствует истинному содержанию кислорода в крови при данных конкретных условиях.
Отношение содержания кислорода к емкости, выраженное в процентах, носит название процента насыщения крови кислородом. Ниже приводятся основные характеристики дыхательной функции крови в норме.
Парциальное давление кислорода в атмосферном воздухе составляет примерно 152 мм ртутного столба, в воздухе легочных альвеол – 106-107 мм, в венозной крови – 50-40 мм и в тканях – 0-20 мм.
Содержание гемоглобина у женщин 14,5 г%, у мужчин – 16 г.%. Один грамм гемоглобина может связать 1,34 мл кислорода. Кислородная емкость составляет 21 об.%. Содержание кислорода в артериальной крови 19 об.%, в венозной крови – 14 об.%. Артерио-венозное различие в содержании кислорода для крови и большинства тканей составляет 5 об.%. Парциальное давление углекислоты в атмосферном воздухе составляет 0,2 мм ртутного столба, в воздухе легочных альвеол – 40 мм, в артериальной крови – 40 мм, в венозной крови – 46 мм и в тканях – 40-60 мм.
Таким образом, весь сложный путь от вдыхаемого воздуха через альвеолярные пространства и кровь к тканям кислорода проходит под знаком постепенного падения парциального давления.
Транспорт углекислоты от тканей к альвеолярному воздуху также совершается при постепенном падении парциального давления углекислоты. Парциальное давление кислорода падает:
- а) при поступлении кислорода из внешнего воздуха в систему альвеол, что объясняется наличием там большого количества углекислоты;
- б) при диффузии кислорода через альвеолярную мембрану в артериальную систему.
Учитывая чрезвычайно малую толщину альвеолярной перегородки, можно было бы ожидать, что парциальное давление кислорода в артериальной крови должно быть таким же, как и в альвеолярном воздухе. Но, так как скорость диффузии кислорода через альвеолярную мембрану составляет только 1/20 – 1/30 скорости диффузии углекислоты, кислород проходит не с такой быстротой, чтобы успело выровняться давление по обе стороны. Это и обусловливает различие в парциальном давлении кислорода между артериальной кровью и альвеолярным воздухом.
Итак, парциальное давление кислорода падает при переходе из артериальной системы в венозную и из капиллярной крови в ткани. В крови парциальное давление кислорода создается количеством его, находящимся в состоянии физического растворения, а также кислородом, связанным с гемоглобином крови, «чудесным веществом» (Баркрофт), обладающим способностью воспринимать из воздуха большие количества кислорода и по мере прохождения через капилляры легко и быстро отдавать его тканям. Тем не менее и кислород, растворенный в плазме, является чрезвычайно важным элементом в кислородном бюджете организма. С одной стороны, он находится почти в полном равновесии с альвеолярным воздухом, с другой – определяет снабжение эритроцитов кислородом. Соотношение давлений кислорода в капиллярной крови и в тканях указывает на дальнейшее его падение при переходе в ткань. В тканях давление кислорода оказывается ниже, а давление СО2 выше, чем в крови.
Способы, позволяющие непосредственно определять давление кислорода в тканях, отсутствуют, поэтому для суждения о нем приходится пользоваться косвенными методами. В настоящее время принято считать, что парциальное давление кислорода в разных тканях различно, будучи обусловлено функциональной способностью ткани. Количество кислорода, доставляемое тканям, значительно превосходит количество, воспринимаемое ими. Ткани обладают специальными механизмами, регулирующими парциальное давление кислорода в них соответственно их потребностям.
Таким образом, переход кислорода из альвеолярного воздуха в кровь есть результат простой диффузии. Давление кислорода в артериальной крови всегда ниже, чем в альвеолярном воздухе. Давление кислорода в тканевой жидкости зависит от количества его, находящегося в растворенном виде, что в свою очередь обусловлено жизнедеятельностью тканей, сопровождающейся постоянным понижением парциального давления кислорода в тканевой жидкости.
Одной из основных функций, которые выполняет кровь в организме животного и человека, является дыхательная функция. Кровь, осуществляя транспорт кислорода воздуха от капилляров легочных альвеол к тканевым капиллярам, обеспечивает таким образом бесперебойную доставку кислорода, необходимого для нормального течения жизненно важных процессов в организме.
В процессе эволюции был выработан принципиально другой механизм переноса кислорода кровью. Этот механизм связан с наличием в крови специального сложного белка (хромопротеида), способного обратимо присоединять молекулярный кислород. В организме человека и высших животных таким хромопротеидом является гемоглобин, содержащийся в эритроцитах.
Под обратимым присоединением кислорода понимают способность гемоглобина образовывать с кислородом лабильное соединение (оксигемоглобин).
Весь сложный путь от вдыхаемого воздуха через альвеолярные пространства и кровь к тканям кислорода проходит под знаком постепенного падения парциального давления.
Парциальное давление кислорода падает при переходе из артериальной системы в венозную и из капиллярной крови в ткани. В крови парциальное давление кислорода создается количеством его, находящимся в состоянии физического растворения, а также кислородом, связанным с гемоглобином крови, «чудесным веществом» (Баркрофт), обладающим способностью воспринимать из воздуха большие количества кислорода и по мере прохождения через капилляры легко и быстро отдавать его тканям. Тем не менее и кислород, растворенный в плазме, является чрезвычайно важным элементом в кислородном бюджете организма. С одной стороны, он находится почти в полном равновесии с альвеолярным воздухом, с другой – определяет снабжение эритроцитов кислородом. Соотношение давлений кислорода в капиллярной крови и в тканях указывает на дальнейшее его падение при переходе в ткань. В тканях давление кислорода оказывается ниже, а давление СО2 выше, чем в крови.
Переход кислорода из альвеолярного воздуха в кровь есть результат простой диффузии. Давление кислорода в артериальной крови всегда ниже, чем в альвеолярном воздухе. Давление кислорода в тканевой жидкости зависит от количества его, находящегося в растворенном виде, что в свою очередь обусловлено жизнедеятельностью тканей, сопровождающейся постоянным понижением парциального давления кислорода в тканевой жидкости.
Источник
Основная функция гемоглобина – транспорт кислорода, которую онвыполняет очень эффективно. Гемоглобин артериальной крови насыщен кислородом приблизительно на 96%, гемоглобин венозной крови – на 64% (White А. et al, 1981).
Уменьшение степени насыщения на 32 % соответствует количеству О2, потребляемому тканями. Принимая, что 100 мл крови содержат 15,0 г гемоглобина и что каждый грамм гемоглобина может связать 1,34 мл О2 (число Хюфнера) находим, что:
0,96 х 1,34 х 15 = 19,2 мл О2 –
транспортируется 100 мл артериальной крови (19,2 объемных %);
0,64 х 1,34 х 15 = 12,8 мл О2 –
транспортируется 100 мл венозной крови (12,8 объемных %);
19,2 – 12,8 = 6,4 мл О2 (6,4% объемных %)
или
0,32 х 1,34 х 15 = 6,4 мл О2 (6,4 % объемных %)
отдается тканям каждыми 100 мл артериальной крови, протекающими через капилляры.
Поскольку минутный объем крови (МОК) равен 5 литрам, в сутках 1440 минут, определяем, что в течение суток общий объем перекачиваемой сердцем крови составит:
5 х 1440 = 7200 литров
А так как один литр артериальной крови способен транспортировать 19,2 объемных % кислорода, из которых 6,4 объемных процента потребляются тканями, находим:
7200 х 19,2
———————– = 1382 литра – количество кислорода, транспортируемое
100 за сутки артериальной кровью
7200 х 6,4
———————– = 461 литр – количество кислорода, потребляемое тканями
100 за сутки из артериальной крови
В целом, за сутки кровь переносит от легких к тканям около 1400 л кислорода, из которых 450-600 л потребляются тканями. Причем, практически весь перенос кислорода обеспечивается гемоглобином, т.к. кислород плохо растворим в водных растворах. Ограниченная растворимость кислорода позволяет транспортировать его в растворенном состоянии в количестве, составляющем всего 0,3 мл О2 / 100 мл крови (White А. еt al, 1981) при РаО2 равном 12,7 кПа (95 мм рт ст). Это соотношение вытекает из закона Генри-Дальтона, в соответствии с которым «количество растворенного в жидкости газа пропорционально его напряжению». Важно отметить, что несмотря на малое количество растворенного кислорода, именно эта его фракция обусловливает РаО2.
Гемоглобин растворен в водном цитозоле эритроцитов в очень высокой концентрации, порядка 34%. Его синтез осуществляется в процессе созревания ретикулоцитов и перехода их в эритроциты. Гемоглобин состоит из белка – глобина и простетической группы – гема. Гем представляет собой соединение, в молекулу которого входят атом двухвалентного железа и 4 замещенных пиррольных кольца, связанных между собой метиновыми группами ( – СН = ). Скелетом молекулы гема служит порфирин. Fe2+ имеет в геме координационное число, равное 6, т.е. 6 пар электронов. Четыре из этих пар связаны с атомами азота, одна пара с белком (глобином) через гистидин. Оставшаяся пара электронов используется для образования донорско-акцепторной координационной связи (ковалентной химической связи) с кислородом (рис. 12).
Функциональные свойства гемоглобина, обусловленные его уникальной структурой, специфически соответствуют задачам обеспечения дыхательной функции. Каждая из четырех полипептидных цепей глобина содержит по одной молекуле гема. А поскольку атом железа в геме может обратимо связывать одну молекулу О2 понятно, что одна молекула полностью оксигенированного гемоглобина (НbО2) содержит четыре молекулы кислорода.Гемоглобин, отдавший кислород тканям, называется свободным (неоксигенированным) гемоглобином.
Рис. 12.Координационные связи железа в молекуле гема
(по A. Ленинджеру, 1985)
В процессе присоединения и отдачи кислорода железо в молекуле гемоглобина свою валентность не меняет, т.е. при присоединении кислорода или при его отдаче железо не окисляется и не восстанавливается. Следовательно, в этих случаях речь идет об оксигенированном (оксигемоглобин) и неоксигенированном (свободном) гемоглобине, но не об окисленном и восстановленном гемоглобине.
Окисленный гемоглобин – это метгемоглобин (MetHb), содержащий Fe3+. Он не способен присоединять кислород, однако Fe3+ в MetHb может взаимодействовать со многими анионами, например, при щелочном рН с ОН- и при кислом рН – с Cl-. В небольшом количестве, составляющем 0, 5% от всего гемоглобина, метгемоглобин образуется ежесуточно в условиях in vivo (White A. et al, 1981).
Кроме кислорода к атому железа в молекуле гемоглобина могут присоединяться и другие вещества (лиганды) : Н2О; СО; СN. Их сродство, проявляемое к атому железа, неодинаково. Оно наиболее выражено у цианидов, затем у окиси углерода, затем у кислорода и наименее выражено у воды.
Степень насыщения гемоглобина кислородом зависит от парциального давления кислорода (РО2). Это давление в легких ( 100 мм рт.столба) достаточно, чтобы практически полностью оксигенировать весь гемоглобин в эритроцитах. Уникальной особенностью связывания гемоглобином О2 является кооперативное взаимодействие между гемсвязывающими участками, получившее название гем-гем – взаимодействие. И хотя прямых физических контактов между четырьмя группами гема нет, кооперативность связывания О2 проявляется в том, что по мере протекания оксигенирования гемоглобина облегчается связывание последующих молекул кислорода. При физиологических условиях сродство к О2 у гемоглобина и у полностью оксигенированного гемоглобина отличается в 500 раз (A. White et al, 1981); это показывает, что после присоединения первых молекул О2 сродство частично насыщенного гемоглобина к кислороду увеличивается.Данное положение характеризуетсясигмовидной формой кривой диссоциации HbO2 (рис. 5).Такая формауказывает на то, что связывание О2 одной из гемовых групп гемоглобина влияет на константы диссоциации других гемовых групп этой же молекулы. Сигмовидный характер кривой диссоциации НbО2 имеет большое физиологическое значение. Как видно из рис. 5 парциальное давление О2 существенно влияет на насыщение гемоглобина в пределах от 20 до 60 мм рт. ст., когда показатель насыщения кислородом характеризуется наиболее крутым подъемом отрезка кривой. При больших значениях РО2 кривая насыщения приобретает пологий характер, увеличиваясь в диапазоне 60-90 мм рт. ст. всего на 7%.
Связывание гемоглобином кислорода зависит не только от РО2. Этот процесс тонко регулируется рядом соединений, подобно тому как это имеет место при действии на аллостерический фермент.Таким регуляторным действием обладают 2,3 – дифосфоглицерат, диоксид углерода (СО2) и ионы Н+.
Главной фракцией фосфатов в эритроцитах является 2,3 – дифосфоглицерат (ДФГ); его внутриклеточная концентрация составляет приблизительно 4-5 – ммоль, т.е. сопоставима с концентрацией гемоглобина. Дифосфоглицерат (ДФГ) связывается с тетрамерным гемоглобином при нейтральном рН, образуя комплекс с соотношением компонентов 1 : 1. Связывание с гемоглобином ДФГ обусловлено наличием в молекуле последнего отрицательно заряженных групп (рис. 13):
-О О
С
Н С О Р О-
Н С Н
О
О Р О
О-
Рис. 13. Структура молекулы ДФГ(по А. Ленинджеру, 1985).
Жирным выделены группы, взаимодействующие с β-цепями
Местом связывания служит центральная полость или канал в молекуле гемоглобина, выстланный многочисленными положительно заряженными R-группами β-цепей. В итоге образуется поперечная связь между двумя β-субъединицами. При связывании гемоглобина кислородом ДФГ вытесняется из этого канала.
Главным результатом образования комплекса ДФГ-гемоглобин является снижение сродства гемоглобина к кислороду:
НbO2 + ДФГ Нb • ДФГ + О2
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. Чем ниже это давление (при подъеме на высоту), тем выше концентрация ДФГ в эритроцитах, тем легче будет освобождаться кислород от связи с гемоглобином в тканях.
Таким образом, при фиксированной концентрации оксигенированного гемоглобина, увеличение концентрации ДФГ повышает диссоциацию НbO2. При увеличении же РО2 и росте концентрации НbО2 будет усиливаться диссоциация комплекса Нb ДФГ.
Повышенное сродство крови плода к кислороду не является следствием различий сродства фетального (НbF) и постнатального (НbA) гемоглобинов к О2, поскольку кривые диссоциации изолированных НbАО2 и НbFO2 существенно не отличаются. Этот феномен повышенного сродства к кислороду крови плода является результатом менее эффективного связывания ДФГ фетальным гемоглобином, поскольку на ДФГ – связывающем участке НbF незаряженный Sery γ 143 заменяет His β 143.
В крови, консервированной в некоторых средах (цитрат-декстрозной) концентрация ДФГ снижается (в течение 10 дней с 4,5 до 0,5 мМ). Гемоглобин такой крови приобретает очень высокое сродство к кислороду, в связи с чем увеличивается риск развития гипоксии, обусловленной снижением отдачи им кислорода. Тем более, что восстановление содержания ДФГ самими эритроцитами происходит медленно (за 24 часа – до половины нормальной концентрации). Исправление ситуации путем добавления экзогенного ДФГ не эффективно, поскольку высокий отрицательный заряд его молекулы не позволяет ей проникать через мембрану эритроцитов. В связи с этим используются вещества, добавление которых к консервированной крови обеспечивает поддержание нормальной концентрации ДФГ (Волкова Н.П., 2005).
Способность гемоглобина взаимодействовать с СО2 и ионами Н+ определяется не наличием атома Fe2+ в гемах, а другими участками его молекулы, с которыми происходит связывание этих соединений. В частности, ионы водорода присоединяются к R – группам остатков гистидина в α и β – цепях глобина :
R CH COOH (общая формула аминокислоты)
NH2
R – группа, с которой связывается
ион водорода.
Что касается диоксида углерода, то он присоединяется к концевой α-аминогруппе каждой из четырех полипептидных цепей с образованием карбаминогемоглобина:
O O
R CH C + CO2 R CH C
OH OH
NH2 NHCOO- + H+
карбаминоконцевой остаток
( карбаминогемоглобин )
Важно подчеркнуть, что процессы связывания с гемоглобином О2, Н+ – ионов и СО2 (как и ДФГ) взаимозависимы. Эту взаимозависимость иногда называют кооперативным эффектом гемоглобина, который заключается в том, что изменение концентрации одного из этих веществ влияет на связывание гемоглобина с другими. В частности,связывание с гемоглобином СО2 и ионов водорода снижает его способность связывать кислороди наоборот:связывание с гемоглобином кислорода снижает его способность связывать СО2 и ионы Н+.Поэтому в периферических тканях с относительно низким значением рН и высокой концентрацией СО2 сродство Нb к кислороду падает по мере связывания СО2 и ионов водорода. И наоборот, в легочных капиллярах выделение СО2 и сопутствующее ему повышение рН крови приводят к увеличению сродства гемоглобина к кислороду. Это влияние величины рН и концентрации СО2 на связывание и освобождение кислорода гемоглобином называется эффектом Бора(в честь датского физиолога Христиана Бора, впервые открывшего его).
В основе данного эффекта лежит изменение четвертичной структуры (т.е. упаковки субьединиц молекулы белка) гемоглобина при его оксигенации. В результате молекула оксигенированного гемоглобина приобретает несколько более компактную структуру по сравнению с неоксигенированным. Вследствие этого аминокислотные остатки в α и β – цепях, связывающие ионы водорода, перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщепление ионов водорода от протонированных групп. Иначе говоря, протонированные группы при оксигенации гемоглобина приобретают свойства более сильных кислот (как донаторов ионов водорода). Т.е. НbО2 более сильная кислота (в 70 раз – Войнов В.А., 1992), чем ННb. Можно сказать и так, что оксигенированный гемоглобин (НbO2) плохо присоединяет протоны, но зато легко их отдает. А неоксигенированный гемоглобин наоборот – плохо отдает протоны, но зато легко их присоединяет (ННb).
В легочной ткани вследствие уменьшения РСО2 и превращения гемоглобина в НbО2 освобождается также СО2, находящийся в виде карбаминогемоглобина..
Повышение или снижение сродства Hb к кислороду проявляется изменением кривой диссоциации оксигемоглобина (рис. 14).
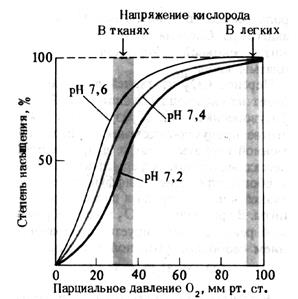
Рис. 14.Кривая диссоциации оксигемоглобина. Влияние рН(по A. Ленинджеру, 1985)
Эти изменения обозначаются понятием «сдвиг вправо» и «сдвиг влево». При сдвиге вправо, как это следует из рисунка, при снижении рН (рН = 7,2), 50% насыщение Hb кислородом, которое в норме происходит при значениях РаО2 ≈ 26,6 мм рт. ст, будет осуществляться уже при больших значениях РаО2, приближающихся к 40 мм рт. ст. Это означает, что сродство Hb к кислороду понизилось. Соответственно, при сдвиге влево (рН = 7,6) 50% насыщение Hb кислородом происходит при меньших, чем при нормальном рН значениях РаО2. Это означает, что сродство Hb к кислороду оказалось повышенным. Помимо кислотно-основного состояния на характер кривой диссоциации оксигемоглобина влияют и другие факторы (табл. 3).
Таблица 3.
Источник