Русский медицинский журнал анемия
В последнее время, на наш взгляд, стало излишне распространенным применение в описании многих заболеваний терминов «чума XXI века», «эпидемия, охватившая мир» и т.д. Мы прекрасно осознаем, что именно резкая динамика роста давно известных нозологических форм (ИБС, гипертоническая болезнь, сахарный диабет, ХОБЛ, онкология) заставляют нас обращаться к столь высокопарной риторике. Что же тогда говорить о таких распространенных заболеваниях как анемия, знакомых человечеству с незапамятных времен? Как же тогда можно охарактеризовать заболевание, упоминаемое практически с момента существования человечества, так как основные звенья его патогенеза фактически заложены в жизнедеятельности любого здорового человека? Речь идет о малокровии, анемии и самой распространенной ее форме – железодефицитной анемии.
Немного истории
Железодефицитная анемия (наиболее распространенная из всех анемий) впервые описана в XVI столетии под названием morbus virginum (поскольку обнаруживалась у девушек в 14–17 лет) и chlorosis, или зеленая болезнь. Железодефицитная природа хлороза впервые отмечена Sydenham в XVIII столетии, когда была признана связь анемии, гипохромии и железодефицита. Так, в 1832 г. Pierre Blaud сообщил о положительных результатах лечения хлороза сернокислым железом. В 1866 г. Perls внедрил в практику реакцию на прусскую лазурь в целях выявления тканевого железа, которая в дальнейшем была дополнена внедрением в клиническую практику метода Гейльмайера и Плотнера для определения железа в сыворотке.
Обмен железа в организме
По данным Jacobs, Worwood (1974), в организме человека массой тела 70 кг имеется 4,5 г железа. Железо как биометалл играет важную роль в митозе клеток, окислительно–восстановительных реакциях, в синтезе ДНК и т.д. В организме его содержание можно условно разделить на клеточное, неклеточное и железо запаса. Клеточное железо выявляется в следующих соединениях.
1. В первую очередь, в гемопротеинах, основным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза и пероксидаза).
2. Железосодержащие ферменты негеминовой группы (сукцинатдегидрогеназа, ацетил–коэнзим–А–дегидрогеназа, НАДН–цитохром, С–редуктаза и т.д.).
Внеклеточное железо представлено белками трансферрином и лактоферрином, содержащимися во внеклеточном пространстве, осуществляющими транспортную функцию по отношению к ионам железа. Трансферрин – белок плазмы крови, относящийся к b–глобулинам. У людей основным источником синтеза является печень. За сутки производится до 12–14 мг белка на 1 кг массы тела, что соответствует 5–9% от всего количества трансферрина. Лактоферрин – белок, также относящийся к семейству трансферринов, переносящий ионы трехвалентного железа.
Железо запаса – белковые соединения ферритин и гемосидерин – с преимущественным отложением в печени, селезенке и мышцах. Задействуется при недостатке клеточного железа. Наибольшее количество железа (за вычетом крови) содержится в следующих органах: селезенка (336 мкг/г), легкие (319 мкг/г), печень (195 мкг/г), мышцы (до 27,9%, в виде миоглобина 21,9%, ферритина 6,91%), печень (7,8%, ферритин, гемосидерин).
Существует и лабильный пул железа – от 80 до 90 мг: железо, покидающее плазму крови, проходящее в интерстициальное пространство, в межклеточные промежутки, где оно может связываться с клеточной мембраной, а может возвращаться обратно в плазму крови.
Источником железа в организме является пищевое железо, всасывающееся в желудочно–кишечном тракте в наибольшей концентрации в 12–перстной кишке и проксимальных отделах тощей кишки. В желудке адсорбируется только негемовое железо, содержание которого составляет около 20%. Гемовое (содержащее протопорфирин) железо в эпителиоцитах распадается на ионизированное железо, окись углерода и билирубин. В тонкой кишке железо захватывается энтероцитами, всасывается в кровь, оставляя небольшой запас в депо слизистой оболочки тощей кишки. В соединении с трансферрином транспортируется в эритрокариоциты, проникая в клетку, участвует в образовании всех вариантов клеточного железа.
Организм самостоятельно регулирует поступление железа из слизистой оболочки в кровь. При нормальных показателях железа в организме значительная его часть проходит через слизистую оболочку кишки в ток крови, определенная часть задерживается в слизистой. При снижении показателей железа в слизистой задерживается меньшая часть, большая устремляется в плазму крови. В противном случае (повышение показателей железа) в слизистой остается большее количество железа, клетка, насыщенная железом, со временем смещается к концу ворсинки, слущивается и выводится с калом вместе с невсосавшимся железом.
Усвоение пищевого железа напрямую зависит от состава самой пищи. Наличие в ней янтарной, аскорбиновой, лимонной кислот, а также фруктозы, сорбита, метионина и цистеина ускоряют заданный процесс, напротив, фосфаты, фитаты, оксалаты, препараты кальция и содержащие кальций продукты (творог, молоко) тормозят. Наибольшими по содержанию железа (в мг на 100 г продукта) продуктами являются печень говяжья – 9,8 мг, соль поваренная – 10,0, крупа гречневая – 8,0, язык говяжий – 5,0, фасоль – 12,4, горох – 9,4.
Однако количество железа в продукте питания не корреллирует с его способностью к всасыванию в желудочно–кишечном тракте, что объясняется лучшим усвоением железа в виде гема. Так, из продуктов питания растительного происхождения до 7% от содержания железа усваивается из бобов сои, из фруктов – не более 3%, мясные продукты обладают большим процентом усвоения – до 22% железа из телятины (телятина содержит до 90% железа в виде гема), до 11% из рыбных изделий (железо преимущественно в виде ферритина и гемосидерина).
Физиологическое всасывание железа из пищи ограничено. При полноценном питании взрослый мужчина получает в день до 18 мг железа, из которого усваивается только 1–1,5 мг, у женщин при 12–15 мг поступления усвоение коснется только 1–1,3 мг железа. По данным Гуревича М.И. (1977), в норме гемовое железо всасывается у мужчин до 16,9+1,6%, у женщин 13,6+1,1%.
Максимальное количество всасываемого железа не превышает 2–2,5 мг. К этому прибавляется 21 мг железа из разрушенных эритроцитов, 11 мг – из пула костного мозга, 1 мг – из депо. Суммарно до 35 мг в сутки.
Расходы складываются из следующих величин: синтез гемоглобина (17–40 мг), физиологические потери (с калом, мочой, потом, слущивающимся эпителием кожи – не более 1 мг). Расходы практически полностью покрываются поступлением железа, при условии отсутствия повышенных потребностей в нем, снижения его поступления и увеличения потерь. В числовом варианте это соответствует потере более 2 мг в сутки.
Снижение поступления железа в организм напрямую связано с пищевым рационом и возникает при общем голодании, уменьшении продуктов питания, содержащих железо, патологии 12–перстной кишки и проксимальных отделов тонкого кишечника (либо резекция данных отрезков желудочно–кишечного тракта).
Потери железа четко ассоциируются с кровопотерями, в первую очередь теми, которые считаются физиологическими – у менструирующих женщин. У 10–25% женщин, которые считают себя практически здоровыми, во время менструации теряется более 40 мг железа, у 5% объем теряемой крови за цикл превышает 90 мл (45 мг железа). При обильных и длительных кровопотерях их величина достигает 100–500 мл крови (50–250 мг железа). Суточная потребность в железе у женщин, теряющих 30–40 мл крови за 1 цикл, 1,5–1,7 мг. В ситуации обильной кровопотери потребность возрастает до 3 мг/сут., но такое количество железа не может быть усвоено из пищи. Создается дефицит, который из мизерного количества за одни сутки (0,5–1 мг), увеличивается за месяц до 15–20 мг, за год до 189–240 мг, в течение 10 лет возрастает до 1,8–2,4 г. Срок же репродуктивной функции женского организма (а значит, и менструальных кровопотерь) не менее 40 лет. Следовательно, к возрасту 42–45 лет женщина подходит уже с выраженным дефицитом железа, хотя патологических процессов в состоянии здоровья не определяется.
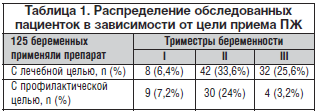
У мужчин физиологических кровопотерь не бывает. Поэтому дефицит железа объясняется патологическими процессами, сопровождающимися кровотечением. Поиск имеет смысл начинать с исследования желудочно–кишечного тракта (язвенная болезнь желудка и 12–перстной кишки, опухоли, дивертикулы различной локализации, глистные инвазии, эрозии слизистой, грыжи пищеводного отверстии диафрагмы, анкилостомидоз) (табл. 1).
Реже встречаются железодефицитные анемии, обусловленные кровопотерей в замкнутые пространства с последующим нарушением реутилизации железа. Примерами могут служить легочный сидероз с постоянной кровопотерей в легочную ткань, и эндометриоз, не связанный с полостью матки. В этих случаях кровотечение во время менструации происходит в замкнутую полость, чаще всего расположенную эктопически.
Третьей причиной формирования дефицита железа является возрастание расходования железа организмом: беременность, лактация, детский и подростковый возраст.
Развитие дефицита железа у детишек младшего возраста развивается, как правило, внутриутробно вследствие многоплодной беременности, при недоношенности. Кроме того, способствующими факторами, могут являться дефицит ферментов кишечника, необходимых для усвоения железа из молока матери.
Дальнейший рост детей увеличивает расходную статью железа, причем и девочки, и мальчики оказываются в одинаковой ситуации. В пубертатный период кровопотери в сочетании с эстрогенным воздействием на эритропоэз и утилизацию железа (некоторое торможение) создают условия для формирования железодефицита у представительниц слабого пола. Беременность и лактация – физиологические состояния, присущие женскому организму, к сожалению, в 100% случаев сопровождаются железодефицитом в организме женщины и возможным в дальнейшем развитием железодефицитной анемии. Последнее заключение особенно важно, так как диагноз железодефицитной анемии должен основываться на лабораторных анализах крови. Периферическая кровь реагирует на истощение депо железа в последнюю очередь, в то время как перераспределение запасов железа между организмом матери и плода происходит в обязательном порядке (табл. 2).
Кроме того, благодаря компенсаторным механизмам, улучшающим эффективность снабжения кислородом, симптомы, обусловленные тканевой гипоксией, могут не проявляться вплоть до падения уровня гемоглобина ниже 80 г/л (двумя адаптационными важнейшими механизмами являются увеличение сердечного выброса и усиленное освобождение кислорода в тканях, происходящее в результате повышенной концентрации в эритроцитах 2–3–дифосфоглицериновой кислоты – 2–3–ДФГ).
Распространенность железодефицитных состояний
Статистические данные подтверждают высокую распространенность дефицита железа среди населения – до 200 млн человек в мире. Частота ЖДА достигает 98% среди всех анемий. Группами риска являются исходя из особенностей обмена, женщины детородного возраста, беременные, кормящие, дети младших возрастных групп. Скрытый дефицит железа у беременных достигает, по данным ВОЗ, 100%, анемия – от 21 до 80%. Нехватка железа в организме беременной женщины чревата развитием гипоксии с дальнейшей цепочкой вторичных метаболических расстройств, в том числе фетоплацентарной недостаточностью.
В I триместре потребность железа составляет 0,6–0,8 мг/сут., не отличаясь от такового до беременности, во II триместре увеличивается до 2–4 мг/сут., в III – до 12 мг/сут. За весь гестационный период на кроветворение расходуется 500 мг железа, на потребности плода – 280–290 мг, плаценты – от 25 до 100 мг. К концу беременности в фетоплацентарном комплексе сосредотачивается около 450 мг железа, в увеличенном объеме крови – до 500 мг. При родах физиологическая потеря составляет 150 мг, лактация забирает до 400 м. Суммарная величина потери железа к окончанию неосложненной беременности составляет 1200–1400 мг.
По степени тяжести анемии разделяют:
Легкая степень 110–91 г/л
Среднетяжелая степень 90–81 г/л
Тяжелая степень менее 80 г/л
У беременных понижение показателя гемоглобина до 110–100 г/л не говорит о патологических изменениях и объясняется физиологическим увеличением объема крови, гемоделюцией. Анемическим порогом является 100–96 г/л (эритроциты – 3,0 млн), тяжелая форма анемии оценивается с 60 г/л.
Лечение
Лечение ЖДА проводится только препаратами железа, имеющими большую всасываемость в желудочно–кишечном тракте в сравнении с пищевым железом.
Препараты, применяемые в терапии, должны помимо 2–валентного железа содержать аскорбиновую кислоту, способствующую его усвоению. Адекватный гемопоэз невозможен без участия фолиевой кислоты и витамина В12. Оба компонента усиливают синтез ДНК в кроветворных клетках, а также регулируют весь цикл метаболизма железа в организме.
Профилактика анемии прежде всего требуется беременным с высоким риском развития малокровия. К ним могут быть отнесены:
– женщины, прежде болевшие анемией;
– женщины, имеющие хронические инфекционные болезни или хронические заболевания внутренних органов;
– много рожавшие женщины;
– беременные с уровнем гемоглобина в I триместре меньше 120 г/л;
– беременные с многоплодием;
– беременные с явлениями токсикоза;
– женщины, у которых в течение многих лет менструации продолжались более 5 дней.
Профилактический прием препарата происходит в дозе 1–2 капсулы в день в течение 4–6 мес., начиная с 12–14–й недели беременности.
Литература
1. Баркаган З.С., Идельсон Л.И., Воробъев.А.И. Руководство по гематологии. М.: Медицина, 1985.
2. Берчану Шт. Клиническая гематология. Бухарест. 1985 г.
3. Буданов П.В. Проблемы профилактики и лечения железодефицитных анемий у беременных. Журнал «Трудный пациент». №8. 2009.
4. Верткин А.Л., Городецкий В.В., Годулян О.В. Сравнительная эффективность и переносимость различных железосодержащих препаратов у больных железодефицитной анемией. Med links.2006 г.
5. Гороховская Г.Н. Медицинский вестник. № 22,2008 г.
6. Гурвич М.И., Щерба М.М., Рысс Е.С., Шапиро Э.Л. Всасывание гемоглобинового железа при железодефицитной анемии. Проблемы гематологии. 1973, 33
7. М.Дж. Денхэм, И.Чанарин. Болезни крови у пожилых. М.:Медицина, 1989.
8. Идельсон Л.И. Гипохромные анемии. М.,1981.
9. Коколина. В.Ф. Ферро–Фольгамма в лечении железодефицитной анемии у больных с ювенильными маточными кровотечениями. М. Gastro portal.
10. Мадьяр И. Дифференциальная диагностика заболеваний внутренних органов. Будапешт. 1987 г.
Источник

Для цитирования. Логутова Л.С. Анемия у беременных: вопросы этиологии, диагностики и лечения // РМЖ. 2016. No 5. С. 290–293.
Структура заболеваемости беременных женщин практически не меняется на протяжении десятков лет. Самое распространенное гематологическое заболевание в период гестации — это анемия [3].
Анемия — клинико-гематологический синдром, обусловленный снижением концентрации гемоглобина и, в большинстве случаев, эритроцитов в единице объема крови и их морфологическими изменениями.
Диагностика истинной анемии у беременных представляет определенные трудности. Это обусловлено тем, что во время беременности увеличиваются объем циркулирующей крови и его составляющих, объем плазмы и объем эритроцитов, причем объем плазмы возрастает в большей степени (почти в 2 раза). Происходит разведение эритроцитов в большом количестве жидкости, относительное уменьшение их числа при абсолютном увеличении объема плазмы. Это состояние называется гидремией и не является анемией, хотя наблюдается закономерное снижение показателей красной крови, но при этом отсутствуют морфологические изменения эритроцитов.
Допустимым пределом физиологической гемодилюции при беременности считается снижение показателя гематокрита до 0,32, гемоглобина – до 100 г/л, эритроцитов – до 3,5×1012/л. Дальнейшее снижение показателей красной крови следует расценивать как истинную анемию.
Компенсаторное значение гемодилюции беременных состоит в том, что облегчается обмен питательных веществ и газов через плаценту, а при кровопотере истинная потеря эритроцитов уменьшается примерно на 20%.
Клиническая гидремия беременных протекает бессимптомно и лечения не требует. С окончанием беременности быстро (в течение 1–2 нед.) восстанавливается нормальная картина крови.
Различают анемии, диагностируемые во время беременности, и догестационные.
Некоторые клиницисты склонны подразделять анемию на «анемию беременных» и «анемию у беременных», подразумевая в первом случае заболевание, развивающееся во время беременности, а во втором – малокровие, существовавшее еще до гестационного процесса.
По литературным данным, во второй половине гестации анемия диагностируется почти в 40 раз чаще, чем в первые недели, что, несомненно, связано с нарушением гемопоэза из-за изменений, вызванных беременностью [3].
При беременности развитие анемии связано с гормональными изменениями, развитием ранних токсикозов, препятствующих всасыванию в желудочно-кишечном тракте элементов железа, магния, фосфора, необходимых для кроветворения. Одной из основных причин является прогрессирующий дефицит железа, связанный с его утилизацией на нужды фетоплацентарного комплекса (ФПК), для увеличения массы циркулирующих эритроцитов. Анемию беременных также связывают с нарушением перекисного окисления липидов (ПОЛ) [1, 2].
У 9 из 10 пациенток во время беременности диагностируется железодефицитная анемия (ЖДА). Частота ЖДА во время беременности, по разным данным, колеблется от 21 до 80% (если судить по уровню гемоглобина) и от 49 до 99% (по уровню сывороточного железа). ЖДА – заболевание, на первый взгляд, безобидное, но ведущее к многочисленным осложнениям для матери, новорожденного и здоровья в течение всей последующей жизни ребенка. Проблема ЖДА у женщин в период гестации остается актуальной, поскольку осложняет течение беременности, родов и послеродовый период [2].
ЖДА – патологическое состояние, характеризующееся нарушением синтеза гемоглобина в результате дефицита железа, развивающееся на фоне различных патологических или физиологических (беременность) процессов. По данным ВОЗ, частота ЖДА среди беременных колеблется от 14% в странах Европы до 70% в Юго-Восточной Азии. В странах с высоким уровнем жизни населения ЖДА диагностируется у 18–25% беременных женщин, в развивающихся странах частота железодефицита при беременности может достигать 80%. Частота данного осложнения беременности в России стабильно на протяжении 15 лет составляет 30–40% [6].
Следует отметить, что у 20–25% женщин выявляется латентный дефицит железа. Так, дефицит железа в III триместре беременности обнаруживается почти у 90% женщин и сохраняется после родов и лактации у 55% из них [1, 4, 9].
Во время беременности железо усиленно расходуется вследствие интенсификации обмена веществ: в I триместре потребность в железе не превышает потребности до беременности и составляет 0,6–0,8 мг/сут; во II триместре – увеличивается до 2–4 мг/сут; в III триместре – до 10–12 мг/сут [7].
К концу беременности неизбежно наступает обеднение железом организма матери в связи с депонированием его в ФПК (около 450 мг), с увеличением объема циркулирующей крови, на что затрачивается около 500 мг, в послеродовом периоде – в связи с физиологической кровопотерей в 3-м периоде родов (100–150 мг) и лактацией (400 мг). Суммарная потеря железа к окончанию беременности и лактации составляет 1200–1400 мг [5].
Для своевременной диагностики и лечения ЖДА необходимо учитывать риск развития этого осложнения у различных групп беременных:
– перенесенные заболевания (частые инфекции): острый пиелонефрит, дизентерия, вирусный гепатит;
– экстрагенитальная фоновая патология (хронический тонзиллит, хронический пиелонефрит, ревматизм, пороки сердца, сахарный диабет, гастрит);
– меноррагии;
– частые беременности;
– наступление беременности при лактации;
– беременность в подростковом периоде;
– анемия при прошлых беременностях;
– вегетарианская диета;
– уровень Hb в I триместре беременности <120 г/л;
– осложнения беременности (ранний токсикоз, вирусные заболевания, угроза прерывания);
– многоплодная беременность.
Выявлено, что при ЖДА отмечается усиление процессов ПОЛ без активации антиоксидантной системы защиты, что приводит к повреждению мембранных структур клеток ФПК.
При дефиците железа у беременных возникает прогрессирующая гемическая гипоксия с последующим развитием вторичных метаболических расстройств. Поскольку при беременности потребление кислорода увеличивается на 15–33%, это усугубляет развитие гипоксии. У беременных с тяжелой степенью ЖДА развивается не только тканевая и гемическая гипоксия, но и циркуляторная, обусловленная развитием дистрофических изменений гипокинетического типа кровообращения.
Анемия осложняет течение беременности и родов. Истинные анемии беременных могут сопровождаться нарушением коагуляционных свойств крови, что является причиной массивных кровопотерь; оказывают неблагоприятное влияние на развитие сократительной деятельности матки; возможны длительные затяжные или быстрые и стремительные роды.
Беременные с ЖДА нуждаются в медикаментозном лечении и диетическом питании. Но невозможно купировать ЖДА лишь диетой, состоящей из богатых железом продуктов, без препаратов железа (ПЖ). Из лекарственных препаратов в организме может усвоиться в 15–20 раз больше железа, чем из пищи.
В настоящее время в распоряжении врача имеется большой арсенал лекарственных ПЖ, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов (аскорбиновая и янтарная кислоты, витамины, фруктоза и др.), влияющих на фармакокинетику препарата, лекарственной формой, переносимостью, стоимостью. В клинической практике ПЖ применяются внутрь или парентерально.
В комплексной терапии ЖДА при беременности целесообразно применять антиоксиданты (витамин Е в дозе от 100 до 300 мг/сут). Для улучшения белкового метаболизма рекомендуется подключить так называемую белково-синтетическую терапию (оротат калия, витамин В6).
Лечение ЖДА у беременных при ее верификации должно проводиться до конца беременности. Это имеет принципиально важное значение и для коррекции анемии у беременной, и, главным образом, для профилактики дефицита железа у плода. Кроме того, по рекомендации ВОЗ, все беременные на протяжении II—III триместров беременности и в первые 6 мес. лактации должны получать ПЖ в профилактической дозе [8].
Контроль показателей красной крови необходимо проводить на фоне лечения каждые 10 дней. Неэффективность лечения ЖДА может быть обусловлена неадекватностью назначаемой терапии.
Несмотря на многообразие ПЖ, до настоящего времени продолжается дискуссия о преимуществах и недостатках двухвалентного железа, оценивается переносимость ПЖ пациентами, а также отслеживаются их возможные побочные действия.
Идеальный железосодержащий препарат должен обладать минимальным количеством побочных эффектов, иметь простую схему применения, наилучшее соотношение эффективности и цены, оптимальное содержание железа, желательно наличие компонентов, усиливающих всасывание и стимулирующих гемопоэз.
Применение комбинаций ПЖ с витамином В12 и фолиевой кислотой не всегда является оправданным, т. к. фолиеводефицитная анемия у беременных возникает крайне редко и имеет специфические клинико-лабораторные признаки.
Более целесообразным считается применять ПЖ, содержащие аскорбиновую кислоту. Одним из таких препаратов является Сорбифер Дурулес, выпускаемый фармацевтическим заводом «Эгис» (Венгрия). В препарате содержится оптимальное количество микроэлемента: в 1 таблетке – 320 мг сульфата железа (соответствует 100 мг железа II) и 60 мг аскорбиновой кислоты, улучшающей всасывание, усвоение железа и оказывающей антиоксидантное действие.
Нами проведен анализ результатов применения во время беременности препарата Сорбифер Дурулес с лечебной и профилактической целью в некоторых районах Московской области (гг. Балашиха, Домодедово, Видное, Люберцы, Мытищи). По результатам анализа количество анемий у беременных в этих районах колеблется от 27,8 до 48,3%. Всего было обследовано 125 беременных, которые с лечебной (82 (65,6%) и профилактической целью (43 (34,4%)) получали Сорбифер Дурулес. С лечебной целью назначали по 1 таблетке 2 р./сут, для профилактики – по 1 таблетке 1 р./сут. Длительность применения и дозу препарата определяли индивидуально на основании динамической оценки результатов гематологических показателей красной крови. Распределение обследованных пациенток в зависимости от цели приема препарата представлено в таблице 1.

Как показано в таблице, чаще всего ЖДА выявлялась во II и III триместрах беременности. В связи с этим и профилактику ЖДА чаще всего начинали проводить со II триместра гестации. Важнейшими и наиболее доступными показателями красной крови при ЖДА являются пониженный уровень гемоглобина, низкий цветовой показатель, снижение количества эритроцитов. Эти показатели и использовались нами для оценки степени тяжести, адекватности лечения и эффективности профилактики ЖДА.
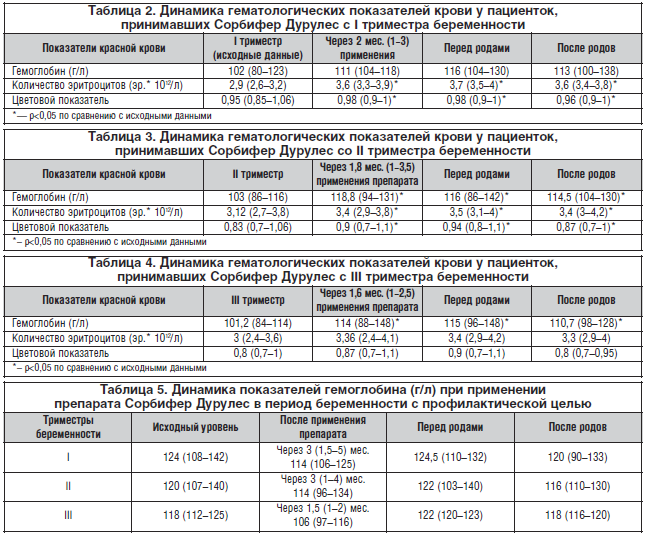
Результаты применения препарата Сорбифер Дурулес с I триместра беременности для лечения ЖДА представлены в таблице 2 (med (g1-g2)).
Из приведенных в таблице 2 данных следует, что применение препарата Сорбифер Дурулес в течение 2 мес. для лечения анемии с I триместра беременности привело к повышению гемоглобина в среднем на 10 единиц. Этот показатель сохраняется стабильным на протяжении всего периода гестации и в послеродовом периоде. Показатели количества эритроцитов и цветовой показатель после лечения на протяжении оставшегося периода беременности и в послеродовом периоде достоверно выше, чем исходные данные.
Динамика показателей гемоглобина, количества эритроцитов и цветового показателя у беременных с ЖДА, выявленной во II триместре гестации, до лечения и на его фоне представлена в таблице 3 (med ( g1-g2)).
При анализе полученных данных (табл. 3) видно, что на фоне проводимой терапии, продолжительность которой в среднем составила 1,8 мес., показатель гемоглобина стал достоверно выше аналогичного показателя до лечения и оставался в пределах нормативных значений до родов и в послеродовом периоде. Такая же тенденция наблюдалась и в динамике показателей количества эритроцитов и цветового показателя.
При выявлении ЖДА у беременных в III триместре беременности лечение проводилось в среднем 1,6 мес. и, как правило, продолжалось в послеродовом периоде. Динамика показателей красной крови при лечении анемии с III триместра беременности представлена в таблице 4 (med ( g1-g2)).
Таким образом, из анализа полученных результатов видно, что уровень гемоглобина после лечения препаратом Сорбифер Дурулес становился достоверно выше по сравнению с исходным, выявленным в III триместре беременности, и оставался таковым до родов.
Главная задача акушера в такой важный период для жизни женщины, как беременность, – не лечить осложнения, а предупредить их развитие. В нашем исследовании скрининговый анализ гемоглобина у беременных позволил осуществить профилактику ЖДА в период гестации.
Динамика показателей гемоглобина при применении препарата Сорбифер Дурулес в период беременности с профилактической целью представлена в таблице 5 (med (g1-g2)).
Данные, приведенные в таблице 5, подтверждают результаты других исследователей о том, что во II триместре беременности происходит наибольшее снижение показателей красной крови, а также тот факт, что повышение этих показателей происходит не быстро, а на фоне длительного применения (в нашем исследовании – в среднем 1,5–3 мес.) ПЖ (в частности, эффективного препарата Сорбифер Дурулес).
Представленные в настоящем исследовании данные свидетельствуют о высокой клинической эффективности железосодержащего препарата Сорбифер Дурулес, что позволяет рекомендовать его для лечения ЖДА, а также профилактики ее развития. Каких-либо побочных отрицательных эффектов, потребовавших отмены препарата, отмечено не было.
Источник
