Серповидно клеточная анемия это пример
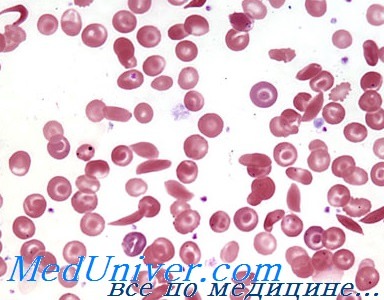
Серповидноклеточная анемия: причины, диагностика, лечениеЭтиология и встречаемость серповидноклеточной анемии. Серповидноклеточная анемия (MIM № 603903) — аутосомно-рецессивное заболевание гемоглобина, вызванное миссенс-мутацией гена бета-субъединицы, заменяющей валин на глутаминовую кислоту в 6 положении. Болезнь чаще вызвана гомозиготностью по мутации серповидноклеточности, хотя серповидноклеточную анемию также может вызывать компаундная (составная) гетерозиготность по аллелю серповидноклеточности и аллелям HbC или бета-талассемии. Распространение серповидноклеточной анемии широко изменяется среди популяций в соответствии с прошлым и настоящим распространением малярии. Мутация серповидноклеточности, как оказалось, несколько повышает сопротивляемость малярии, таким образом, давая преимущество выживания гетерозиготным носителям мутации. Патогенез серповидноклеточной анемииГемоглобин формируется из четырех субъединиц: двух а-субъединиц, кодируемых геном ЯВА в хромосоме 16, и двух бета-субъединиц, кодируемых геном ЯВВ в хромосоме 11. Мутация Glu6Val в бета-субъединице уменьшает растворимость ненасыщенного кислородом гемоглобина и вызывает формирование сети жестких волокнистых полимеров, искажающих строение эритроцита, придавая ему форму серпа. Серповидные эритроциты закупоривают капилляры и вызывают инфаркты. Первоначально обогащение кислородом заставляет полимер гемоглобина растворяться, и эритроциты восстанавливают нормальную форму; тем не менее, регулярное нарушение формы приводит к необратимому переходу клеток в серповидную форму, впоследствии такие эритроциты удаляются из кровотока в селезенке. Скорость удаления эритроцитов из кровотока превышает возможность их синтеза в костном мозге, что приводит к гемолитической анемии. Аллельная гетерогенность часто встречается при большинстве менделирующих заболеваний, особенно когда мутантные аллели вызывают снижение функции. Серповидноклеточная анемия — важное исключение из этого правила, поскольку в данном случае единственная специфическая мутация ответственна за уникальные новые свойства HbS. HbC тоже менее растворим, чем HbA, и тоже стремится кристаллизоваться в эритроцитах, уменьшая их деформируемость в капиллярах и вызывая легкий гемолиз, но HbC не формирует полимерные волокна, как HbS. Неудивительно, что другие мутации с новыми функциями, например, мутации в гене FGFR3, вызывающие ахондроплазию, часто имеют аналогичное снижение аллельной гетерогенности, когда фенотип зависит от специфического, уникального изменения функции белка.
Фенотип и развитие серповидноклеточной анемииКлиническая картина у больных серповидноклеточной анемией обычно проявляется в течение первых двух лет жизни анемией, задержкой развития, спленомегалией, регулярными инфекциями и дактилитами (болезненными припухлостями кистей или стоп, вызванными закупоркой капилляров в небольших костях, обнаруженных у приведенной в примере пациентки). Инфаркты вследствие закупорки сосудов происходят во многих тканях, вызывая инсульты мозга, острый кардиальный синдром, почечный папиллярный некроз, инфаркты селезенки, язвы ног, приапизм, асептический некроз костей и снижение зрения. Окклюзия сосудов костей вызывает приступы болей, при отсутствии лечения эти болезненные эпизоды могут продолжаться в течение нескольких дней и даже недель. Функциональная аспления вследствие инфарктов и других недостаточно ясных факторов, предрасполагает к бактериальным инфекциям, например, пневомококковому или сальмонеллезному сепсису и остеомиелиту. Инфекция — основная причина смерти во всех возрастных группах, хотя прогрессирующая почечная и дыхательная недостаточность также нередкие причины смерти на четвертом и пятом десятилетиях жизни. Пациенты также имеют высокий риск развития угрожающей жизни апластической анемии после парвовирусной инфекции, поскольку парвовирусы вызывают временное прекращение образования эритроцитов. Гетерозиготные носители мутации («признака» серповидноклеточности) не имеют анемии и обычно клинически здоровы. Однако в условиях серьезной гипоксии, например, при восхождении в горы, эритроциты пациентов с «признаком» серповидноклеточности могут принимать форму серпа, вызывая симптомы, подобные наблюдаемым при серповидноклеточной анемии. Особенности фенотипических проявлений серповидноклеточной анемии: Лечение серповидноклеточной анемииКонкретному больному серповидноклеточной анемией дать точный прогноз тяжести течения болезни невозможно. Хотя молекулярная основа болезни стала известной раньше других моногенных заболеваний, лечение остается только симптоматическим. Никакой специфический терапии, предохраняющей от процесса образования серповидных эритроцитов, не найдено. Существенно снижает тяжесть болезни персистенция HbE Исследуется несколько фармакологических препаратов, нацеленных на увеличение концентрации HbF, в этих целях одобрено использование гидрокси-мочевины. Хотя генотерапия имеет шанс улучшить или излечить эту болезнь, эффективная пересадка гена b-глобина не достигнута. Пересадка костного мозга остается единственным доступным в настоящее время лечением, способным помочь при серповидноклеточной анемии. Из-за 11% смертности, вызванной сепсисом в первые 6 мес жизни, большинство штатов в США проводит неонатальный скрининг на серповидноклеточную анемию с целью проведения профилактики антибиотиками, продолжающейся до 5-летнего возраста. Риски наследования серповидноклеточной анемииПоскольку серповидноклеточная анемия — аутосомно-рецессивное заболевание, будущие сибсы больного ребенка имеют 25% риск серповидноклеточной анемии и 50% риск носительства серповидноклеточности. Используя ДНК плода, полученную при БВХ или амниоцентезе, можно провести пренатальную диагностику обнаружением мутации. Пример серповидноклеточной анемии. Второй раз за полгода семейная пара карибского происхождения обратилась со своей 24-месячной дочерью в отделение неотложной помощи, поскольку девочка не может стоять. В анамнезе отсутствуют повышение температуры, инфекция или травма, и в остальном медицинская история ничем не примечательна; данные предыдущих осмотров соответствовали норме, за исключением низкого уровня гемоглобина и слегка увеличенной селезенки. При текущем осмотре патологии не найдено, за исключением пальпируемого края селезенки и отека стоп. Стопы болезненны при пальпации, и девочка не хотела вставать на ноги. Оба родителя имели сибсов, умерших в детстве от инфекций, и других сибсов, вероятно, имевших серповидноклеточную анемию. С учетом анамнеза и повторного болезненного увеличения стоп врач проверил ребенка на наличие серповидноклеточной анемии методом электрофореза гемоглобина. Результат этого теста подтвердил наличие HbS. – Также рекомендуем “Болезнь Тея-Сакса: причины, диагностика, лечение” Оглавление темы “Врожденные болезни”:
|
Источник
Как и почему возникает клеточная анемия
Это заболевание является своеобразной приспособительной реакцией, возникшей у населения, проживающего в районах с высоким распространением малярии. Возбудитель болезни – плазмодий, передаваемый комарами, живет и размножается в клетках крови. Периодически паразиты выходят в кровоток, вызывая тяжелое состояние, сопровождающееся лихорадкой, сыпью, спутанностью сознания и даже смертельными исходами.
Укус комара
Поэтому местные жители в процессе эволюции приобрели особенность, позволяющую противостоять возбудителям. Часть эритроцитов – красных кровяных клеток изменила свою форму и свойства. Они увеличили плотность и стали не круглыми, а полукруглыми, напоминающими по форме серп. В такой крови плазмодии размножаются гораздо хуже и малярия не развивается.
Однако при такой особенности количество серповидных клеток у каждого больного индивидуально. При небольших концентрациях измененных эритроцитов больные не предъявляют жалоб.
Заболевание является наследственным:
- Дети, один из родителей которых имеет признаки изменения эритроцитов, а у другого нет такой особенности, здоровы.
- Однако если оба родителя имеют в крови серповидные эритроциты, у детей в кровотоке могут полностью отсутствовать нормальные красные кровяные тельца.
Симптомы серповидноклеточной анемии
В начале жизни, пока плодные (фетальные) клетки крови не поменялись на «взрослые», ребенок с такой генетической особенностью чувствует себя нормально. Однако, постепенно его состояние ухудшается – возникает задержка физического и умственного развития, опухают суставы, появляются боль в груди, животе, пожелтение кожи, увеличение селезенки.
Характерно неправильное развитие скелета – череп в виде башни с утолщенными швами, напоминающими гребни, искривление позвоночника.
Признаки серповидной анемии:
- слабость;
- головная боль;
- затрудненное дыхание;
- пациент не может выдержать нагрузку;
- анорексия;
- быстрый сердечный ритм;
- низкое кровяное давление;
- сердечная недостаточность.
Головная боль
Быстрый сердечный ритм
У пациентов периодически наступают гемолитические кризы – состояния, при которых измененные эритроциты разрушаются. Повышается температура, нарушается дыхание, появляются явные признаки желтухи, кровь в моче, кровотечения. Возможны сильные боли в животе, вызванные увеличением селезенки. Без срочного переливания крови больной может очень быстро умереть.
До начала миграции населения проблема серповидноклеточной анемии касалась только стран, где она давно наблюдалась. Однако теперь такие случаи регистрируются в государствах, где малярия никогда не встречалась.
Как диагностируется заболевание?
Подозрения может вызывать история болезни пациента и его семьи. При этом симптомы патологии могут быть специфическими для других состояний, связанных с анемией или гемолизом.
После тщательного физического осмотра пациента, назначаются лабораторные анализы крови, подтверждающие анемию и гемолиз. Точно подтверждает наличие HbS и самого заболевания специальная лабораторная обработка образца крови пациента (электрофорез гемоглобина). Под микроскопом (после надлежащей подготовки) эритроциты приобретают характерную форму серповидных клеток.
Лабораторные нарушения гемолиза с обнаруживаемой анемией включают высокий уровень ЛДГ и высокий уровень билирубина.
Визуальные исследования, в основном, УЗИ брюшной полости, показывают увеличение селезенки или печени.
Лечение серповидноклеточной анемии
До последнего момента, единственным возможным вариантом лечения пациентов с этим видом анемии была трансплантация донорских стволовых клеток. Такая процедура требует соответствующего донора, и сам пациент также должен быть с допустимым состоянием здоровья. Из-за строгих требований лечению подвергался лишь небольшой процент пациентов с гомозиготной серповидно-клеточной анемией.
Для пациентов с симптомами тяжелого кризиса, симптомы облегчаются следующими методами:
- Обезболивание. Во многих случаях требуется сильный анальгетик (морфий).
- Оксигенотерапия.
- Переливание крови. Проводится только по индивидуальным показаниям, в случае угрозы жизни
Переливание крови
Поддержка в течение бессимптомного периода:
- Предотвращение недостатка кислорода.
- Предотвращение обезвоживания.
- Профилактика инфекций везде, где это возможно.
- Антибиотикопрофилактика из-за недостаточной функции селезенки (постоянное применение пенициллина у детей до пяти лет).
- Быстрое и целенаправленное лечение инфекций.
- Вакцинация (против пневмококка, Haemofilus influenzae).
- Прием фолиевой кислоты (спорная рекомендация).
Новые методы лечения серповидной анемии — генная терапия
Раньше больные дети умирали в раннем возрасте, но теперь медицина может продлить им жизнь, а с внедрением новой технологии – избавить от заболевания. Лечение, основанное на реактивации выработки гемоглобина, было представлено на ежегодном собрании Американского общества гематологов в Орландо, штат Флорида.
В процессе лечения у больного изымаются стволовые клетки, которые затем размножаются и вводятся обратно. В большинстве случаев такой метод приводит к излечению. Новую методику уже начали применять в США.
Ученые выяснили, что до рождения и в первые месяцы после появления на свет у ребёнка не вырабатываются серповидные красные кровяные клетки. В его кровотоке циркулирует фетальный (плодный) гемоглобин, имеющий нормальное строение. Поэтому в самом раннем детстве у ребёнка не возникает симптомов заболевания.
Со временем этот тип гемоглобина заменяется взрослым, а эритроциты приобретают серповидную форму. Учёные выяснили, что за этот переход отвечает ген BCL11A и белок с таким же названием. Выключив этот процесс, и оставив гемоглобин в плодном состоянии, можно вылечить больных.
Для этого из организма пациента «вылавливают» стволовые клетки, в которые с помощью специального вируса транспортируют маленькую шпилечную РНК, которая не дает образовываться белку BCL11A. Зачем эритроциты оставляют размножаться в специальных культурах.
Пациенту проводится цитостатическая терапия с помощью препаратов, убивающих костный мозг, как при лечении лейкоза. После этого пациенту вводят выращенные стволовые клетки. Они формируют новый костный мозг, заставляя его вырабатывать фетальный гемоглобин, который находился в кровотоке больного до рождения и в первые месяцы жизни.
Результаты лечения хорошие. Первые трое взрослых пациентов, которым была проведена «подсадка» стволовых клеток через 9,10 и 18 месяцев, чувствуют себя намного лучше. Двое из трех больше не нуждаются в переливания крови. В анализах у них не обнаружено существенных отклонений.
Затем такая процедура была проведена двум подросткам 12 и 16 лет. «Подсадка» была повторена через 5 месяцев. Практически сразу отпала необходимость в переливании крови, и исчезли гемолитические кризы.
Все больные, прошедшие лечение, избавились от риска разрушения сосудов мозга, легочной пневмонии, поражений костей. В дальнейшем планируется продолжить развивать и улучшать такой метод лечения.
Поделиться ссылкой:
Источник
Серповидноклеточная анемия — это хроническое нарушение, генетическая аномалия, при которой происходит два связанных процесса: синтез неполноценного S-гемоглобина, а также изменение нормальной формы эритроцитов на серпообразную, как и следует из названия состояния.
Основной контингент пациентов — лица ближневосточного происхождения, и население Индии и некоторых других стран. Заболеваемость в регионах повышенного риска находится на уровне 20-40%. Среди прочих европеоидов число значительно ниже и составляет всего 0.5-2% от общей массы больных и патологиями крови.
Серповидно-клеточная анемия (сокращенно СКА) отличается группой смертельно опасных симптомов. Без постоянного контроля есть риски гибели от осложнений.
Полностью излечить расстройство невозможно, нужна симптоматическая коррекция по потребности. От ее качества зависят прогнозы.
Механизм развития
В основе патогенеза отклонения лежит наследственный процесс. Приобретенные формы практически не встречаются, это казуистика. Потому и рассматривать заболевание нужно как сложную генетическую аномалию.
Наследование СКА происходит по аутосомно-рецессивному типу. Что это значит? Для того, чтобы стать обладателем патологического процесса нужно унаследовать два гена, ответственных за рассматриваемое заболевание.
Здесь присутствуют варианты. Это могут быть сразу оба родителя с аномальным геномом или же за расстройство в ответе предыдущие поколения. Разбираться с этим вопросом должен профильный специалист. Проводятся специальные исследования.
Наследование не всегда идет по идентичному сценарию.
Смешанный (гетерозиготный)
Вполне возможна ситуация, когда в генотипе присутствует и доминантный (нормальный) и рецессивный (аномальный ген).
В таком случае гетерозиготные организмы становятся носителями и измененных, и правильно структурированных эритроцитов. Потому заболевание у них проявляется только в некоторых случаях, каких именно — зависит от конкретного пациента.
Обычно это сильные стрессы, анемия других типов, перенесенные воспалительные заболевания. Все возвращается на круги своя спустя какое-то время.
Как правило, такие пациенты не ощущают изменений в самочувствии и практически не страдают от осложнений. Считаются условно здоровыми большую часть времени.
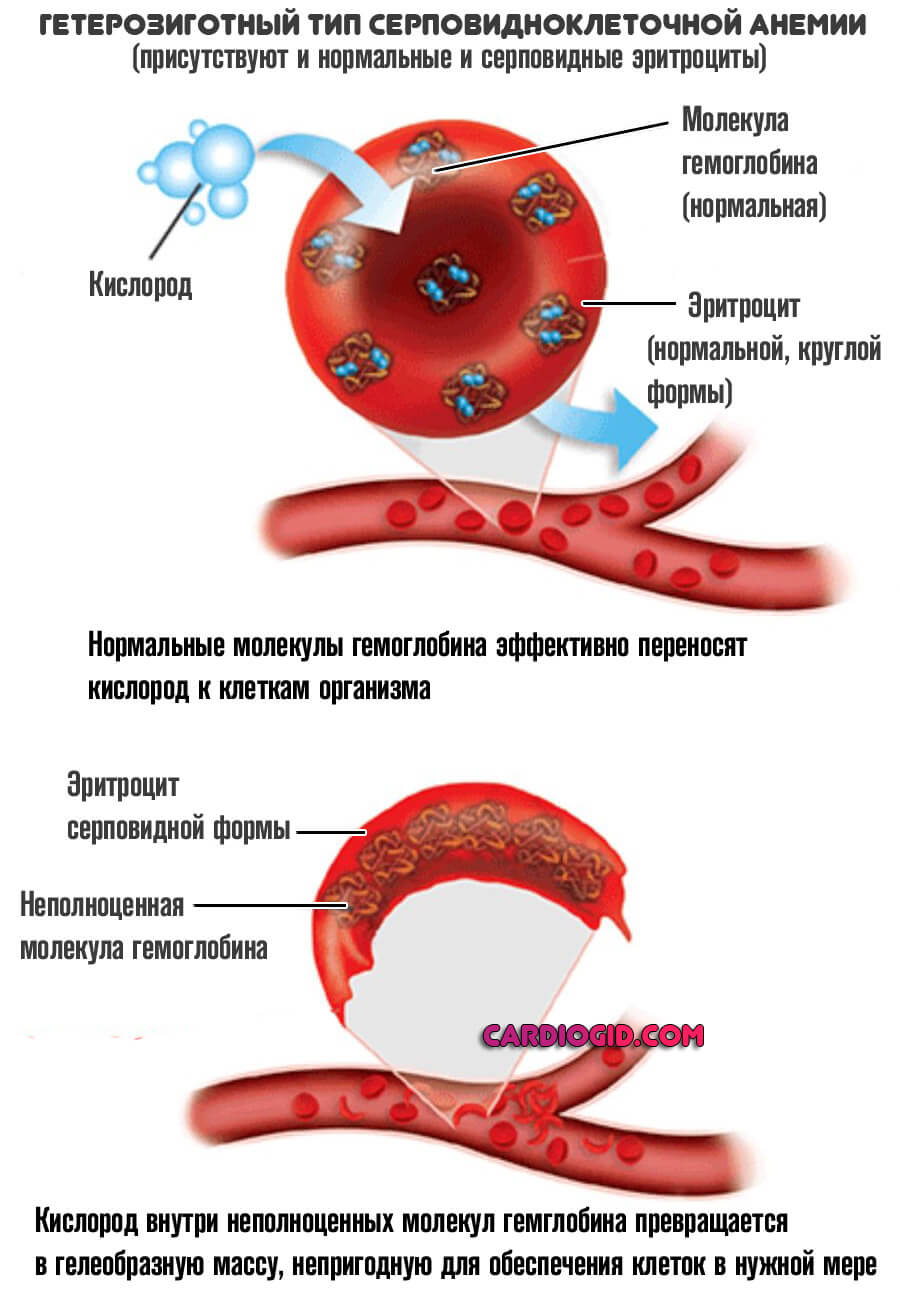
Рецессивный
При полноценном рецессивном варианте, когда нормальные клетки отсутствуют, формируется группа типичных изменений. В первую очередь — это синтез неполноценного S-гемоглобина.
В отличие от своего нормального варианта, он не способен быстро переносить кислород, вызывает его трансформацию в гелеобразную массу, непригодную для обеспечения тканей и органов в нужной мере.
Ситуация усугубляется еще и изменением нормальной формы эритроцитов. Они принимают вид полумесяца и также не способны к адекватной транспортировке кислорода к клеткам.
Отсюда постоянная гипоксия тканей, изменения со стороны физиологических процессов. Особенно заметны отклонения от нормы у детей.
Полного восстановления добиться не удается, потому остается предпринимать симптоматические меры, чтобы снизить агрессивность патологического состояния. От регулярности и качества получаемой помощи и зависит прогноз.
Причины становления
Ключевой фактор один — это аномалии в генотипе родителей. Далеко не обязательно сами отец или мать страдают серповидноклеточной анемией.
Как было сказано выше, для мутации нужны определенные условия, чтобы два измененных гена составили пару. Однако они вполне могут быть носителями проблемных структур, которые и передаются детям.
Сказать заранее, какого типа будет анемия, гомо- или гетерозиготная (когда присутствуют и нормальные и аномальные гены) не всегда сможет даже профильный врач.
Внимание:
Родителям еще на этапе планирования беременности рекомендуется посетить специалиста, оценить характерные отклонения в собственном генотипе и исходить из этих положений.
Доказанных факторов, увеличивающих риски становления проблемы пока нет. Однако, есть предположения, которые оценивают вероятность тяжелого будущего течения процесса у ребенка.
К таковым можно отнести:
- Выраженные стрессовые ситуации. Психологические травмы, влияющие на гомеостаз организма (нахождение в состоянии динамического равновесия).
- Физические перегрузки различного происхождения.
- Перенесенные в недавнем прошлом инфекционные заболевания.
- Несептические аутоиммунные воспалительные процессы.
- Беременность. Сама по себе гестация — большой стресс для тела женщины. В такой момент может актуализироваться расстройство. Особенно у гетерозиготных пациентов, которые имеют в составе крови и нормальные, и аномальные структуры.
- Стремительный рост, пубертатный период.
- Переход в климактерическую стадию, затухание репродуктивных функций.
- Гормональный дисбаланс любого характера.
Все эти причины могут усугубить течение серповидной анемии, но не спровоцировать ее манифестацию.
Больные с классической гомозиготной формой знают о собственном заболевании, встречаются с ним еще в ранние годы и даже месяцы жизни.
Что касается пациентов со смешанным генотипом, присутствием нормальных и патологически измененных структур, они могут и не подозревать о проблеме, пока не встретятся с провоцирующим фактором. Таковым способен стать один из названных в списке.
В любом случае, при наличии оснований предполагать болезнь, стоит навестить гематолога для превентивной диагностики.
Симптомы в зависимости от стадии
Всего можно выделить 4 этапа развития патологического процесса.
Первая
Приходится на самые ранние периоды. С полугода до 3 лет, примерно. Для этого интервала типичны следующие возможные признаки:
- Боли в суставах. Различной интенсивности. Поскольку пациент пока не может рассказать о своих ощущениях, судят по объективному поведению и дополнительным клиническим проявлениям. Страдают в основном крупные структуры: коленные, локтевые, бедренные. Возможны и даже вероятны отклонения со стороны позвоночника в грудном и поясничном отделах.
- Отечность, опухлость суставов. Сопровождается выраженными изменениями размеров. Клиника в этом случае напоминает таковую при артрите, с нарушением подвижности, сильной отечностью.
Этот признак хорошо заметен даже невооруженным глазом. Поскольку проблемы опорно-двигательного аппарата и детей столь юного возраста практически исключены, суставные изменения можно рассматривать как подозрительные признак в рамках диагностики серповидноклеточной анемии.
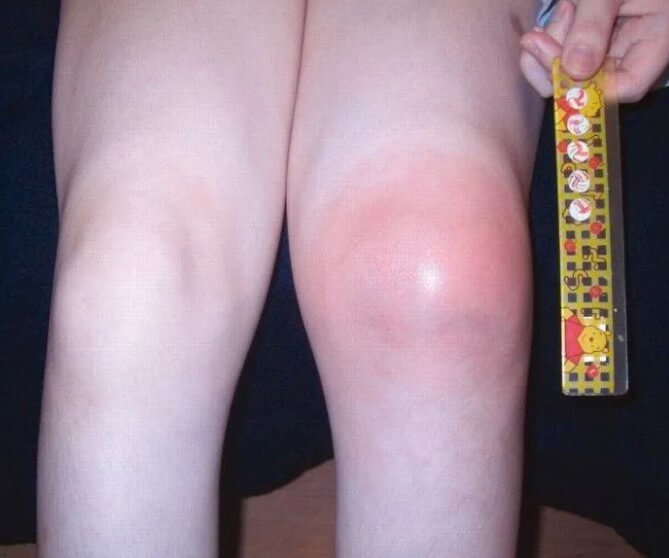
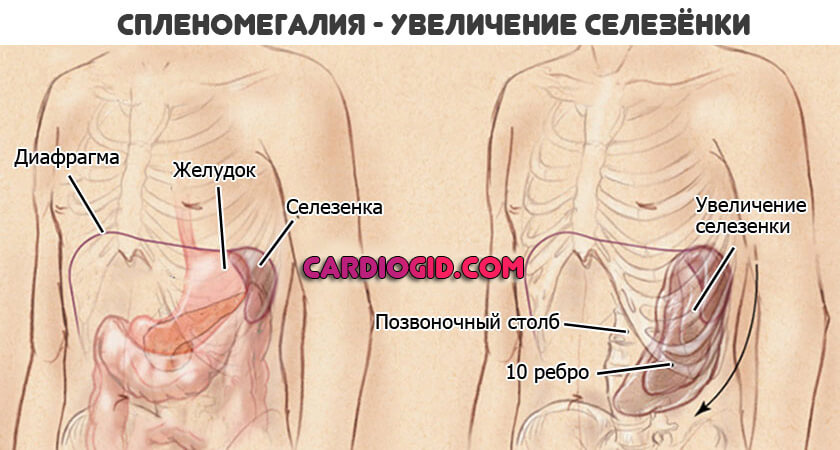
- Увеличение размеров селезенки. Спленомегалия. Возникает временами, не постоянное расстройство. Обнаруживается по результатам ультразвукового обследования и пальпации. Вероятны риски по типу разрыва органа, кровотечения. За пациентом постоянно наблюдают. При критическом изменении размеров показано удаление.
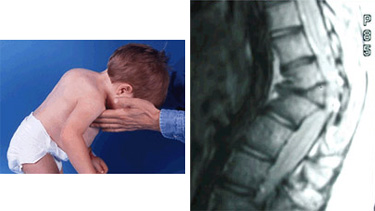
- Аномальное развитие скелета и мускулатуры. Типичны трансформации со стороны грудного и пояснично-крестцового отделов позвоночника. Они выглядят неестественно гипертрофированными, проявляются кифозом (горбатостью), лордозом .
- Частые инфекционно-воспалительные заболевания. В результате падения качества работы защитных сил организма. Встречается практически у всех пациентов. Есть некоторая сезонность. В весеннее и осеннее время процесс более активный. Объективно проявляется частыми острыми респираторными вирусными инфекциями.
Вторая
С 3 до 10 лет, наблюдаются те же симптомы, в более выраженной форме плюс дополнительные признаки:
- Снижение общего иммунитета. О нем уже было сказано. Но в таком случае дефицит постоянный, не зависит от сезона и прочих факторов. Это результат недостаточного обеспечения тканей кислородом, вялой выработки лейко-, лимфоцитов, форменных клеток, ответственных за иммунную реакцию. Восстановление симптоматическое, требуется во всех случаях.
- Увеличение размеров печени. Гепатомегалия. Развивается спонтанно, так же внезапно исчезает. Это тревожный признак. Зачастую он указывает на приближение кризового состояния. Смертельно опасного для пациента. Необходимо динамическое наблюдение. Желательно в условиях гематологического стационара.
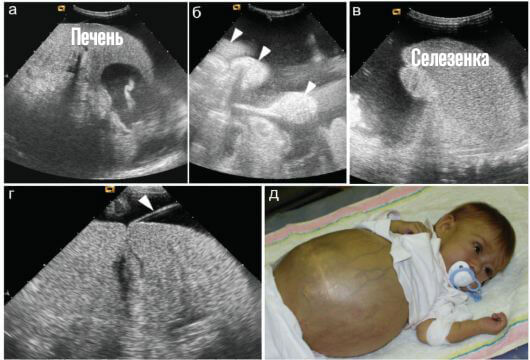
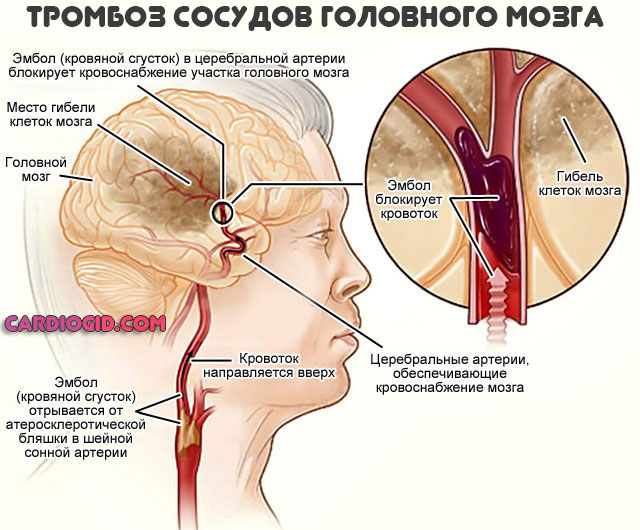
- Повышение рисков тромбоза. Агрегация (накопление) форменных клеток остается на прежнем уровне, но если организм пытается компенсировать неполноценность структур за счет их количества, вероятна цепная реакция с развитием кровяных сгустков. Способных закупорить сосуды, вызвать некроз тканей и смертельно опасные последствия.
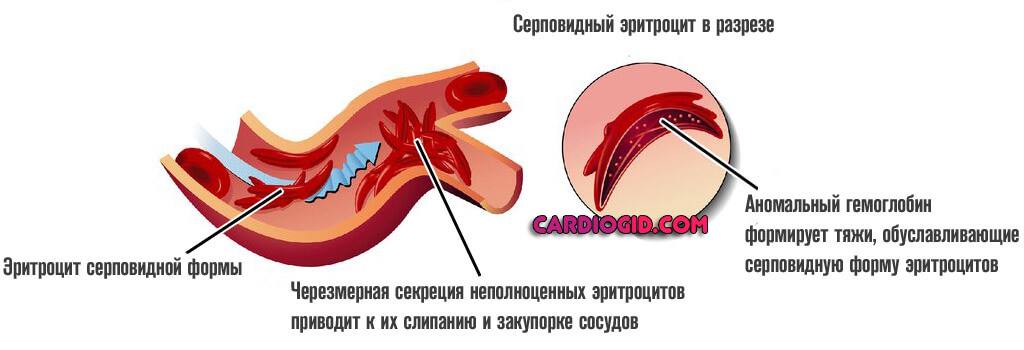
Третья
У пациентов старше 10 лет вероятно развитие еще группы проявлений:
- Слабость, общая астения. Это сказывается на успеваемости в школе. Продуктивности деятельности и мышления. Нет сил ни на что. Активность минимальна, что нетипично для лиц в столь ранние годы.
Возможна симптоматическая активизирующая терапия. Причина такого состояния — гипоксия тканей центральной нервной системы. Необходимо увеличить интенсивность кровотока и, соответственно, обеспечить ЦНС кислородом.
- Вероятность развития гемолитического криза. Сопровождается стремительным спонтанным распадом эритроцитов. Результатом становится критическая гипоксия.
Объективно процесс дает знать о себе несколькими моментами: растет температура тела, появляется слабость, сонливость, кожные покровы приобретают желтый оттенок, обнаруживается кровь в моче. Без срочной помощи велика вероятность гибели.
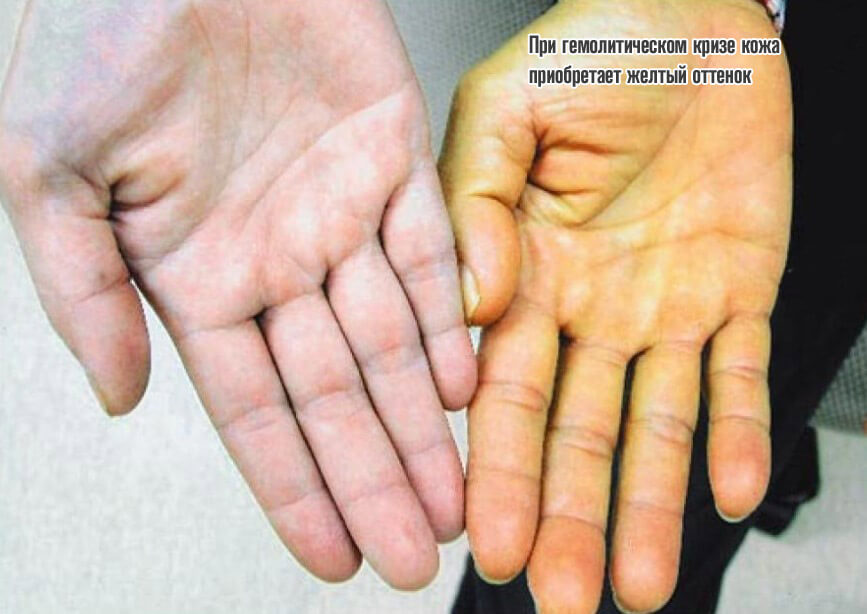
Четвертая
Приходится на взрослые годы. Для него типично повышение рисков столкнуться с кризами разного рода и степени выраженности:
- Уже названным гемолитическим.
- Апластическим. Не менее опасная форма. Клетки не распадаются, а просто перестают нормально вырабатываться. Результатом оказывается резкое уменьшение уровня гемоглобина, проблемы с клеточным дыханием. Возможен летальный исход. Требуется срочная госпитализация.
- Секвестрационным. Характерные черты — увеличение печени, селезенки, падение артериального давления.
В критические периоды также возможны тромбозы, закупорка сосудов с некрозом тканей (инфаркт, инсульт и прочие процессы).
Симптомы серповидноклеточной анемии ставят крест на нормальном физическом и умственном развитии ребенка, но при достаточной коррекции удается сгладить негативные явления.
У взрослых пациентов риски заключается в вероятности смертельно опасных кризов, помимо невозможности вести нормальную повседневную активность.
У гетерозиготных носителей симптоматики как таковой нет практически никогда. Она может стать актуальной в пиковые периоды: стрессовые ситуации, перегрузки психологического и физического плана, беременность, гормональные перестройки, вот неполный перечень возможных провокаторов.
Диагностика
Проводится гематологом, при необходимости подключают генетика. Последний может определить тип наследования серповидноклеточной анемии, сказать больше о характере процесса, его активности.
Задача — констатировать факт наличия патологии. Более сделать нельзя ничего, потому как причины и так понятны.
Необходимые мероприятия:
- Устный опрос больного или его родителей при невозможности самостоятельной речи.
- Сбор анамнеза. Позволяет определить, в какой момент началась проблема. Присутствует ли она с рождения или манифестировала позже.
- Общий анализ крови. Наиболее информативен. Наблюдается резкое снижение уровня гемоглобина, малое количество нормальных эритроцитов. При микроскопии хорошо заметны измененные форменные клетки. Чем их больше, тем тяжелее общее состояние пациента.
- При необходимости проводится пункция для забора образца костного мозга. Как правило, такая процедура крайне редко требуется.
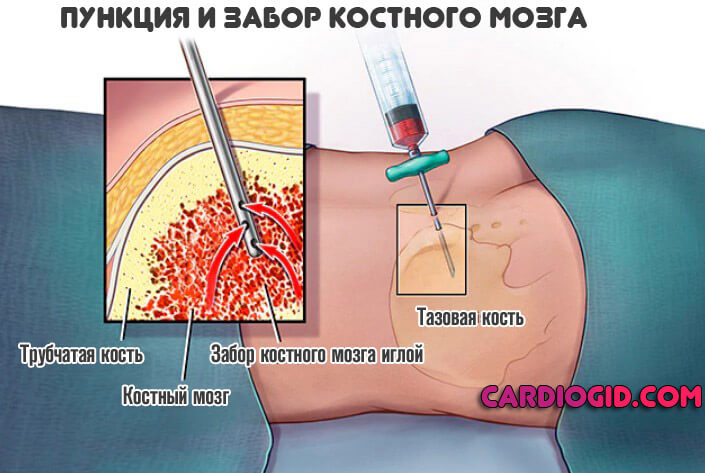
- Информативной методикой выступает и биохимическое исследование венозной крови. Способ используется для выявления концентрации щелочной фосфатазы, билирубина, которые также повышены. Печеночные пробы (АЛТ, АСТ) дают выраженное отклонение нормальных показателей вверх.
В рамках расширенного обследования имеет смысл определить состояние внутренних органов. Для этих целей применяется ультразвуковая методика. Исследуются структуры брюшной полости.
При увеличении размеров селезенки показано динамическое наблюдение за состоянием больного. То же касается изменения нормальных характеристик печени.
В рамках консультации генетика возможна сдача некоторых анализов. Обычно к исследованию привлекаются и родители. По усмотрению профильного специалиста.
Лечение
Надежного метода терапии пока нет. Единственное, что могут сделать доктора — частично или полностью сгладить симптоматику.
Но не всегда клиническая картина поддается изменению. Возможность помощи зависит от количества аномальных клеток в крови. Чем их больше, тем сложнее что-либо сделать.
- Систематически больного должен осматривать гематолог. Вне острого периода назначаются препараты витаминного ряда, также фолиевая кислота, минеральные комплексы для поддержания организма в тонусе.
- Кризовые состояния требуют обязательной госпитализации в профильный стационар. Это единственный способ помочь человеку.
В рамках срочной помощи проводится вливание питательных растворов внутривенно, применяются антибиотики. Препараты для восстановления текучести крови (чтобы не было тромбов), вроде Аспирина и его современных аналогов, по усмотрению докторов. В тяжелых случаях имеет смысл перелить эритроцитарную массу.
Удаление селезенки назначается по показаниям. Как свидетельствуют исследования, при тяжелом трудно купируемом течении серповидноклеточной анемии этот метод достаточно эффективен для прерывания острого состояния.
Что он дает в долгосрочной перспективе — пока сказать врачи не могут.
Прогноз и профилактика
Гомозиготные пациенты, имеющие значительное количество измененных клеток рискуют погибнуть в первые 10-15 лет жизни. Чем больше аномальных эритроитов присутствует, тем хуже.
Что касается прочих больных — все куда более обнадеживающе. Однако такие пациенты должны регулярно осматриваться гематологом, при необходимости проходить пожизненное лечение по предписанной схеме.
Надежных методов профилактики серповидноклеточной анемии нет. Это задача, скорее, родителей. На стадии планирования беременности нужно исключить присутствие аномального гена и матери и отца. Поможет консультация профильного специалиста.
Необходимо систематически посещать гематолога. Это единственная мера.
Возможные последствия
Осложнения стоит подразделить на группы:
- Инфекционные процессы. От воспаления легких до сепсиса.
- Сосудистые изменения. Инсульт, инфаркт, тромбоз, проблемы с потенцией в результате скудного кровоснабжения, прочие аномальные состояния.
- Сердечная недостаточность.
- Выраженная дисфункция почек.
- Проблемы с репродукцией: невозможность зачать, выкидыши.
Это лишь часть возможных последствий.
Серповидно клеточная анемия — смертельно опасная и неизлечимая форма заболевания. Тем не менее, руки опускать не стоит, несмотря на неблагоприятные прогнозы. Известны случаи длительной жизни даже со столь тяжелым расстройством в течение многих лет.
Важно следовать рекомендациям гематолога и систематически посещать врача для коррекции лечения или назначения такового, если потребуется.
Источник
