Серповидноклеточная анемия это биохимия
Серповидно-клеточная анемия
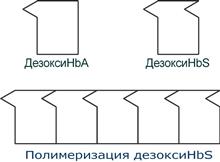
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина “липкого” участка. При дезоксигенации гемоглобина участок “раскрывается” и связывает одну молекулу дезоксигемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцитов и, при прохождении ими капилляров, гемолиз.

Схема отличия гемоглобина S от гемоглобина А и его полимеризация
Нарушение синтеза гемоглобина
Порфирии
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX.
Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%. В результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфобилиноген окисляется в окрашенные соединения и моча темнеет. Симптомами заболевания являются острые боли в животе, нервно-психические расстройства (полиневриты, тетрапарез, галлюцинации), сердечно-сосудистые нарушения.
Заболевание проявляется после достижения половой зрелости из-за повышенной потребности гепатоцитов в цитохроме Р450 для обезвреживания половых стероидов, обострение состояния также часто бывает после приема лекарственных препаратов, метаболизм которых требует участия цитохрома Р450. Снижение концентрации гема, используемого для синтеза цитохрома Р450, активирует аминолевулинат синтазу.
2. Эритропоэтические – аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках. При этом при синтезе уропорфириногенов баланс реакций смещается в сторону синтеза уропорфириногена I. Примером может служить болезнь Гюнтера (частота<1:1000000), при которой развиваются высокая фоточувствительность кожи (ожоги под солнечным светом) и ее поражение, гемолиз, эритродонтия (окрашивание зубов в красный цвет), разрушение хрящей, в том числе носа и ушей.
Талассемии
Для талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям.
Гемоглобинопатия – это наследственные заболевания с единой проблемой – образованием аномальной формы гемоглобина, например, серповидноклеточная анемия S и талассемия.
Гемоглобинопатии носят эндемический характер – они возникают в определенном географическом районе, например, в Средиземноморье, Африке, Юго–Восточной Азии. В нашей стране они тоже встречаются.
Что такое гемоглобинопатия
Гемоглобинопатии – это заболевания, вызванные выработкой и присутствием аномальной формы гемоглобина.
Гемоглобин состоит из гема (частей, содержащих железо) и глобина (частей белка, состоящих из аминокислотных цепей). Молекулы гемоглобина (Hb или Hgb) находятся в красных кровяных тельцах. Их задача – связывать кислород в легких и передавать его тканям и органам, где они его выделяют.
Строение гемоглобина
Существует несколько типов цепей глобина: альфа, бета, дельта и гамма.
Типы нормального гемоглобина:
- A – HbA: составляет около 95-98% от общего гемоглобина у взрослых людей. Он содержит 2 альфа (α) цепи и две бета (β) цепи.
- A2 – HbA2: составляет около 2-3% от общего гемоглобина. Он содержит 2 цепи альфа (α) и две цепи дельта (δ).
- F (HbF): составляет около 2% от общего гемоглобина взрослого человека. Он содержит 2 альфа (α) цепи и две гамма (γ) цепи. Этот гемоглобин в основном вырабатывается у плода, его производство значительно снижается вскоре после рождения и достигает уровня взрослого человека в течение 1-2 лет.
К гемоглобинопатиям относятся: структурные варианты гемоглобина, гемоглобин S, серповидноклеточная анемия, гемоглобинопатия C, гемоглобинопатия E, талассемия, гемоглобин Бартс, наследственная персистенция гемоглобина плода.
Причины развития гемоглобинопатии
Гемоглобинопатии возникают в случае генетических изменений генов глобина, которые приводят к изменению аминокислот, составляющих белок глобина. Эти изменения влияют на:
- структуру гемоглобина, например, гемоглобин S, который вызывает серповидно-клеточную анемию;
- его поведение;
- количество продуцируемого вещества (талассемия);
- стабильность.
Серповидно-клеточная анемия
Существует четыре гена, кодирующих цепь альфа-глобина, и два гена, кодирующих цепь бета-глобина. Наиболее частым заболеванием, связанным с изменением альфа-цепи, является альфа-талассемия. Его тяжесть зависит от количества пораженных генов.
Талассемия характеризуется снижением продукции одной из цепей глобина, дисбалансом между альфа- и бета-цепями в гемоглобине A (альфа-талассемия) или увеличением малых форм, таких как Hb A2 или Hb F (бета-талассемия).
Изменения бета-цепей гемоглобина являются врожденными, аутосомно-рецессивными. Это означает, что больной человек должен иметь две дефектные копии гена, каждая от одного из родителей. Если один ген нормален, а другой дефектен, человек гетерозиготен, и мы называем его носителем. Аномальный ген может быть передан любому из потомков. Если рассматриваемый человек является гетерозиготным носителем, он может не иметь никаких симптомов и носительство не влияет на его здоровье.
Если происходят две модификации одного и того же бета-гена, человек гомозиготен по этому гену. Его организм может производить дефектный гемоглобин – возникает гемоглобинопатия с симптомами и потенциальными осложнениями. Степень тяжести зависит от генетической мутации и варьируется от случая к случаю. Копию гена можно передать потомству.
Если два аномальных бета-гена являются врожденными, человек является двойным, смешанным гетерозиготным. У него будут симптомы одной или обеих гемоглобинопатий. Один из аномальных бета-генов будет передаваться каждому из потомков.
Были идентифицированы сотни гемоглобинопатий в бета-цепях. Хотя лишь некоторые из них являются общими и клинически значимыми.
Клинические признаки и симптомы
Признаки и симптомы различаются по типу гемоглобинопатии и возможному сочетанию нескольких гемоглобинопатий. Некоторые приводят к усилению распада эритроцитов (гемолизу), уменьшению их общего количества и развитию анемии.
Клинические признаки включают:
- слабость, утомляемость;
- недостаток энергии;
- желтуха;
- бледность кожи.
Утомляемость
К серьезным клиническим признакам относятся:
- приступы сильной боли;
- удушье;
- увеличение селезенки;
- нарушения роста у детей;
- боль в верхней части живота (вызванная желчными камнями).
Удушье
Общие гемоглобинопатии
Красные кровяные тельца, содержащие аномальный гемоглобин, могут не переносить кислород достаточно эффективно. Они могут разрушаться раньше (чем в здоровых клетках крови) и развиваться гемолитическая анемия. Выявлены сотни гемоглобинопатий, но лишь некоторые из них являются общими и клинически значимыми.
Одной из наиболее распространенных гемоглобинопатий является серповидно-клеточная анемия с присутствием гемоглобина S. Это приводит к изменению формы – серповидно-клеточной – эритроцитов и снижению их выживаемости. Гемоглобин С может вызвать легкую гемолитическую анемию. Гемоглобин E обычно не приводит к развитию каких-либо или только очень легких клинических симптомов.
- Талассемия: самая распространенная генетическая аномалия в мире. Она часто встречается в Средиземноморье, на Ближнем Востоке и в Юго-Восточной Азии. Более легкая форма талассемии также встречается, например, у людей, родившихся в Чехии.
- Гемоглобин S: это основной гемоглобин людей с серповидно-клеточной анемией. В среднем эта мутация есть в одном из двух бета-генов у 8% американцев и африканцев. Возникновение этих мутаций в наших широтах встречаеся редко. Пациенты с заболеванием HbS имеют две аномальные цепи бета (b s) и две нормальные цепи альфа (a). Когда эритроциты, содержащие гемоглобин S, подвергаются действию пониженного количества кислорода (как это может быть в случае повышенной физической нагрузки или инфекционного заболевания легких), они деформируются, принимая форму полумесяца. Серповидные эритроциты могут блокировать периферические кровеносные сосуды и вызывать нарушения кровотока и боль. У них пониженная способность переносить кислород и более короткий срок жизни. Одна копия б не вызывает клинических проявлений, если не сочетается с другой мутацией гемоглобина, такой как HbC (b C) или бета-талассемия.
- Гемоглобин C: около 25% жителей Западной Африки и 2-3% афроамериканцев гетерозиготны по гемоглобину C (у них есть одна копия B C). Но заболевают только гомозиготные люди с обоими дефектными генами (b C). Обычные симптомы – легкая гемолитическая анемия с небольшим или средним увеличением селезенки.
- Гемоглобин E: вторая по распространенности гемоглобинопатия в мире с изменением бета-цепей. Патология очень часто встречается в Юго-Восточной Азии, особенно в Камбодже, Лаосе и Таиланде, а также частично в Северо-Восточной Азии. Есть случаи и в нашей стране. Люди с гомозиготным Hb E (две копии b E) обычно имеют легкую гемолитическую анемию, микроциты (маленькие красные кровяные тельца) и слегка увеличенную селезенку. Одна копия гемоглобина E не вызывает клинических признаков, если не сочетается с другой мутацией, такой как одна из бета-талассемии.
Талассемия
Необычные гемоглобинопатии
Существует ряд гемоглобинопатий, некоторые из которых не проявляются – они не вызывают никаких клинических признаков или симптомов. Другие, в свою очередь, влияют на функциональность и / или стабильность молекулы гемоглобина. Примерами являются гемоглобин D, гемоглобин G, гемоглобин J, гемоглобин M и гемоглобин Constant Spring. Мутации в гене альфа-цепи глобина приводят к образованию аномально длинных альфа (а) цепей, которые вызывают нестабильность в молекуле гемоглобина.
Другие примеры мутаций бета-цепи:
- Гемоглобин F: Hb F в основном вырабатывается в организме будущего ребенка (плода), и его функция заключается в переносе кислорода в среде с низким содержанием кислорода. Продукция гемоглобина F снижается сразу после рождения и стабилизируется на уровне взрослого человека до 1-2 лет. Гемоглобин F может быть повышен при некоторых врожденных заболеваниях. При бета-талассемии его уровень может быть нормальным или повышенным, но часто повышен при серповидно-клеточной анемии и сочетании серповидно-клеточной анемии с бета-талассемией. Пациенты с серповидно-клеточной анемией и повышенным Hb F часто имеют более легкое течение болезни, поскольку Hb F предотвращает серповидное движение красных кровяных телец. Уровни Hb F повышены в редком состоянии, называемом врожденным постоянством выработки гемоглобина плода (HPFH). Люди с повышенным уровнем гемоглобина F не имеют клинических признаков. HPFH вызывается разными генными мутациями у разных этнических групп. Hb F также может быть повышен при некоторых приобретенных состояниях, влияющих на выработку красных кровяных телец. Например, лейкемия и миелопролиферативные заболевания часто сопровождаются небольшим повышением уровня гемоглобина F.
- Гемоглобин H: HbH – это аномальный гемоглобин, который возникает в некоторых случаях альфа-талассемии. Его образование является ответом на фундаментальный недостаток альфа (а) цепей. Hb H состоит из четырех цепей бета (b) глобина. Хотя каждая из цепей бета-глобина нормальна, комплекс из четырех цепей бета нормально не функционирует. Обладает повышенным сродством к кислороду, плохо выделяет кислород клеткам тканей. Присутствие гемоглобина H также связано со значительным распадом эритроцитов (гемолизом), который возникает в результате осаждения нестабильного гемоглобина внутри красных кровяных телец.
- Hemoglobin Barts: Hb Barts вырабатывается в организме будущего ребенка с альфа-талассемией при условии, что все четыре гена, отвечающие за производство гемоглобина альфа, отсутствуют. Таким образом, не может образовываться гемоглобин HbA, HbA 2 и HbF. Гемоглобин Бартс состоит из четырех гамма (g) цепей и имеет высокое сродство к кислороду. Это состояние несовместимо с жизнью и обычно приводит к внутриутробной гибели плода.
Некоторые люди могут унаследовать два гена с разными мутациями, каждый от одного из родителей. Таких людей называют двойными или смешанными гетерозиготами.
Обследование: лабораторные тесты
Исследование на гемоглобинопатию проводится в следующих случаях:
- Выявление гемоглобинопатий у бессимптомных родителей больных детей.
- Выявление гемоглобинопатий у пациента с необъяснимой анемией, микроцитозом и / или гипохромией. Анализ может быть выполнен как часть теста на анемию.
- Скрининг на гемоглобинопатии у новорожденных – только в США и некоторых регионах с повышенной заболеваемостью.
- Пренатальный скрининг проводится в некоторых регионах с высокой частотой гемоглобинопатий (особенно в Африке).
На результаты тестов на гемоглобинопатию может повлиять переливание крови. Поэтому после переливания крови, прежде чем сдать анализ, пациенту следует подождать несколько месяцев. Тем не менее пациентам с серповидно-клеточной анемией после переливания крови рекомендуется сдать анализ крови, чтобы увидеть, достаточно ли гемоглобина в крови, и снизить риск повреждения организма серповидными эритроцитами.
Обследование гемоглобинопатий основано на обнаружении и оценке «нормальности» эритроцитов и гемоглобина в эритроцитах, а также на исследовании конкретной мутации гена. Каждый из тестов является частью головоломки, предоставляющей важную информацию о том, какая гемоглобинопатия присутствует. Для проверки гемоглобинопатии используются следующие тесты:
- Анализ крови. Анализ крови дает быструю информацию о клетках, циркулирующих в крови. Помимо прочего, результаты анализа крови показывают, сколько красных кровяных телец (эритроцитов) содержится в крови, какого они размера и формы, а также сколько там гемоглобина. Размер эритроцита определяет средний объем эритроцитов (MCV). Обнаружение пониженного MCV (микроцитоз, наличие небольших эритроцитов) часто сначала указывает на возникновение талассемии. Если MCV низкий и дефицит железа исключен, пациенты могут быть носителями талассемии или гемоглобинопатии, которые также вызывают микроцитоз (например, HbE).
- Анализ ДНК. Этот анализ используется для скрининга мутаций и делеций в альфа- и бета-областях глобиновых генов. Иногда обследуются все члены семьи. Задача в том, чтобы определить конкретный тип мутации, встречающейся в семье, и выявить всех носителей. ДНК-тесты не являются обычным тестом, но они могут помочь диагностировать гемоглобинопатию и выявить носителей.
- Мазок периферической крови (микроскопический дифференциальный подсчет лейкоцитов, считываемый по мазку периферической крови). Тест проводится путем формирования тонкого слоя крови на предметном стекле и окрашивания его специальными красителями. Образец крови, обработанный таким образом, затем оценивается лаборантом под микроскопом. Специалист определяет количество и тип белых и красных кровяных телец и тромбоцитов. Оценивает, являются ли они нормальными и зрелыми.
Анализ крови
При гемоглобинопатии эритроциты могут быть в следующих формах:
- Микроциты (меньше нормального).
- Гипохромные (более бледные, с пониженным гемоглобином).
- Разных размеров (анизоцитоз) и формы (пойкилоцитоз, например, серповидно-клеточные клетки).
- С ядром (в незрелых эритроцитах) или с включениями.
- С неравномерным распределением гемоглобина (клетки-мишени, которые под микроскопом выглядят как «бычий глаз»).
Наличие более высокого процента аномально выглядящих эритроцитов означает более высокую вероятность наличия заболевания.
С помощью тестов на гемоглобинопатию и их комбинаций можно диагностировать наиболее распространенные гемоглобинопатии. Эти тесты могут помочь выявить пациентов с сочетанием различных гемоглобинопатий (смешанные гетерозиготы).
Лечение гемоглобинопатии
В настоящее время гемоглобинопатии – неизлечимые заболевания. Но возможно устранять симптомы заболевания. Цель – облегчить боль и минимизировать возможные осложнения. Также существуют лекарства, повышающие уровень гемоглобина F, что облегчает некоторые симптомы.
Однако исследования и поиск более безопасных и эффективных методов лечения все еще продолжается. В будущем для восстановления мутированного гена можно будет использовать трансплантацию стволовых клеток или генную терапию. Для того чтобы эти методы могли широко использоваться в будущем, необходимы дальнейшие обширные исследования.
Источники: БЕРТИС, Калифорния, ЭШВУД, Эр., Брунс, Делавэр, (ред.), Учебник Тиц по клинической химии и молекулярной диагностике. 4-е издание Луи: Эльзевье-Сондерс, 2006; LOTHAR, T. Клиническая лабораторная диагностика. Франкфурт: TH-Books, 1998; MASOPUST, J. Клиническая биохимия – требования и оценка биохимических исследований, часть I. и часть 2, Прага: Каролинум, 1998; RACEK, J., et al. Клиническая биохимия. 2. переработанное издание, Прага: Гален, 2006; Каспер Д.Л., Браунвальд Э., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., редакторы Джеймсон Д.Л., 2005.
Поделиться ссылкой:
Как и почему возникает клеточная анемия
Это заболевание является своеобразной приспособительной реакцией, возникшей у населения, проживающего в районах с высоким распространением малярии. Возбудитель болезни – плазмодий, передаваемый комарами, живет и размножается в клетках крови. Периодически паразиты выходят в кровоток, вызывая тяжелое состояние, сопровождающееся лихорадкой, сыпью, спутанностью сознания и даже смертельными исходами.
Укус комара
Поэтому местные жители в процессе эволюции приобрели особенность, позволяющую противостоять возбудителям. Часть эритроцитов – красных кровяных клеток изменила свою форму и свойства. Они увеличили плотность и стали не круглыми, а полукруглыми, напоминающими по форме серп. В такой крови плазмодии размножаются гораздо хуже и малярия не развивается.
Однако при такой особенности количество серповидных клеток у каждого больного индивидуально. При небольших концентрациях измененных эритроцитов больные не предъявляют жалоб.
Заболевание является наследственным:
- Дети, один из родителей которых имеет признаки изменения эритроцитов, а у другого нет такой особенности, здоровы.
- Однако если оба родителя имеют в крови серповидные эритроциты, у детей в кровотоке могут полностью отсутствовать нормальные красные кровяные тельца.
Симптомы серповидноклеточной анемии
В начале жизни, пока плодные (фетальные) клетки крови не поменялись на «взрослые», ребенок с такой генетической особенностью чувствует себя нормально. Однако, постепенно его состояние ухудшается – возникает задержка физического и умственного развития, опухают суставы, появляются боль в груди, животе, пожелтение кожи, увеличение селезенки.
Характерно неправильное развитие скелета – череп в виде башни с утолщенными швами, напоминающими гребни, искривление позвоночника.
Признаки серповидной анемии:
- слабость;
- головная боль;
- затрудненное дыхание;
- пациент не может выдержать нагрузку;
- анорексия;
- быстрый сердечный ритм;
- низкое кровяное давление;
- сердечная недостаточность.
Головная боль
Быстрый сердечный ритм
У пациентов периодически наступают гемолитические кризы – состояния, при которых измененные эритроциты разрушаются. Повышается температура, нарушается дыхание, появляются явные признаки желтухи, кровь в моче, кровотечения. Возможны сильные боли в животе, вызванные увеличением селезенки. Без срочного переливания крови больной может очень быстро умереть.
До начала миграции населения проблема серповидноклеточной анемии касалась только стран, где она давно наблюдалась. Однако теперь такие случаи регистрируются в государствах, где малярия никогда не встречалась.
Как диагностируется заболевание?
Подозрения может вызывать история болезни пациента и его семьи. При этом симптомы патологии могут быть специфическими для других состояний, связанных с анемией или гемолизом.
После тщательного физического осмотра пациента, назначаются лабораторные анализы крови, подтверждающие анемию и гемолиз. Точно подтверждает наличие HbS и самого заболевания специальная лабораторная обработка образца крови пациента (электрофорез гемоглобина). Под микроскопом (после надлежащей подготовки) эритроциты приобретают характерную форму серповидных клеток.
Лабораторные нарушения гемолиза с обнаруживаемой анемией включают высокий уровень ЛДГ и высокий уровень билирубина.
Визуальные исследования, в основном, УЗИ брюшной полости, показывают увеличение селезенки или печени.
Лечение серповидноклеточной анемии
До последнего момента, единственным возможным вариантом лечения пациентов с этим видом анемии была трансплантация донорских стволовых клеток. Такая процедура требует соответствующего донора, и сам пациент также должен быть с допустимым состоянием здоровья. Из-за строгих требований лечению подвергался лишь небольшой процент пациентов с гомозиготной серповидно-клеточной анемией.
Для пациентов с симптомами тяжелого кризиса, симптомы облегчаются следующими методами:
- Обезболивание. Во многих случаях требуется сильный анальгетик (морфий).
- Оксигенотерапия.
- Переливание крови. Проводится только по индивидуальным показаниям, в случае угрозы жизни
Переливание крови
Поддержка в течение бессимптомного периода:
- Предотвращение недостатка кислорода.
- Предотвращение обезвоживания.
- Профилактика инфекций везде, где это возможно.
- Антибиотикопрофилактика из-за недостаточной функции селезенки (постоянное применение пенициллина у детей до пяти лет).
- Быстрое и целенаправленное лечение инфекций.
- Вакцинация (против пневмококка, Haemofilus influenzae).
- Прием фолиевой кислоты (спорная рекомендация).
Новые методы лечения серповидной анемии — генная терапия
Раньше больные дети умирали в раннем возрасте, но теперь медицина может продлить им жизнь, а с внедрением новой технологии – избавить от заболевания. Лечение, основанное на реактивации выработки гемоглобина, было представлено на ежегодном собрании Американского общества гематологов в Орландо, штат Флорида.
В процессе лечения у больного изымаются стволовые клетки, которые затем размножаются и вводятся обратно. В большинстве случаев такой метод приводит к излечению. Новую методику уже начали применять в США.
Ученые выяснили, что до рождения и в первые месяцы после появления на свет у ребёнка не вырабатываются серповидные красные кровяные клетки. В его кровотоке циркулирует фетальный (плодный) гемоглобин, имеющий нормальное строение. Поэтому в самом раннем детстве у ребёнка не возникает симптомов заболевания.
Со временем этот тип гемоглобина заменяется взрослым, а эритроциты приобретают серповидную форму. Учёные выяснили, что за этот переход отвечает ген BCL11A и белок с таким же названием. Выключив этот процесс, и оставив гемоглобин в плодном состоянии, можно вылечить больных.
Для этого из организма пациента «вылавливают» стволовые клетки, в которые с помощью специального вируса транспортируют маленькую шпилечную РНК, которая не дает образовываться белку BCL11A. Зачем эритроциты оставляют размножаться в специальных культурах.
Пациенту проводится цитостатическая терапия с помощью препаратов, убивающих костный мозг, как при лечении лейкоза. После этого пациенту вводят выращенные стволовые клетки. Они формируют новый костный мозг, заставляя его вырабатывать фетальный гемоглобин, который находился в кровотоке больного до рождения и в первые месяцы жизни.
Результаты лечения хорошие. Первые трое взрослых пациентов, которым была проведена «подсадка» стволовых клеток через 9,10 и 18 месяцев, чувствуют себя намного лучше. Двое из трех больше не нуждаются в переливания крови. В анализах у них не обнаружено существенных отклонений.
Затем такая процедура была проведена двум подросткам 12 и 16 лет. «Подсадка» была повторена через 5 месяцев. Практически сразу отпала необходимость в переливании крови, и исчезли гемолитические кризы.
Все больные, прошедшие лечение, избавились от риска разрушения сосудов мозга, легочной пневмонии, поражений костей. В дальнейшем планируется продолжить развивать и улучшать такой метод лечения.
