Схема распада гемоглобина биохимия
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов.
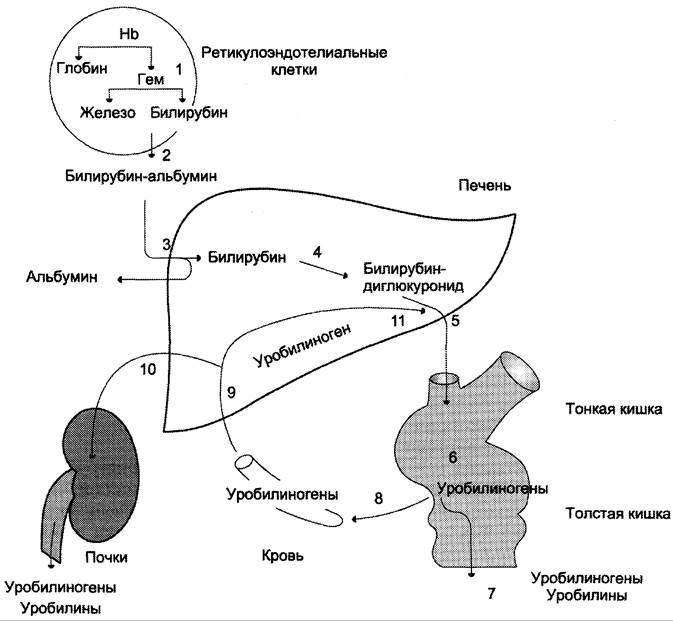
Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга.
Синтез билирубина
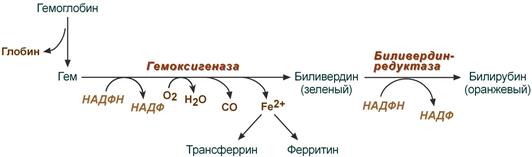
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином.
Реакции распада гемоглобина и образования билирубина
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.
Этапы метаболизма билирубина в организме
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой), попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой), попадающий из желчных протоков (в норме не более 20%).
Термины “связанный“, “конъюгированный“, “свободный“, “несвязанный” отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины “прямой” и “непрямой” введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую, без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами.
Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена. Далее
- малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену,
- незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи,
- однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин, окрашивая кал,
- аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин.
Очень часто стеркобилиноген, содержащийся в нормальной моче, называют уробилиногеном. И в клинической практике обычно не проводят различий между стеркобилиногеном и уробилиногеном мочи, их рассматривают как один пигмент – урохромы (уробилиноиды), что может создавать некоторую путаницу при оценке результатов анализа.
Тема 3 (вопрос 4 и 5).
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом – гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент – порфобилиногенсинтаза – ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.
Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 – 2×1011 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
РАЗДЕЛ 13. МЕТАБОЛИЗМ ГЕМА И ОБМЕН ЖЕЛЕЗА
III. Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 — 2 x 1011 эритроцитов в сутки. Их катаболизм происходит главным образом в ретикулоэндотелиальных клетках селезёнки, лимфатических; узлов, костного мозга и печени. При старении эритроцитов снижается содержание сиаловых кислот в составе гликопротеинов плазматической мембраны. Изменённые углеводные компоненты гликопротеинов мембран эритроцитов связываются рецепторами клеток РЭС, и эритроциты «погружаются» в них эндоцитозом. Распад эритроцитов в этих клетках начинается с распада гемоглобина на гем и глобин и последующего гидролиза ферментами лизосом белковой части гемоглобина.
А. Катаболизм гема
Первая реакция катаболизма гема происходит при участии NADPH-зaвиcимoгo ферментативного комплекса гемоксигеназы. Ферментная система локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, — таким образом, раскрывается структура кольца (рис. 13-11). В ходе реакции образуются линейный тетрапиррол — биливердин (пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к гему.
Рис. 13-11. Распад гема. М — (-СН3) — метильная группа; В — (-СН = СН2) — винильная группа; П — (-СН2-СН2-СООН) — остаток пропионовой кислоты. В ходе реакции одна метильная группа превращается в окись углерода и, таким образом, раскрывается структура кольца. Образованный биливердин под действием биливердинредуктазы превращается в билирубин.
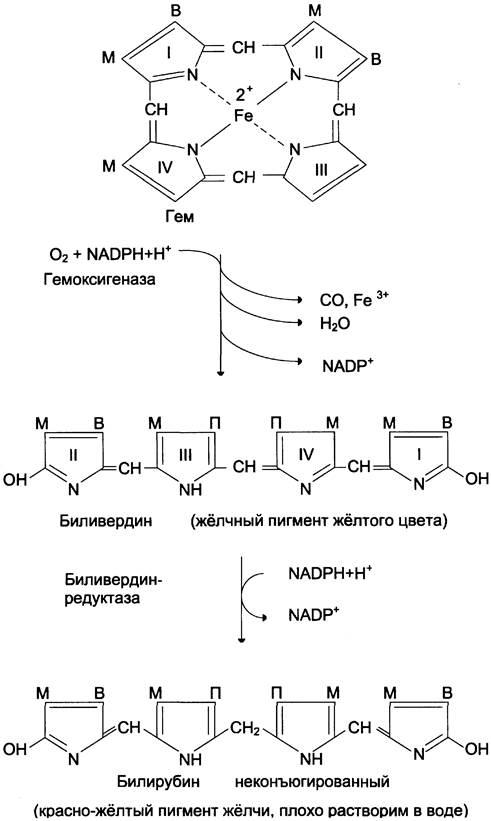
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Билирубин образуется не только при распаде гемоглобина, но также при катаболизме других гемсодержащих белков, таких как цитохромы и миоглобин. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека — примерно 250 — 350 мг билирубина. Дальнейший метаболизм билирубина происходит в печени.
Б. Метаболизм билирубина
Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином. Каждая молекула альбумина связывает 2 (или даже 3) молекулы билирубина, одна из которых связана с белком более прочно (более высокое сродство), чем другие. При сдвиге pH крови в кислую сторону (повышение концентрации кетоновых тел, лактата) изменяются заряд, конформация альбумина, снижается сродство к билирубину. Поэтому билирубин, связанный с альбумином непрочно, может вытесняться из центров связывания и образовывать комплексы с коллагеном межклеточного матрикса и липидами мембран. Ряд лекарственных соединений конкурирует с билирубином за высокоаффинный, имеющий высокое сродство центр альбумина.
Поглощение билирубина паренхиматозными клетками печени
Комплекс «альбумин — билирубин», доставляемый с током крови в печень, на поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны. Облегчённая диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z. Активность поглощения билирубина гепатоцитом зависит от скорости его метаболизма в клетке.
Лигандин и протеин Z обнаружены также в клетках почек и кишечника, поэтому при недостаточности функции печени они способны компенсировать ослабление процессов детоксикации в этом органе.
Конъюгация билирубина в гладком ЭР
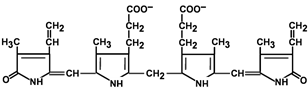
В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты. Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо растворимый в воде конъюгат — диглюкуронид билирубина (конъюгированный, или прямой, билирубин) (рис. 13-12).
Рис. 13-12. Структура билирубиндиглюкуронида (конъюгированный, «прямой» билирубин). Глюкуроновая кислота присоединяется эфирной связью к двум остаткам пропионовой кислоты с образованием ацилглюкуронида.
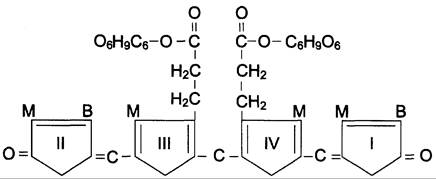
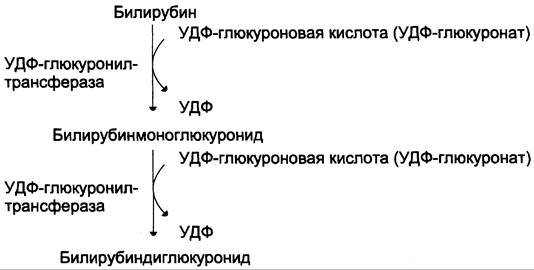
Донором глюкуроновой кислоты служит УДФ- глюкуронат. Специфические ферменты, УДФ-глюкуронилтрансферазы (уридиндифосфоглюкуронилтрансферазы) катализируют образование моно- и диглюкуронидов билирубина (рис. 13-13). Индукторами синтеза УДФ-глюкуронилтрансфераз служат некоторые лекарственные препараты, например, фенобарбитал (см. раздел 12).
Рис. 13-13. Образование билирубиндиглюкуронида.
Секреция билирубина в жёлчь
Секреция конъюгированного билирубина в жёлчь идёт по механизму активного транспорта, т. е. против градиента концентрации. Активный транспорт является, вероятно, скорость-лимитирующей стадией всего процесса метаболизма билирубина в печени. В норме диглюкуронид билирубина — главная форма экскреции билирубина в жёлчь, однако не исключается присутствие небольшого количества моноглюкуронида. Транспорт конъюгированного билирубина из печени в жёлчь активируется теми же лекарствами, которые способны индуцировать конъюгацию билирубина. Таким образом, можно сказать, что скорость конъюгации билирубина и активный транспорт би- лирубинглюкуронида из гепатоцитов в жёлчь строго взаимосвязаны (рис. 13-14).
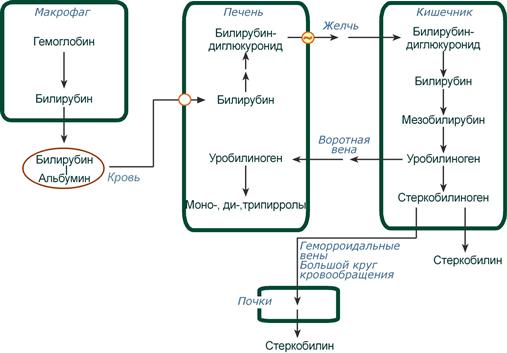
Рис. 13-14. Билирубин-уробилиногеновый цикл в печени. 1 — катаболизм Нb в ретикулоэндотелиальных клетках костного мозга, селезёнки, лимфатических узлов; 2 — образование транспортной формы комплекса билирубин-альбумин; 3 — поступление билирубина в печень; 4 — образование билирубинглюкуронидов; 5 — секреция билирубина в составе жёлчи в кишечник; 6 — катаболизм билирубина под действием кишечных бактерий; 7 — удаление уробилиногенов с фекалиями; 8 — всасывание уробилиногенов в кровь; 9 — усвоение уробилиногенов печенью; 10 — поступление части уробилиногенов в кровь и выделение почками с мочой; 11 — небольшая часть уробилиногенов секретируется в жёлчь.

В. Катаболизм билирубиндиглюкуронида
В кишечнике поступившие билирубинглюкурониды гидролизуются специфическими бактериальными ферментами р-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тетрапиррольных соединений — уробилиногенов (рис. 13-15).
Рис. 13-15. Структура некоторых жёлчных пигментов. Мезобилиноген — промежуточный продукт катаболизма билирубина в кишечнике.
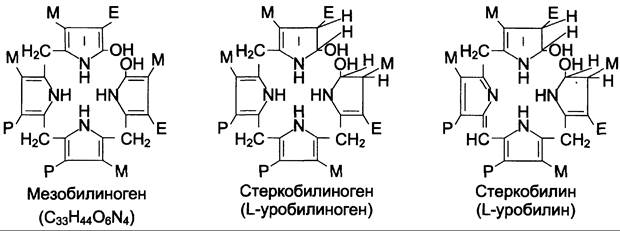
В подвздошной и толстой кишках небольшая часть уробилиногенов снова всасывается, попадает с кровью воротной вены в печень. Основная часть уробилиногена из печени в составе жёлчи выводится в кишечник и выделяется с фекалиями из организма, часть уробилиногена из печени поступает в кровь и удаляется с мочой в форме уробилина (рис. 13-14). В норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке, под действием кишечной микрофлоры окисляется в прямой кишке до пигмента коричневого цвета уробилина и удаляется с фекалиями. Цвет фекалий обусловлен присутствием уробилина.
Реакции синтеза билирубин-диглюкуронида
Строение билирубин-диглюкуронида
(прямой билирубин)
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой) , попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой) , попадающий из желчных протоков (в норме не более 20%).
Термины «связанный«, «конъюгированный«, «свободный«, «несвязанный» отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины «прямой» и «непрямой» введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую , без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена ( уробилиногена ). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами.
Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена . Далее
- малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену,
- незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи,
- однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин , окрашивая кал,
- аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин .
источник
Биосинтез и распад гемоглобина
Тема 3 (вопрос 4 и 5).
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом — гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент — порфобилиногенсинтаза — ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.
Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 — 2×10 11 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8720 —
| 8267 — или читать все.
источник
Распад гемоглобина
Процесс распада эритроцитов начинается уже в сосудистом русле, а завершается в клеточных элементах системы фагоцитирующих мононуклеаров (купферовских клетках печени, гистиоцитах соединительной ткани, плазматических клетках костного мозга). После выхода гемоглобина из структуры эритроцитов так называемый внеэритроцитарный гемоглобин связывается с гаптоглобином плазмы, образуя комплекс «гемоглобин—гаптоглобин». Благодаря этому гемоглобин задерживается в сосудистом русле, не проходя через почечный фильтр. Вследствие трипсиноподобного действия бета-цепи гаптоглобина и вызванных его влиянием конформационных изменений в порфириновом кольце гема создаются условия для более легкого разрушения гемоглобина в клеточных элементах системы фагоцитирующих мононуклеаров (рис.15).
Образующийся таким образом высокомолекулярный пигмент зеленого цвета вердоглобин представляет собой комплекс, состоящий из глобина, разорванной системы порфиринового кольца и трехвалентного железа.
Дальнейшие превращения приводят к потере вердоглобином железа и глобина, в результате чего порфириновое кольцо разворачивается в цепь и формируется низкомолекулярный желчный пигмент зеленого цвета —биливердин. Почти весь он ферментативным путем восстанавливается в важнейший красно-желтый пигмент желчи — билирубин, являющийся обычным компонентом плазмы крови.
При распаде 1 г гемоглобина образуется 34 мг билирубина. Будучи водонерастворимым, свободный билирубин соединяется с альбумином плазмы, который служит основным его транспортером в плазме крови. Установлено, что каждая молекула альбумина реагирует с двумя (или даже тремя) молекулами билирубина.
Комплекс «альбумин—билирубин», доставленный с током крови в печень, на поверхности плазматической мембраны гепатоцита подвергается диссоциации. При этом высвобожденный билирубин образует временный ассоциат с липидами плазматической мембраны и перемещается через нее благодаря деятельности определенных ферментных систем. Дальнейшее прохождение свободного билирубина в клетку происходит при участии в этом процессе двух белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z.
Лигандин и протеин Z обнаружены также в почках и кишечнике, поэтому при недостаточности функции печени они способны компенсировать ослабление процессов детоксикации в этом органе.
В клетках печени под влиянием фермента глюкуронилтрансферазы, осуществляющей перенос активных форм молекул глюкуроновой кислоты (уридиндифосфоглюкуроновой кислоты) на свободный билирубин, образуются билирубиндиглюкурониды (до 80%) и билирубинмоноглюкурониды.
И те и другие достаточно хорошо растворимы в воде, но лишены способности перемещаться через липидный слой мембраны. За счет связывания билирубина с глюкуроновой кислотой присущая свободному билирубину токсичность в значительной мере теряется. Гидрофобный, липофильный свободный билирубин, легко растворяясь в липидах мембраны и проникая вследствие этого в митохондрии, разобщает в них дыхание и окислительное фосфорилирование, нарушает синтез белка, поток ионов калия через мембрану клеток и органелл. Это отрицательно сказывается на состоянии центральной нервной системы, вызывая у больных ряд характерных неврологических симптомов.
В настоящее время под свободным билирубином принято понимать неконъюгированный (с глюкуроновой кислотой) билирубин, который из-за плохой растворимости в воде дает трудную, непрямую (происходящую лишь после внесения в пробу этилового спирта или другого ускорителя, «акселератора») реакцию с ди-азореактивом Ван ден Берга. Поэтому его раньше именовали «непрямой» билирубин.
Билирубинглюкурониды (или связанный, конъюгированный билирубин) в отличие от свободного билирубина тотчас вступают в реакцию с диазореактивом («прямой» билирубин). Следует иметь в виду, что в самой плазме крови билирубин, не конъюгированный с глюкуроновой кислотой, может быть либо связан с альбумином, либо нет. Последняя фракция (не связанного ни с альбумином, ни с липидами, ни с другими компонентами крови билирубина) наиболее токсична.
источник
Распад гемоглобина в тканях (образование желчных пигментов)
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе оба процесса могут происходить и в клетках других органов. Распад гемоглобина в печени начинается с разрыва α-метиновой связи между I и II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей ок-сидазой и приводит к образованию зеленого пигмента вердоглобина (холеглобина):
В приведенных структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа, В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН) – остаток пропионовой кислоты.
Как видно из приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и белковый компонент. Имеются экспериментальные доказательства, что в этом окислительном превращении гемоглобина принимают участие витамин С, ионы Fe 2+ и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит спонтанно с освобождением железа, белка-глобина и образованием одного из желчных пигментов – биливердина. Спонтанный распад сопровождается перераспределением двойных связей и атомов водорода в пиррольных кольцах и метиновых мостиках. Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных:
Основное место образования билирубина – печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метиновых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха.
В крови взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л. Около 75% этого количества приходится на долю непрямого билирубина. Повышение его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой билирубин, поступая с током крови в печень, подвергается обезвреживанию путем связывания с глюку-роновой кислотой. В этом процессе принимают участие особый фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка глюкуроновой кислоты с образованием сравнительно индифферентного комплекса – билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с диазореактивом. В желчи всегда присутствует прямо
