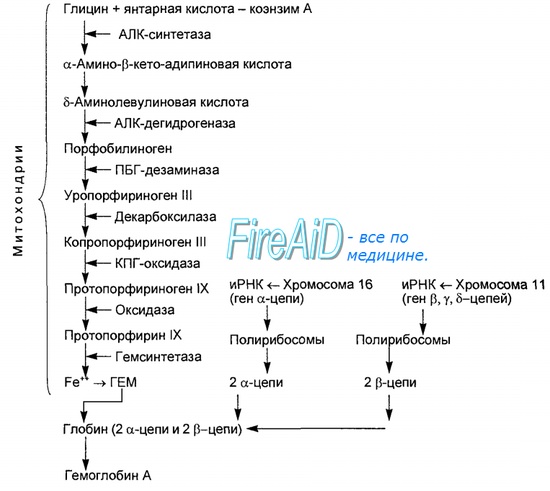
Схема синтеза гемоглобина у человека

Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Источник

Синтез гемоглобина происходит в костном мозге. Он образуется из гема и глобина. Гем – это соединение порфирина и железа, а глобин представлен двумя цепочками аминокислот: 2 альфа и 2 бета.
Один гем и глобин называются субъединицей, в гемоглобине их 4. Каждая может присоединять из воздуха и отдавать клетке кислород, а в обратном направлении переносится углекислый газ. При недостатке железа развивается железодефицитная анемия, так как железо удерживает части гема, обеспечивает соединение гема и глобина.
При нарушении образования цепей глобина развивается талассемия со склонностью к тромбозу и серповидно-клеточная анемия с поражением печени, селезенки, накоплением железа. Если есть врожденный дефект синтеза порфирина, то возникают порфирии, их типичный признак – это красная моча. Печеночная порфирия также появляется при злоупотреблении снотворными группы барбитуратов.
Синтез гемоглобина: пояснение простыми словами
Синтез гемоглобина проходит в клетках-предшественниках эритроцитов – эритробластах и ретикулоцитах костного мозга. Для его образования нужны порфирины, глобин (белок) и ионы железа. Порфирин – это аморфное (некристаллическое) вещество, при пропускании через него света появляется красное окрашивание. Источниками для его синтеза является аминокислота, глицин и коэнзим А (производное янтарной кислоты).
Из порфирина и железа образуется гем. Биохимия этого процесса включает ряд последовательных реакций с появлением порфобилиногена. Потом требуется его 4 молекулы для формирования комплекса уропорфириногена, превращающегося в протопорфирин. Именно последний и соединяется с железом. Одновременно и в том же количестве образуется белок глобин из аминокислот. При соединении гема и глобина появляется гемоглобин.
Для нормального образования гема требуется витамин В6, В12, фолиевая кислота, ионы меди и кобальта. Поэтому при однообразном питании с дефицитом мяса, овощей, ягод и круп уменьшается синтез гемоглобина. Также причиной нарушений бывают и врожденные болезни с нарушением усвоения витаминов и минералов. Так развиваются дефицитные анемии. Наиболее известная и распространенная форма – это железодефицитная, но возможны и фолиеводефицитная, В12-дефицитная.
Какую структуру имеет молекула гемоглобина
Молекула гемоглобина в структуре содержит белковую часть – глобин и пигментный комплекс с железом (гем). У взрослого человека белок имеет 2 альфа и 2 бета цепи, они состоят из 141 и 146 аминокислот соответственно. Нормальный гемоглобин имеет обозначение HbA1. Следовые количества представлены HbA2, в нем вместо бета-цепей есть дельта-цепи. Такой комплекс прочно удерживает кислород и с трудом его отдает тканям.
В крови у плода есть два вида гемоглобина – эмбриональный и фетальный. Они имеют другую первичную структуру. У новорожденного 80% составляет фетальный, а к концу первого месяца молекула приобретает вид обычного, характерного для взрослого.
Число гемов в составе молекулы
Молекула гемоглобина состоит из четырех гемов. Каждый гем внутри содержит железо и окружен глобином, образующим гемовый «карман». Такое расположение обеспечивает растворимость и возможность соединения с кислородом. Каждая субъединица может связывать одну молекулу кислорода.
Поэтому на каждый гемоглобин эритроцита приходится 4 молекулы кислорода. После того, как доставка кислородных молекул завершена, гемоглобин забирает из тканей углекислоту, и в легких она выделяется в воздух при выдохе.
Роль железа в синтезе гемоглобина
Железо является необходимым компонентом для синтеза гемоглобина, так как оно обеспечивает связи ядер порфирина, аминокислот глобина, то есть оно удерживает весь комплекс. Биологическая роль железа состоит также в:
- связывании кислорода в легких;
- транспортировке кислорода к тканям и внутриклеточном переносе к митохондриям;
- использовании кислородных ионов для образования энергии;
- обезвреживании токсичных соединений.
Источниками минерала является пища и ионы, образовавшиеся при распаде гемоглобина (повторное использование). Усиление всасывания железа из кишечника происходит при снижении его запасов. Хранится микроэлемент в виде ферритина.
Болезни с нарушением синтеза гемоглобина
Снижение синтеза гемоглобина происходит при дефицитных анемиях, но есть и более редкие формы нарушений – образование неправильных цепей глобина (гемоглобинозы) и дефекты порфирина (порфирии).
Гемоглобинозы
Гемоглобинозы делятся на гемоглобинопатии и талассемии.
Гемоглобинопатии характеризуются образованием гемоглобина неправильной структуры. Могут протекать бессимптомно при мелких изменениях или тяжело при существенных аномалиях. Примером опасной формы является серповидно-клеточная анемия. При ней образуется HbS. Глутаминовая кислота в нем заменена на валин в шестом положении бета-цепи. Это приводит к снижению растворимости гемоглобина внутри эритроцита, и он образует осадок в виде серпа. Для этого заболевания характерны:
- нарушение кровотока в мелких сосудах;
- склонность к тромбозам;
- высокий риск инсульта, инфаркта;
- ускоренное разрушение эритроцитов (гемолитическая анемия);
- одышка, особенно при физических нагрузках.
При талассемии нарушается синтез одной из цепей гемоглобина. Чаще всего изменяется бета-цепь. Фетальный гемоглобин из-за этого не превращается в полноценный HbA1, его в крови у взрослых содержится до 60%, а вторая форма с плохой отдачей кислорода HbA2 составляет около 15%. Эти формы гемоглобина нестойкие, поэтому эритроциты быстро разрушаются. Болезнь сопровождается:
- разрастанием и разрушением костного мозга;
- изменениями формы лица и черепа;
- поражением селезенки и печеночной ткани;
- увеличением количества железа в сыворотке крови и его отложением в тканях.
Причиной смерти больного чаще всего бывает сердечная недостаточность из-за накопления железа в миокарде.
Порфирии
Нарушение янтарно-глицинового пути образования порфирина приводит к порфирии. Это врожденные и приобретенные болезни, наиболее распространены эритроцитарная и печеночная. Первая характеризуется дефектом ферментов, участвующих в синтезе гема. В организме накапливается уропорфириноген, он не может включиться в гемовый остаток и выделяется с мочой, концентрируется в костном мозге. Типичные признаки:
- красная моча;
- ускоренное разрушение эритроцитов;
- красноватый оттенок зубов;
- высокая чувствительность к солнечным лучам.
Печеночная порфирия бывает врожденной и на фоне злоупотребления барбитуратами (снотворные). Моча имеет цвет красного вина, больные предъявляют жалобы на частую рвоту, запоры, нарушения работы сердца, боль в животе. Нередко возникают психические расстройства.
Для синтеза гемоглобина нужно железо, белок, витамины, немного меди и кобальта. Его образование происходит в костном мозге, а при нарушении возникает талассемия, порфирии, серповидно-клеточная и дефицитные анемии.
Источник
Гемоглобин синтезируется в клетках костного мозга. Все необходимые для синтеза гемоглобина составные части поступают с током крови.
Белковая часть молекулы синтезируется как и все простые белки из аминокислот матричным способом.
Синтез гема протекает в несколько стадий под влиянием различных ферментов:
1. Вначале происходит образование дельта-аминолевулиновой кислоты. Это реакция протекает в результате конденсации сукцинил-КоА и глицина в митохондриях под действием фермента аминолевулинатсинтетазы.
2.Следующая реакция протекает в цитоплазме. Происходит образование порфобилиногена в результате реакции конденсации двух молекул дельта-аминолевулиновых кислот.
3.Затем, в результате многоступенчатых реакций из четырех монопиррольных молекул порфобилиногена образуется протопорфирин 1Х, являющийся непосредственным предшественником гема.
4. Протопорфирин IX присоединяет молекулу железа (реакция осуществляется под влиянием фермента гемсинтетазы или феррохелатазы) и образуется гем, который затем используется для биосинтеза всех гемопротеидов. Оба фермента, участвующие в синтезе ПБГ, регулируемые, они ингибируются гемом и НЬ. Поэтому гем не образуется в избытке или недостатке. Также строго в определенном количестве образуется и белковая часть Нb, т. к. ее синтез может происходить только в присутствии тема, и образующиеся полипептидные цепи тут же соединяются с гемом. При низкой концентрации гема, когда нарушается его синтез, образование гемоглобина также замедляется.
Каждая из образовавшихся полипетидных цепей глобина присоединяются кодному гему, образуя моном ер гемоглобиан. 4 таких мномера, объединивщись, образуют гемоглобин.
Основной функцией гемоглобина является перенос кислорода из легких к тканям и перенос углекислого газа от тканей к легким, участие в поддержке рН крови. Свои функции гемоглобин выполняет только в составе эритроцита. Продолжительность жизни эритроцита 110-120 дней. Затем эритроцит подвергается гемолизу
3. Распад гемоглобина. Превращение билирубина в желудочно- кишечном тракте. Свободный и связанный билирубин. Свойства.
При гемолизе эритроцитов гемоглобин попадает в кровь и соединяется с белком гаптоглобином, в виде комплекса гемоглобин-гаптоглобин (Нр-Нb) транспортируется в клетки макрофагально-моноцитарной системы (ММС): это Купферовы клетки печени, клетки лимфоузлов, селезенки, пейеровых бляшек в кишечнике.
Процесс начинается с окислительного расщепления метинового мостикамежду первым и вторым пиррольными кольцами и образуется вердоглобин. Затем от вердоглобина отщепляется глобин, железо и образуется биливердин (зеленого цвета), вещество линейной структуры. Железо соединяется с b-глобулинами и в виде трансферина доставляется в печень и селезенку, где депонируется в виде ферритина. Глобин распадается так же как и все простые белки до аминокислот.
Биливердин восстанавливается за счет НАДФН2 в неконьюгированный,
свободный билирубин, который не растворим в воде и является токсичным соединением. Свободный билирубин выходит из клеток ММС, соединяется с
альбуминами и поступает в гепатоциты. В крови он называется непрямым потому, что дает реакцию с реактивом Эрлиха не сразу, а после добавления в сыворотку крови кофеинового реактива или спирта для осаждения белка.
В Купферовых клетках печени распад гемоглобина также начинается с
образования вердоглобина, затем биливердина. В печени непрямой билирубин обезвреживается в гепатоцитах путем реакции конъюгации, соединяясь с одной или двумя молекулами глюкуроновой кислоты, образуя моно- или диглюкуронид билирубина. Такой билирубин называется конъюгированным и
связанным и прямым. Этот билирубин хорошо растовряется в воде, не обладает токсическими свойствами. Биливердин и прямой билирубин собираются в желчном пузыре, придавая желчи оливковый цвет и потому их относят к пигментам желчи. Желчь поступает в тонкий кишечник, но в желчном протоке прямой билирубин, теряя глюкуроновые кислоты, снова превращается в непрямой. Биливердин проходит через весь кишечник не изменяя своей химической структуры и удаляется с калом, окрашивая его в зеленоватый цвет, т.е. он является пигментом кала. А непрямой билирубин в кишечнике восстанавливается до мезобилиногена (уробилиногена), часть которого всасывается в воротную вену и возвращается в печень, где распадается до бесцветных моно- и дипирролов. Последние выводятся через почки вместе с мочой.
Большая часть мезобилиногена поступает в толстый кишечник, где под
влиянием ферментов микроорганизмов восстанавливается в стеркобилиноген. Часть стеркобилиногена, всасываясь в кровь через геморроидальные вены, попадает в почки. В моче под действием света и воздуха происходит окисление стеркобилиногена до стеркобилина, который придает моче желтый цвет, т.е. является пигментом мочи. Остальная часть стеркобилиногена окисляется в толстом кишечнике на свету до стеркобилина и вместе с биливердином является пигментом кала, придавая ему коричнево-зеленый цвет.
У грудных детей в кишечнике нет гнилостных бактерий, поэтому
билирубин не превращается в стеркобилиноген и выводится как таковой. Соответственно цвет кала у детей обусловлен биливердином и билирубином (желто-зеленый).
У детей в первые три месяца эмбрионального периода образуется эмбриональный гемоглобин. Затем он преобразуется в фетальный (гемоглобин F), который доминирует вплоть до рождения ребенка. После рождения в течение первого месяца жизни фетальный гемоглобин постепенно заменяется на гемоглобин взрослого (гемоглобин А), отличающегося составом полипептидных цепей. Эмбриональный и фетальный гемоглобин обладают более высоким сродством к кислороду по сравнению с гемоглобином взрослого.
Пигменты желчи, кала и мочи.
При распаде гемоглобина образуются пигменты желчи, кала и мочи.
Пигменты желчи: биливердин (зеленого цвета), связанный билирубин (глюкурониды билирубина –желтого цвета). Цвет желчи зависит от соотношения этих пигментов.
Пигменты кала: биливердин (зеленого цвета), стеркобилин (коричневого цвета)
Пигмент мочи: стеркобилин
Цвет сыворотки крови тоже зависит в определенной степени от наличия в ней билирубина. В норме количество общего билирубина в крови равно 8—20 мкмоль/л, на долю непрямого билирубина приходится 75- 100%, а прямого от 0 до 25%. Количество прямого билирубина незначительно. Прямой билирубин проходит через пачечную ткань, и появляется в моче, непрямой билирубин в моче появиться не может, вследствие его нерастворимости в воде.
Источник
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; van Holde, KE & Ahern, KG (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & Chothia, C (1976), Structural patterns in globular proteins, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник