Синтез гемоглобина при эритропоэзе
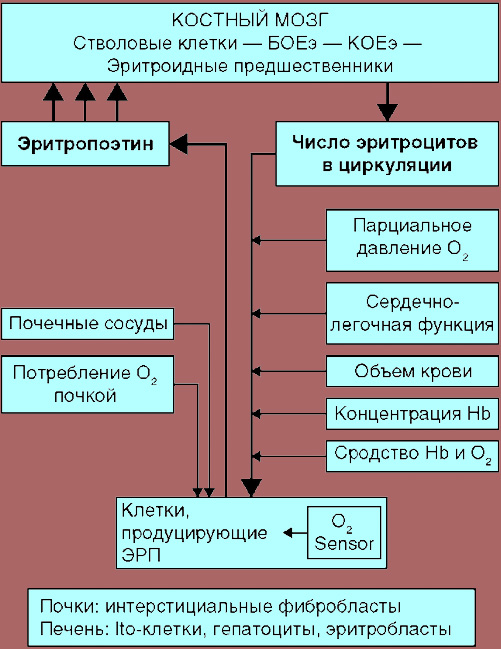
Эритропоэ́з (от греч. «erythro — «красный», и греч. poiesis — «делать») — это одна из разновидностей процесса гемопоэза (кроветворения), в ходе которой образуются красные кровяные клетки (эритроциты). Эритропоэз стимулируется уменьшением доставки кислорода к тканям, которое детектируется почками. Почки в ответ на тканевую гипоксию или ишемию выделяют гормон эритропоэтин, который стимулирует эритропоэз[2]. Этот гормон стимулирует пролиферацию и дифференциацию клеток-предшественников красного кровяного ростка, приводя тем самым к ускоренному эритропоэзу в кроветворных тканях и к увеличению выхода эритроцитов в кровь[2]. У птиц и млекопитающих (включая человека) после рождения гемопоэз — и в том числе эритропоэз — осуществляется в костном мозге, который и является единственной кроветворной тканью в норме после рождения[2]. У ранних эмбрионов и плодов гемопоэз происходит в мезодермальных клетках желточного мешка. Начиная с третьего месяца беременности, у человека гемопоэз (и в частности эритропоэз) начинает происходить в фетальной печени и фетальной селезёнке[3]. После 7-го месяца беременности гемопоэз у плода происходит преимущественно в костном мозге. Повышение физической активности (то есть повышение потребности тканей в кислороде), а также кровопотеря, курение (то есть пониженная доставка кислорода тканям из-за хронического воздействия угарного газа), пребывание в горах (то есть в местности с пониженным парциальным давлением кислорода), некоторые сердечно-сосудистые заболевания (например, сердечная недостаточность) и лёгочные заболевания (например, хроническая бронхообструктивная болезнь), приводящие к нарушению доставки кислорода тканям, могут способствовать усилению эритропоэза. Напротив, при почечной недостаточности с нарушением выработки эритропоэтина, при дефиците белков, витамина B12 или фолиевой кислоты, железа и других нутриентов, при хронических инфекциях, при злокачественных опухолях, при ряде интоксикаций, при ряде заболеваний костного мозга (например, таких, как миелодиспластический синдром или лейкоз) — наблюдается нарушение или угнетение эритропоэза, приводящее к снижению уровня гемоглобина и эритроцитов — к развитию анемии[4]. У людей с некоторыми заболеваниями и у некоторых видов животных при некоторых обстоятельствах гемопоэз, и в том числе эритропоэз, может также происходить и вне пределов костного мозга, в печени и/или селезёнке. Это называется «экстрамедуллярный (внекостномозговой) гемопоэз».
Костный мозг практически всех костей тела человека участвует в выработке клеток крови (гемопоэзе) приблизительно до 5 лет. Кости бедёр и голеней прекращают вносить существенный вклад в гемопоэз приблизительно к 25 годам. Костный мозг, расположенный в костях позвонков, грудины, таза и рёбер, а также кости черепа продолжают вносить вклад в гемопоэз в течение всей жизни человека.
Дифференциация эритроцитов[править | править код]
В процессе созревания эритроцитов клетка кровяного ростка в костном мозгу проходит несколько последовательных стадий деления и созревания (дифференциации), а именно:
- Гемангиобласт, первичная стволовая клетка — общий прародитель клеток эндотелия сосудов и кроветворных клеток, превращается в
- Гемоцитобласт, или плюрипотентную гемопоэтическую стволовую клетку, превращается в
- CFU-GEMM, или общего миелоидного предшественника — мультипотентную гемопоэтическую клетку, а затем в
- CFU-E, унипотентную гемопоэтическую клетку, полностью коммиттированную в эритроидную линию, а затем в
- пронормобласт, также называемый проэритробластом или рубрибластом, а затем в
- Базофильный или ранний нормобласт, называемый также базофильным или ранним эритробластом или прорубрицитом, а затем в
- Полихроматофильный или промежуточный нормобласт/эритробласт, или рубрицит, а затем в
- Ортохроматический или поздний нормобласт/эритробласт, или метарубрицит. В конце этой стадии клетка избавляется от ядра, прежде чем стать
- Ретикулоцитом, или «юным» эритроцитом.
После завершения 8-й стадии получившиеся клетки — то есть ретикулоциты — выходят из костного мозга в общее кровеносное русло. Таким образом, среди циркулирующих красных кровяных клеток около 1 % составляют ретикулоциты. После 1—2 дней пребывания в системном кровотоке ретикулоциты заканчивают созревание и становятся, наконец, зрелыми эритроцитами.
Все эти стадии развития сопровождаются соответствующими морфологическими изменениями внешнего вида клетки при окраске по Райту и рассмотрении в световой микроскоп, а также определёнными биохимическими и иммунофенотипическими изменениями.
В частности, в процессе созревания базофильный пронормобласт, крупная клетка с огромным ядром, имеющая объём в среднем 900 фемтолитров, превращается в безъядерный диск объёмом в 10 раз меньше — в среднем приблизительно 95 фемтолитров. На стадии ретикулоцита клетка уже избавилась от ядра, но всё ещё способна накапливать и производить дополнительный гемоглобин, поскольку имеет «оборудование» для производства белка — рибосомы. Зрелые же эритроциты лишены не только ядра, но и рибосом, и поэтому нового гемоглобина не накапливают, а лишь транспортируют и используют уже имеющийся в течение отведённого им срока жизни. По этой же причине зрелые эритроциты, в отличие от ретикулоцитов, лишены поверхностных рецепторов к трансферрину (то есть не способны более захватывать и усваивать дополнительное железо).
Критически необходимым для созревания красных кровяных клеток (эритроцитов) является достаточное поступление витамина B12 (кобаламина) и фолиевой кислоты, а также витамина B6 (пиридоксина) и витамина B2 (рибофлавина), особенно первых двух. Дефицит любого из них вызывает нарушение процессов созревания эритроцитов, что клинически проявляется анемией (снижением содержания в крови эритроцитов и гемоглобина), макроцитозом (аномально крупными размерами эритроцитов), мегалобластозом костного мозга или, иначе говоря, мегалобластным типом кроветворения (аномально крупными размерами проэритробластов и эритробластов, называемых в этом случае соответственно промегалобластами и мегалобластами) и ретикулоцитопенией (аномально низким количеством ретикулоцитов в крови). При этом каждый отдельный эритроцит не только крупнее обычного, но и — компенсаторно — обычно содержит гемоглобина больше, чем в норме. Цветной показатель крови при этом может быть больше единицы («гиперхромная анемия») или нормален («нормохромная анемия»), но самих эритроцитов образуется меньше, чем нужно, поскольку витамин B12 и фолиевая кислота критически необходимы для деления клеток-предшественников эритроцитарного ростка. Это называется мегалобластной анемией.
Для синтеза гемоглобина клеткам-предшественникам эритроцитов необходимо железо. Дефицит железа вызывает снижение как общего содержания гемоглобина в крови, так и его содержания в каждом отдельном эритроците (то есть, в противоположность предыдущему случаю, гемоглобина в каждом отдельном эритроците не больше, а меньше нормы), а также может вызывать уменьшение размеров эритроцитов («микроцитоз», «микроцитарная анемия»). Либо же размеры эритроцитов не изменяются, но количество гемоглобина в них ниже нормы («нормоцитарная» гипохромная анемия, то есть с обычных размеров, но более бледными эритроцитами). Может также наблюдаться некоторое (меньшее, чем при дефиците витамина B12 или фолиевой кислоты) уменьшение количества эритроцитов. Цветной показатель крови при этом либо нормален и не изменен («нормохромная анемия»), либо снижен («гипохромная анемия»). И опять-таки отмечается аномально низкое количество ретикулоцитов в крови — ретикулоцитопения.
После кровопотери или при гипоксии (например, при подъёме в горы или переезде в горную местность или развитии легочного либо сердечно-сосудистого заболевания с гипоксией), или при стимулировании эритроцитарного ростка костного мозга экзогенно введённым эритропоэтином, или в фазе восстановления после химиотерапии, или при назначении больному с дефицитом B12, фолиевой кислоты или железа препаратов, компенсирующих эти дефициты, напротив, количество ретикулоцитов в крови временно возрастает — развивается ретикулоцитоз, который служит признаком усиления эритропоэза. Ретикулоцитоз при этом сохраняется до компенсации анемии (восстановления нормального уровня гемоглобина и эритроцитов) и устранения причины анемии.
Изменения характеристик клеток-предшественников эритроцитов в процессе эритропоэза[править | править код]
В процессе созревания клеток эритроцитарного ростка изменяется их ряд морфологических характеристик. В частности:
- Уменьшаются размеры клетки;
- Цитоплазматический матрикс увеличивается в количестве;
- Окраска клетки меняется с голубой (базофильной) на розоватую, розовую и затем красную вследствие уменьшения содержания в клетке РНК и ДНК и накопления гемоглобина;
- Уменьшаются размеры ядра клетки, причём в конце созревания оно не только уменьшается в размерах, но и становится характерно «сморщенным», а затем выталкивается из клетки, которая лишается ядра на стадии ретикулоцита;
- У незрелых клеток эритроидного ряда ядро содержит открытый, рыхло упакованный хроматин, в процессе созревания хроматин становится всё более плотно упакованным, конденсированным[5].
Регуляция эритропоэза[править | править код]
Продукция эритроцитов, то есть интенсивность процессов эритропоэза, регулируется петлёй отрицательной обратной связи при участии гормона эритропоэтина. Эта система саморегулируется таким образом, чтобы в нормальном, здоровом состоянии организма скорость производства костным мозгом новых эритроцитов приблизительно соответствовала скорости разрушения «пожилых» (уже деформировавшихся от старости и потому захваченных и разрушенных клетками ретикулоэндотелиальной системы и в частности макрофагами селезёнки), то есть чтобы уровень гемоглобина и эритроцитов в крови оставался приблизительно постоянным. А уровень этот поддерживается таким, чтобы количество гемоглобина и эритроцитов было достаточным для обеспечения адекватного снабжения тканей (и в частности печени и почек) кислородом, но при этом чтобы это количество эритроцитов также не было чрезмерным, вызывающим чрезмерное «сгущение крови», повышение её вязкости, агглютинацию («склеивание») эритроцитов в кровяном русле, чрезмерное увеличение объёма крови и повышение артериального давления, развитие тромбозов, инфарктов или инсультов. Эритропоэтин выделяется в печени и почках в ответ на пониженное содержание в их тканях кислорода (то есть на ухудшение кислородного снабжения ткани печени или почек, чем бы оно ни было вызвано — анемией, спазмом сосудов почек или печени, недостаточным содержанием кислорода в воздухе, заболеванием лёгких или сердца, сосудов — не суть важно, механизм сработает). Кроме того, циркулирующий в крови эритропоэтин связывается циркулирующими эритроцитами, поэтому низкое содержание эритроцитов в крови приводит к повышению количества свободного (не связанного с эритроцитами) эритропоэтина, что приводит к стимуляции производства эритроцитов костным мозгом и к повышению их содержания в крови. Вследствие этого кислородное снабжение печени и почек улучшается (так как эритроцитов и гемоглобина в крови стало больше), снижается продукция ими эритропоэтина, а уровень свободного (несвязанного) эритропоэтина снижается из-за связывания увеличившимся количеством эритроцитов. Таким образом система предотвращает чрезмерное нарастание количества эритроцитов в ответ на стимуляцию и негативные последствия этого чрезмерного нарастания, и самобалансируется.
Кроме того, как продукция эритропоэтина почками и печенью, так и продукция красных кровяных клеток костным мозгом находятся под контролем и ряда других гормонов. В частности, стрессовый гормон кортизол также способен как увеличивать продукцию эритропоэтина почками и печенью, так и непосредственно стимулировать эритроцитарный росток костного мозга. Физиологическое значение этого заключается в том, что для реализации стрессовых реакций по типу «бей или беги» повышенная продукция эритроцитов и улучшение кислородного снабжения тканей (особенно мышц, мозга, миокарда) предоставляет преимущество. Значение при патологии — в том, что при недостаточности коры надпочечников (болезни Аддисона) нередко отмечается анемия, а при гиперкортицизме (болезни Кушинга) — нередко чрезмерный эритроцитоз.
Также на продукцию эритроцитов положительно влияют половые гормоны, особенно мужские (поэтому содержание гемоглобина и эритроцитов у мужчин выше, чем у женщин), гормоны щитовидной железы, соматотропин, инсулин. Физиологическое значение этого заключается в том, что в период роста и созревания организма ребёнка или подростка, параллельно общему росту, увеличивается и интенсивность процессов эритропоэза. Значение при патологии — в том, что при ряде эндокринных недостаточностей, например, сахарном диабете, гипотиреозе, нередко наблюдается умеренно выраженная анемия, а при состояниях, сопровождающихся гиперпродукцией гормонов (например, тиреотоксикозе), иногда бывает умеренный эритроцитоз.
Последние исследования показывают также, что пептидный гормон гепсидин может играть важную роль в регуляции продукции гемоглобина и тем самым в регуляции эритропоэза. Гепсидин производится печенью и регулирует все аспекты обмена железа — скорость абсорбции железа в желудочно-кишечном тракте, скорость высвобождения железа из клеток ретикулоэндотелиальной системы, в частности макрофагов костного мозга, скорость продукции железосвязывающих белков печенью, экскрецию железа почками. А поскольку для того, чтобы эритроциты были способны производить гемоглобин, макрофаги костного мозга должны их снабдить высвобождаемым из них железом, то гепсидин, тем самым, регулирует и скорость образования гемоглобина. Регулятором для уровня гепсидина является содержание железа в печени и в крови.
Утрата функции эритропоэтинового рецептора или белка JAK2 в мышиных клетках вызывает нарушение эритропоэза, поэтому продукция красных кровяных клеток у эмбриона мыши нарушается и вместе с этим нарушается нормальный рост и развитие эмбриона. И напротив, если отключить механизм отрицательной обратной связи (супрессоры цитокиновых сигналов) и позволить неограниченную продукцию эритропоэтина, это вызывает у мышей гигантизм (развитие необычно крупных мышек). Нарушения в экспрессии гепсидина в ту или другую сторону приводят к мышкам с врождённой тяжёлой железодефицитной анемией или, наоборот, с гемосидерозом (болезнью накопления железа)[6][7].
См. также[править | править код]
- Анемия: состояние, характеризующееся аномально низким уровнем функционально активного (способного транспортировать кислород) гемоглобина в крови;
- Истинная полицитемия: состояние, характеризующееся аномально высоким содержанием эритроцитов и гемоглобина в крови.
Примечания[править | править код]
- ↑
Le, Tao; Bhushan, Vikas; Vasan, Neil. (неопр.). — USA: The McGraw-Hill Companies, Inc., 2010. — С. 123. — ISBN 978-0-07-163340-6. - ↑ 1 2 3 Sherwood, L, Klansman, H, Yancey, P: Animal Physiology, Brooks/Cole, Cengage Learning, 2005
- ↑ Palis J., Segel G. B. Developmental biology of erythropoiesis (англ.) // Blood Rev. (англ.)русск. : journal. — 1998. — June (vol. 12, no. 2). — P. 106—114. — doi:10.1016/S0268-960X(98)90022-4. — PMID 9661799.
- ↑
Le, Tao; Bhushan, Vikas; Vasan, Neil. First Aid for the USMLE Step 1: 2010 20th Anniversary Edition (англ.). — USA: S&P Global, 2010. — P. 124. — ISBN 978-0-07-163340-6. - ↑ Textbook of Physiology by Dr. A. K. Jain reprint 2006—2007 3rd edition
- ↑ Nicolas G., Bennoun M., Porteu A., Mativet S., Beaumont C., Grandchamp B., Sirito M., Sawadogo M., Kahn A., Vaulont S. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2002. — April (vol. 99, no. 7). — P. 4596—4601. — doi:10.1073/pnas.072632499. — PMID 11930010.
- ↑ Michael Föller, Stephan M. Huber , Florian Lang. Erythrocyte programmed cell death (неопр.) // IUBMB Life. — 2008. — August (т. 60, № 10). — С. 661—668. — doi:10.1002/iub.106. — PMID 18720418. (недоступная ссылка)
Ссылки[править | править код]
- Microscopic Hematology
- More information on erythropoiesis
Медицина / Физиология / Физиология (статья)
Эритропоэз: Гемоглобин и Эритроциты. Часть 2
Статья |
14-10-2018, 19:24
|
 ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ: Эритропоэз: Гемоглобин и Эритроциты. Часть 1
ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ: Эритропоэз: Гемоглобин и Эритроциты. Часть 1
РЕГУЛЯЦИЯ ЭРИТРОПОЭЗА
Массу эритроцитов, которая циркулирует в крови, можно сравнить с большим специализированным органом, основной задачей которого является транспорт кислорода от легких к тканям организма. Процесс удаления эритроцитами углекислого газа из тканей происходит посредством карбоангидразы. Количество эритроцитов в крови и скорость их образования в костном мозге тесно взаимосвязаны с процессом обеспечения тканей кислородом (см рисунок 10).
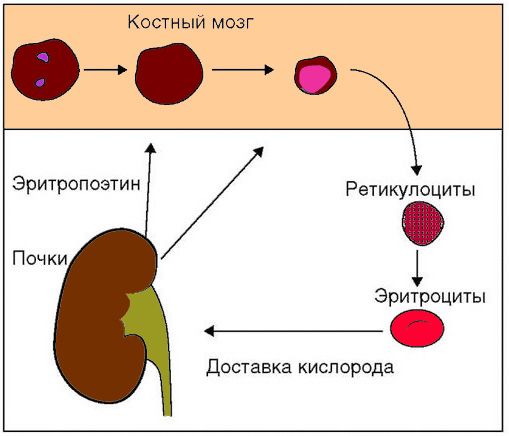
Рисунок 10. Регуляция эритропоэза
Ведущая роль эритроцитов в переносе кислорода позволяет сделать вывод, что главный фактор, влияющий на скорость эритропоэза – отношение между доставкой кислорода в ткани и метаболические потребности этих тканей.
То есть, основной стимул для продукции эритроцитов – гипоксия (дефицит кислорода в тканях). И наоборот, при увеличении количества эритроцитов в циркулирующей крови или гипероксии (чрезмерном снабжении тканей кислородом), скорость эритропоэза снижается. Долгое время ученые полагали, что фактором регуляции скорости эритропоэза является парциальное давление кислорода непосредственно в костном мозге. Такая «гипоксическая» концепция предполагала, что костный мозг даже в нормальном состоянии испытывает незначительно кислородное голодание, благодаря чему происходит стимул эритропоэза. Но непосредственное стимулирующее влияние гипоксии на продукцию клеток эритрона ученые доказать не смогли. Напротив, выяснилось, что для повышения продукции эритроцитов и высокой скорости пролиферации ядросодержащих эритроидных клеток необходимо нормальное или даже повышенное парциальное давление кислорода в костном мозге. Многолетние исследования показали, что состояние гипоксии оказывает не прямой стимул на эритропоэз, а опосредованный, с помощью эритропоэтина (ЭПО) – почечного эритропоэтического гормона (см рисунок 11).

Рисунок 11. Роль эритропоэтина в регуляции эритропоэза
Уровень эритроцитов в крови зависит от координации образования и разрушения клеток эритрона. В нормальных условиях эти противоположные процессы на в состоянии стабильного динамического баланса, обеспечивающегося соответствующими регуляторными механизмами. Скорость образования эритроцитов регулируется с помощью стимулов (сигналов обратной связи), которые образую ткани, нуждающиеся в O2 (функциональная обратная связь), или сами эритроциты (обратная связь конечным продуктом).
Продукция почечного и внепочечного эритропоэтина зависит от степени гипоксической, циркуляторной, анемической и тканевой (гистотоксической) гипоксии. Уровень эритропоэтина в плазме крови может колебаться от практически нулевого (у пациентов истинной полицитемией в результате аутотрансфузирования) до 10 000 мМЕ/мл и выше (у пациентов при тяжелой гипоксии). У человека, проживающего на местности на уровне моря, нормальный уровень эритропоэтина в крови составляет примерно 10-15 мМЕ/мл; ученые полагают, что именно такая концентрация ЭПО позволяет поддерживать уровень гемоглобина в пределах 130-150 г/л, а парциальное давление кислорода в почках адекватно для синтеза эритропоэтина, чтобы обеспечить такую концентрацию. Механизм обратной связи «костный мозг – почки» обеспечивает регуляцию скорости образования эритроцитов. Регуляция синтеза эритропоэтина позволяет контролировать его концентрацию в крови в пределах 5-30 мМЕ/мл до момента, пока уровень гемоглобина в крови не уменьшается ниже 105 г/л.
При недостаточном снабжении тканей кислородом или повышение их потребностей в кислороде стимулируется синтез эритропоэтина. И наоборот – при повышенном снабжении тканей кислородом или снижением потребностей в кислороде, образование эритропоэтина ингибируется. Такой реципрокный механизм хорошо демонстрирует, что биогенез эритропоэтина определяется в первую очередь сенсорным механизмом, который взаимосвязан с аэробным метаболизмом клеток, синтезирующих ЭПО. Ответная реакция на эритропоэтин возникает в результате взаимодействия гормона с чувствительными к нему клетками-мишенями в костном мозге. Конечный эффект действия эритропоэтина – повышение количества образования клеток эритрона с целью восстановления нарушенного баланса между снабжением тканей кислородом и их потребностями в нем. То есть, эритропоэтин, выделяемый почками, выступает в роли посредника между клетками-потребителями кислорода и клетками-продуцентами гемоглобинсодержащих клеток эритрона, находящихся в костном мозге.
Ученые долгое время не могли выявить наличие эритропоэтина в крови или моче животных и людей, что было связано с отсутствием на тот момент достаточно чувствительных методов анализа. Технический и научный прогресс позволил специалистам определять и измерять количественно уровень эритропоэтина в крови и моче. Доказательства присутствия эритропоэтина не только в условиях гипоксии, но и в нормальных условиях позволили сделать вывод, что этот гормон участвует в регуляции эритропоэза и контролирует продукцию эритроцитов.
ОБМЕН ЖЕЛЕЗА
Железо (Ferrum, Fe) – один из самых распространенных металлов, уникальной особенностью которого является способность изменять свою валентность (состояние окисления и окислительно-восстановительный потенциал) в ответ на изменение состава окружающих лигандов, из-за чего этот элемент выступает в роли незаменимого компонента практически для всех живых существ на планете. Железо легко вступает в одноэлектронные окислительно-восстановительные реакции (переход из состояния Fe2+ в Fe3+). Протеины, в состав которых входит железо, являются ключевыми компонентами многих биологических процессов (транспорт кислорода, энергетический обмен, репарация и репликация ДНК, нейтрализация активных форм кислорода и других форм, которые катализируются ферментами, такими как оксигеназа, пероксигеназа и т.д.). Но эти же химические свойства железа могут оказывать на организм негативное влияние. То есть, даже незначительное количество «свободного» железа способно катализировать образование очень токсичных радикалов. Многогранность функций железа определяет его биологическую ценность, что делает этот элемент незаменимым другими металлами в сложных биохимических процессах и активном участии в клеточном дыхании, обеспечивая таким образом полноценную функцию тканей организма.
Все железозависимые и железосодержащие протеины, в зависимости от характера их взаимосвязи с биологическими элементами и с учетом их основных функций, делят на четыре группы, три из которых составляют стабильный пул железа и одна – лабильный пул железа.
Стабильный пул железа
Стабильный пул железа в организме человека условно делят на:
- Клеточное железо
- Неклеточное железо
- Железо запаса
Клеточное железо
Клеточное железо содержится в основном в гемопротеинах, главным компонентом которого является гем. Гемопротеины – самая большая группа ферропротеинов, в которую входят гемсодержащие белки; эта группа включает примерно 2/3 железа, содержащегося в организме. К гемопротеинам относятся: гемоглобин, миоглобин, нейроглобин, циклооксигеназа, цитохромы дыхательной цепи (al, a3, bl, b5, c), цитохром P450, каталаза, пероксидаза (миелопероксидаза, тиреопероксидаза, лактопероксидаза) и др.
Гем – конечный продукт в цепи превращений порфирина в результате включения железа в протопорфириновое кольцо при участии феррохелатазы, чувствительной к влиянию свинца. Угнетение активности феррохелатазы нарушает процесс утилизации железа, в результате чего оно может накапливаться, вступая в связь с другими протеинами и лигандами. Белки содержаться во всех клетках организма, поэтому гем синтезируется во всех клетках, кроме эритроцитов, в которых отсутствуют протеинсинтезирующая система.
Гемоглобин содержится в эритроцитах. Его основная функция – транспорт экзогенного кислорода и эндогенного углекислого газа. Гем представляет собой конечный продукт в цепи превращений порфиринов в результате включений железа в протопорфириновое кольцо при участии феррохелатазы, чувствительной к влиянию свинца. Угнетение активности феррохелатазы нарушает процесс утилизации железа, в результате чего оно может накапливаться, вступая в связь с другими протеинами и лигандами.
Миоглобин – кислородосвязывающий протеин, участвующий в процессе клеточного, который содержится в клетках миокарда и скелетной мускулатуры. Главная функция миоглобина – транспорт кислорода в клетку и регуляция его содержания в миоцитах и кардиоцитах для обеспечения внутриклеточных метаболических процессов, лежащих в основе клеточного дыхания. Молекула миоглобина накапливает кислород и расходует с целью его компенсации в случае дефицита. В норме миоглобин не обнаруживается в крови. При разного рода поражениях мышечной ткани миоглобин из поврежденных клеток попадает в кровь и выводится с мочой.
Гемы представляют собой комплексные соединения порфиринов с 2-валентным железом, несущие 1 или 2 аксиальных лиганда. Железосодержащие ферменты негеминовой группы – следующая форма клеточного железа. Это негеминовое железо, в состав которого ходят железо-серные белки и железофлавопротеиды (негемовые ферменты митохондрий, участвующие в транспорте электронов и содержащие больше железа, чем цитохромы). К этой группе относится НАДН-дегидрогеназа, ксантиноксидаза, сукцинатдегидрогеназа, оксигеназа, липоксигеназа и специализированный железосерный протеин нуклеинового обмена рибонуклеотидредуктаза.
Неклеточное железо
Неклеточное железо представлено трансферрином и лактоферрином, которые содержатся во внеклеточном пространстве и транспортируют ионы железа. Трансферрин – белок β-глобулиновой фракции плазмы крови, синтезируемый преимущественно клетками печени и лимфоидной ткани. Ежесуточно в организме здорового человека синтезируется около 12-14 г белка на 1 кг массы тела, что соответствует 5-9% от общего количества трансферрина. Лактоферрин – белок семейства трансферринов, способный транспортировать ионы 3-валентного железа.
Во внеклеточном пространстве железо находится в виде железобелковых комплексов (то есть, связано с протеинами). Концентрация железа в крови у здорового человека имеет широкий диапазон референсных значений (от 10,8 до 28,8 мкмоль/л) с довольно большими суточными колебаниями, которые могут достигать 7,2 мкмоль/л. Содержание железа в крови зависит от нескольких основных факторов: взаимоотношение процессов эритропоэза и гемолиза, а также от поступления железа в организм через желудочно-кишечный тракт. Тем не менее, главный фактор, определяющий концентрацию железа в плазме – взаимодействие эритропоэза и гемолиза.
Трансферрин – железосвязывающий белок. Общая железосвязывающая способность крови практически полностью зависит от уровня трансферрина, и варьируется у здоровых лиц в пределах 44,7-71,6 мкмоль/л, а свободная железосвязывающая способность крови, характеризуется резервной емкостью трасферрина, колеблется от 28,8 до 50,4 мкмоль/л.
Большая часть трансферрина синтезируется в гепатоцитах (паренхиматозных клетках печени). В организме человека трансферрин выполняет функции, которым уделяют особое внимание. Этот белок не только транспортирует железо в разные ткани, но и идентифицирует ретикулоциты, из которых образуется гемоглобин и, вероятно, другие клетки, нуждающиеся в железе. Эти клетки получают железо от трансферрина только при условии наличия специальных рецепторов на этих клетках (эти рецепторы связывают железо). Трансферрин также выполняет защитную функцию – предотвращает токсическое влияние железа на ткани. Одна молекула трансферрина способна связывать 2 иона 3-валентного железа, а 1 грамм трансферрина способен связать примерно 1,25 мг железа (таким образом можно вычислить общее количество железа, способного вступить в связь с трансферрином). Этот показатель позволяет дать приблизительную оценку общей железосвязывающей способности крови.
В диагностике железодефицитных состояний используется расчетная величина – процент насыщения трансферрина железом (отношение уровня железа в крови к максимальной железосвязывающей способности трансферрина крови, которое выражается в процентах). В организме здорового человека процент насыщения трансферрина железом составляет примерно 30%; в случае недостаточного поступления железа в организм этот показатель снижается.
Анализ на содержание трансферрина в крови принято использовать при дифференциальной диагностике железодефицитной анемии (ЖДА). Железодефицитная анемия характеризуется снижением уровня железа в крови, повышением концентрации трансферрина и, как следствие, снижением процента насыщения трансферрина Fe. Отметим, что у женщин уровень трансферрина в крови выше на 10%, чем у мужчин. У беременных в III триместре уровень трансферрина в крови может повышаться на 50%. У лиц пожилого возраста концентрация трансферрина в крови снижается. При воспалительных процессах в организме трансферрин проявляется в качестве белка острой фазы – при острофазном воспалительном ответе его уровень в крови снижается).
Лактоферрин – полифункциональный железосвязывающий протеин из семейства трансферринов, который присутствует во многих жидкостях организма человека (панкреатическом соке, секрете тонкого кишечника, слезах, грудном молоке, желчи, синовиальной жидкости), а также в специфических вторичных гранулах нейтрофильных лейкоцитов (образуясь в клетках миелоидного ряды со стадии промиелоцита). Лактоферрин, как и трансферрин, способен связывать два атома железа (белок состоит из одной полипептидной цепочки, приблизительная молекулярная масса – 80 000). В нормальном (здоровом) состоянии организма лактоферрин способен насыщаться железом примерно на 20%. В кровь лактоферрин попадает из нейтрофильных лейкоцитов (его концентрация в крови очень низкая). Несмотря на сходство лактоферрина с трансферрином, эти протеины отличают антигенные свойства, состав углеводов, белков и аминокислот.
Железо запаса
Железо запаса представляет собой соединения в виде ферритина и гемосидерина, которые содержатся преимущественно в печени, селезенке и мышечной ткани. Железа запаса задействуется организмом в случае возникновения дефицита в клетках. Помимо крови, самое большое количество Fe содержится в следующих органах:
- Селезенка: 336 мкг/г
- Легкие: 319 мкг/г
- Печень: 195 мкг/г (7,8% в виде ферритина и гемосидерина)
- Мышцы: до 27,9%; в виде миоглобина – 21,9%, в виде ферритина – 6,91%)
Ферритин и гемосидерин – основные соединения, содержащие запасы железа в клетке, большая часть которых находится в ретикулоэндотелиальной системе (тканевых макрофагах) печени, селезенки и костного мозга. Примерно 1/3 резервного железа в организме человека, преимущественно в виде ферритина, содержится в печени. Примерно 80% железа, содержащегося в печени связано ферритином или гемосидерином, около 5% находится в комплексе с трансферрином, 2% – с гемом, а остальная часть железа остается в лабильном пуле железа.
Резервы железа могут мобилизоваться по мере необходимости с целью компенсации потребностей организма, а также для предупреждения токсического влияния свободно циркулирующего железа.
Ферритин – гидрофильная молекула, структура которой состоит из 24 субъединиц, формирующих полую сферу, внутри которой может содержаться до 4500 атомов железа. Синтез ферритина индуцируется при высоком уровне внутриклеточного железа и ингибируется при дефиците железа. Такая регуляция опосредована системой IRE (железоответственного элемента) – IRP (железорегуляторным белком). Кроме этого, синтез ферритина регулируется цитокинами: интерферон-γ, интерлейкин-1, -6 (ИЛ-1 и ИЛ-6).
Процесс высвобождения железа происходит при деградации ферритина, что помогает мобилизовать железо для потребности клеток. В процессе деградации ферритина участвуют лизосомный и протеосомный аппараты клетки.
Гемосидерин – пигмент, представляющий собой молекулу, нерастворимый в воде, который содержится в лизосомах. Содержащееся в соединении с гемосидерином железо менее эффективно в продукции свободных радикалов и менее доступно, чем железо в соединении с ферритином.
Лабильный пул железа
Лабильный пул железа содержит примерно 80-90 мг Fe, которое находится в интерстициальном пространстве (межклеточных промежутках), куда оно попадает из крови. В интерстициальном пространстве железо может связываться с клеточной мембраной, а также возвращаться обратно в кровь. Существование железа лабильного пула было экспериментально установлено в исследованиях с радиоактивными изотопами Fe. Ученые предполагают, что лабильный пул сосредоточен в лимфатической система, а также депонируется в клеточной цитоплазме вне комплекса с ферритином (таблица 1).
Тип железа | Концентрация железа (мг/кг) | |
Мужчины | Женщины | |
Функциональное железо | ||
Гемоглобин | 28 | 31 |
Миоглобин | 4 | 5 |
Гемовые ферменты | 1 | 1 |
Негемовые ферменты | 1 | 1 |
Транспортное железо | ||
Трансферрин | < 1 (0,2) | < 1 (0,2) |
Железо запаса | ||
Феррин | 4 | 8 |
Гемосидерин | 2 | 4 |
Общее количество | 40 | 50 |
ПРОДОЛЖЕНИЕ ЗДЕСЬ:
Эритропоэз: Гемоглобин и Эритроциты. Часть 3
Эритропоэз: Гемоглобин и Эритроциты. Часть 4
