Синтез эритроцитов и гемоглобина
Гемоглобин синтезируется в клетках костного мозга. Все необходимые для синтеза гемоглобина составные части поступают с током крови.
Белковая часть молекулы синтезируется как и все простые белки из аминокислот матричным способом.
Синтез гема протекает в несколько стадий под влиянием различных ферментов:
1. Вначале происходит образование дельта-аминолевулиновой кислоты. Это реакция протекает в результате конденсации сукцинил-КоА и глицина в митохондриях под действием фермента аминолевулинатсинтетазы.
2.Следующая реакция протекает в цитоплазме. Происходит образование порфобилиногена в результате реакции конденсации двух молекул дельта-аминолевулиновых кислот.
3.Затем, в результате многоступенчатых реакций из четырех монопиррольных молекул порфобилиногена образуется протопорфирин 1Х, являющийся непосредственным предшественником гема.
4. Протопорфирин IX присоединяет молекулу железа (реакция осуществляется под влиянием фермента гемсинтетазы или феррохелатазы) и образуется гем, который затем используется для биосинтеза всех гемопротеидов. Оба фермента, участвующие в синтезе ПБГ, регулируемые, они ингибируются гемом и НЬ. Поэтому гем не образуется в избытке или недостатке. Также строго в определенном количестве образуется и белковая часть Нb, т. к. ее синтез может происходить только в присутствии тема, и образующиеся полипептидные цепи тут же соединяются с гемом. При низкой концентрации гема, когда нарушается его синтез, образование гемоглобина также замедляется.
Каждая из образовавшихся полипетидных цепей глобина присоединяются кодному гему, образуя моном ер гемоглобиан. 4 таких мномера, объединивщись, образуют гемоглобин.
Основной функцией гемоглобина является перенос кислорода из легких к тканям и перенос углекислого газа от тканей к легким, участие в поддержке рН крови. Свои функции гемоглобин выполняет только в составе эритроцита. Продолжительность жизни эритроцита 110-120 дней. Затем эритроцит подвергается гемолизу
3. Распад гемоглобина. Превращение билирубина в желудочно- кишечном тракте. Свободный и связанный билирубин. Свойства.
При гемолизе эритроцитов гемоглобин попадает в кровь и соединяется с белком гаптоглобином, в виде комплекса гемоглобин-гаптоглобин (Нр-Нb) транспортируется в клетки макрофагально-моноцитарной системы (ММС): это Купферовы клетки печени, клетки лимфоузлов, селезенки, пейеровых бляшек в кишечнике.
Процесс начинается с окислительного расщепления метинового мостикамежду первым и вторым пиррольными кольцами и образуется вердоглобин. Затем от вердоглобина отщепляется глобин, железо и образуется биливердин (зеленого цвета), вещество линейной структуры. Железо соединяется с b-глобулинами и в виде трансферина доставляется в печень и селезенку, где депонируется в виде ферритина. Глобин распадается так же как и все простые белки до аминокислот.
Биливердин восстанавливается за счет НАДФН2 в неконьюгированный,
свободный билирубин, который не растворим в воде и является токсичным соединением. Свободный билирубин выходит из клеток ММС, соединяется с
альбуминами и поступает в гепатоциты. В крови он называется непрямым потому, что дает реакцию с реактивом Эрлиха не сразу, а после добавления в сыворотку крови кофеинового реактива или спирта для осаждения белка.
В Купферовых клетках печени распад гемоглобина также начинается с
образования вердоглобина, затем биливердина. В печени непрямой билирубин обезвреживается в гепатоцитах путем реакции конъюгации, соединяясь с одной или двумя молекулами глюкуроновой кислоты, образуя моно- или диглюкуронид билирубина. Такой билирубин называется конъюгированным и
связанным и прямым. Этот билирубин хорошо растовряется в воде, не обладает токсическими свойствами. Биливердин и прямой билирубин собираются в желчном пузыре, придавая желчи оливковый цвет и потому их относят к пигментам желчи. Желчь поступает в тонкий кишечник, но в желчном протоке прямой билирубин, теряя глюкуроновые кислоты, снова превращается в непрямой. Биливердин проходит через весь кишечник не изменяя своей химической структуры и удаляется с калом, окрашивая его в зеленоватый цвет, т.е. он является пигментом кала. А непрямой билирубин в кишечнике восстанавливается до мезобилиногена (уробилиногена), часть которого всасывается в воротную вену и возвращается в печень, где распадается до бесцветных моно- и дипирролов. Последние выводятся через почки вместе с мочой.
Большая часть мезобилиногена поступает в толстый кишечник, где под
влиянием ферментов микроорганизмов восстанавливается в стеркобилиноген. Часть стеркобилиногена, всасываясь в кровь через геморроидальные вены, попадает в почки. В моче под действием света и воздуха происходит окисление стеркобилиногена до стеркобилина, который придает моче желтый цвет, т.е. является пигментом мочи. Остальная часть стеркобилиногена окисляется в толстом кишечнике на свету до стеркобилина и вместе с биливердином является пигментом кала, придавая ему коричнево-зеленый цвет.
У грудных детей в кишечнике нет гнилостных бактерий, поэтому
билирубин не превращается в стеркобилиноген и выводится как таковой. Соответственно цвет кала у детей обусловлен биливердином и билирубином (желто-зеленый).
У детей в первые три месяца эмбрионального периода образуется эмбриональный гемоглобин. Затем он преобразуется в фетальный (гемоглобин F), который доминирует вплоть до рождения ребенка. После рождения в течение первого месяца жизни фетальный гемоглобин постепенно заменяется на гемоглобин взрослого (гемоглобин А), отличающегося составом полипептидных цепей. Эмбриональный и фетальный гемоглобин обладают более высоким сродством к кислороду по сравнению с гемоглобином взрослого.
Пигменты желчи, кала и мочи.
При распаде гемоглобина образуются пигменты желчи, кала и мочи.
Пигменты желчи: биливердин (зеленого цвета), связанный билирубин (глюкурониды билирубина –желтого цвета). Цвет желчи зависит от соотношения этих пигментов.
Пигменты кала: биливердин (зеленого цвета), стеркобилин (коричневого цвета)
Пигмент мочи: стеркобилин
Цвет сыворотки крови тоже зависит в определенной степени от наличия в ней билирубина. В норме количество общего билирубина в крови равно 8—20 мкмоль/л, на долю непрямого билирубина приходится 75- 100%, а прямого от 0 до 25%. Количество прямого билирубина незначительно. Прямой билирубин проходит через пачечную ткань, и появляется в моче, непрямой билирубин в моче появиться не может, вследствие его нерастворимости в воде.
Источник
Цифры напротив символа Hb, или гемоглобина, в бланке с результатами общего анализа крови могут раскрыть врачу причины низкого давления, головокружения, судорог ног пациента, а также оповестить о надвигающихся серьезных угрозах. Своевременное выявление отклонений и приведение концентрации гемоглобина в норму позволит избежать серьезных проблем со здоровьем. Речь идет о снижении рисков инфарктов и инсультов у людей в возрасте, патологий развития детей, ухудшения состояния матери и плода во время беременности.
Что такое гемоглобин и каковы его функции
Гемоглобин (Hb) — сложный железосодержащий белок, содержащийся в эритроцитах (красных кровяных тельцах) крови и частично присутствующий в свободном виде в плазме. Именно он осуществляет перенос кислорода от легких к клеткам и углекислого газа — в обратном направлении. Если говорить образно, то эритроцит — это своеобразное грузовое судно, курсирующее по кровяному руслу, а молекулы гемоглобина — контейнеры, в которых транспортируется кислород и углекислый газ. В норме один эритроцит вмещает порядка 400 млн молекул гемоглобина.
Участие в газообмене — важнейшая, но не единственная функция «кровяных шаров» (от греч. haima — «кровь» + лат. globus — «шар»). Благодаря своим уникальным химическим свойствам гемоглобин является ключевым элементом буферной системы крови, поддерживающим кислотно-щелочной баланс в организме. Hb связывает и выводит на клеточном уровне кислые соединения (препятствует ацидозу — закислению тканей и крови). А в легких, куда он поступает в форме карбгемоглобина (HbCO2), за счет синтеза углекислоты предотвращает противоположный процесс — защелачивание крови, или алкалоз[1].
Производная Hb — метгемоглобин (HbOH) — обладает еще одним полезным свойством: прочно связывать синильную кислоту и другие токсичные вещества. Таким образом, железосодержащий белок принимает удар на себя и снижает степень отравления организма[2].
Итак, гемоглобин крайне важный элемент жизнедеятельности и патологическое уменьшение его концентрации (анемия или малокровие) может спровоцировать в лучшем случае ломкость ногтей и волос, сухость и шелушение кожи, мышечные судороги, тошноту и рвоту, головокружение. Острая же форма анемии вызывает кислородное голодание клеток, приводящее к обморокам, галлюцинациям и фатальным последствиям — гипоксии мозга, атрофии нервных клеток, параличу дыхательной системы.
Как должно быть в норме
Уровень гемоглобина в нашей крови может несколько увеличиваться и уменьшаться по естественным причинам. Обновление гемоглобина связано с жизненным циклом эритроцита, к которому он прикреплен. Так, примерно каждые 120 дней часть молекул гемоглобина вместе с эритроцитами отправляется в печень — на расщепление и после вновь синтезируется, присоединяясь к свободному эритроциту[3].
Количество гемоглобина зависит от возраста и пола, меняется в процессе вынашивания и рождения ребенка[4].
На гемоглобин также оказывают влияние специфические условия труда или проживания (например, повышенные показатели бывают у пилотов и жителей гористой местности), приверженность вегетарианству и донорство (эти факторы, напротив, снижают гемоглобин)[5].
Согласно рекомендациям ВОЗ[6], нормой гемоглобина считается:
- для детей от полугода до 5 лет — 110 г/л и выше;
- для детей 5–11 лет — 115 г/л и больше;
- для детей 12–14 лет, а также девушек и женщин (15 лет и старше) — 120 г/л и выше;
- для мужчин (15 лет и старше) — 130–160 г/л.
Беременным женщинам, обеспечивающим минералами (в том числе железом) себя и малыша, важно следить, чтобы уровень гемоглобина не падал ниже 110 г/л. Отметим, что, по данным ВОЗ, железодефицитная анемия (ЖДА) диагностируется у 38,2% беременных на планете[7]. Дефицит молекул гемоглобина может возникнуть после 20-й недели «интересного положения»: из-за увеличения объема циркулирующей крови, растущих потребностей плода, уменьшения поступления и всасывания железа вследствие токсикоза и расстройств ЖКТ. В это время женщину может мучить слабость, головокружение, одышка даже при непродолжительной ходьбе, судороги нижних конечностей. Опасное следствие острых форм ЖДА — преждевременные роды, задержки в развитии плода.
Кстати, необычные вкусовые запросы беременных (вплоть до анекдотичных, таких как салат из жареной клубники и селедки) порой тоже связаны с потребностью в железе для синтеза гемоглобина. Роды, сопровождающиеся потерей крови, ведут к дополнительному понижению гемоглобина. В целом от зачатия до появления ребенка на свет организм женщины утрачивает порядка 700 мг железа, еще 200 мг — за период лактации[8]. На восстановление запасов требуется не менее трех лет.
Виды анализов на гемоглобин
Подсчет числа молекул гемоглобина производится при общем анализе крови. Помимо количества белка (строка Hb), в бланке анализа могут указать MCH/MCHC, что соответствует среднему содержанию/концентрации гемоглобина в эритроците. Это уточнение позволяет подсчитать полезный железопротеин и исключить из расчета аномальные, нестабильные формы гемоглобина, не способные переносить кислород.
Для измерения гемоглобина во внелабораторных условиях — в машинах скорой помощи или при проведении профилактических выездных осмотров — применяются специальные гемоглобинометры. Это портативные приборы, в которые помещается кровь с реагентом для фотометрического автоматического определения количества гемоглобина.
Для массового тестирования на анемию в странах третьего мира ВОЗ разработала малозатратный колорометрический метод исследования. При колориметрии каплю крови наносят на специальную хроматографическую бумагу и сопоставляют ее со шкалой цветов, соответствующих разным показателям гемоглобина с шагом 20 г/л[9].
Уровень гликированного гемоглобина определяется и при биохимическом анализе венозной крови. Цель исследования в данном случае — определение глюкозы в крови, которая образует прочное соединение с гемоглобином и лишает его возможности транспортировать кислород. Показатель важен для диагностики сахарного диабета и оценки эффективности его лечения.
Чем опасен повышенный гемоглобин в крови
Высокий гемоглобин может быть вызван объективной нехваткой кислорода, стимулирующей организм на увеличенное производство этого белка крови. Подобная патология часто фиксируется у экипажей воздушных судов и часто летающих пассажиров, жителей высокогорья, альпинистов, горнолыжников. В силу большей потребности в кислороде повышенный уровень гемоглобина свойственен профессиональным спортсменам, преимущественно лыжникам, легкоатлетам, борцам, тяжелоатлетам. Это физиологический механизм компенсации, не вызывающий никаких медицинских опасений (кавказское долголетие — яркий тому пример).
Повысить гемоглобин может и пагубная привычка: во время курения человек вдыхает меньше кислорода, чем требуется, и организм реагирует на это выработкой дополнительного гемоглобина.
К сожалению, повышенный гемоглобин может указывать и на патологии системы кроветворения: эритроцитоз, рак крови, обезвоживание организма, порок сердца и легочно-сердечную недостаточность, а также на непроходимость кишечника[10].
Увеличенное количество гликированного гемоглобина отмечается при сахарном диабете: часть молекул Hb «перетягивает» на себя глюкозу, и для нормального дыхания требуются добавочные кислородные «контейнеры»[11].
Повышенный свободный гемоглобин в плазме фиксируется и при ожоговых поражениях вследствие разрушения эритроцитов с высвобождением из них гемоглобина[12].
Опасность высокого гемоглобина (+20 г/л от нормы и более) заключается в сгущении и увеличении вязкости крови, приводящему к образованию тромбов. Тромбы, в свою очередь, могут вызвать инсульт, инфаркт, кровотечение в ЖКТ или венозный тромбоз[13].
Гемоглобин ниже нормы: что это значит и к чему приводит
Железо — один из самых распространенных и легко добываемых химических элементов на Земле. При этом, как ни парадоксально, от дефицита железа в организме страдает больше людей, чем от какого-либо другого нарушения здоровья[14]. В группе риска население из низких социальных слоев, не получающее достаточного количества железа из продуктов питания, женщины репродуктивного возраста и дети, то есть люди, у которых «приход» элемента меньше «расхода».
Причиной низкого уровня гемоглобина (минус 20 г/л от нормы и более) зачастую являются скудное или несбалансированное питание — недостаточное поступление железа и меди, витаминов A, С и группы B или употребление железосодержащей пищи совместно с цинком, магнием, хромом или кальцием, которые не позволяют Fe усваиваться[15].
Низкие показатели могут наблюдаться у вегетарианцев, т.к. негемовое железо из растительной пищи усваивается намного хуже, чем гемовое, источником которого служат продукты животного происхождения[16].
Смежная причина — наличие кишечных паразитов, которые перехватывают поступающие микроэлементы и витамины. Усвоению железа могут также мешать проблемы с желудочно-кишечным трактом.
Заметное снижение уровня гемоглобина сопровождает кровопотери, вызванные ранениями, оперативным вмешательством, менструацией, кровотечениями, возникающими во время родов и абортов, а также при донации крови и ее компонентов.
На уровень гемоглобина влияют и скрытые кровопотери при патологии ЖКТ (язвы желудка и ДКП), варикозе, миомах и кистах органов женской половой системы, кровоточивость десен.
Причины снижения гемоглобина, возникающие во время беременности и лактации, а также осложнения, к которым они могут привести, мы рассмотрели выше. Длительный железодефицит у мужчин, детей и небеременных женщин имеют сходную симптоматику: ухудшение состояния кожи, ногтей и волос, головокружение, обмороки, онемение рук и ног, беспричинная слабость.
Кислородное голодание вследствие недостатка гемоглобина может привести к ухудшению памяти, замедлению нервных реакций, в запущенной форме — к атрофии клеток мозга и других органов и систем организма.
Усиленное кровообращение (более частый прогон гемоглобина от легких к тканям и обратно) чревато проблемами с сердцем и сосудами: кардиомиопатией и развитием сердечной недостаточности.
Низкий гемоглобин негативно отражается на буферной функции: это значит, что закисление крови подрывает иммунную защиту организма, снижает сопротивляемость простудным и инфекционным заболеваниям.
Наиболее уязвимы перед анемией дети и подростки. Острый дефицит жизненно важного минерала может сказаться на их умственном и физическом развитии[17].
Гемоглобин — незаменимый участник жизнедеятельности, на который возложены важнейшие функции: перенос кислорода и углекислого газа, сохранение кислотно-щелочного баланса, противостояние ядам. Еще одна функция — сигнальная — помогает по отклонению уровня гемоглобина от нормы выявить риски развития патологий и принять контрмеры. Таким образом, контроль и оперативная коррекция уровня гемоглобина — не прихоть врачей, а действенный способ сохранить здоровье.
Источник
Медицина / Физиология / Физиология (статья)
Эритропоэз: Гемоглобин и Эритроциты. Часть 4
Статья |
14-10-2018, 19:24
|
 ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ:
ЭритроцитПРОДОЛЖЕНИЕ. НАЧАЛО ЗДЕСЬ:
Эритропоэз: Гемоглобин и Эритроциты. Часть 1
Эритропоэз: Гемоглобин и Эритроциты. Часть 2
Эритропоэз: Гемоглобин и Эритроциты. Часть 3
Организм человека содержит примерно 4 г железа. В норме 1-2 мг железа в сутки усваивается из пищи энтероцитами двенадцатиперстной кишки. Абсорбированное энтероцитами железо поступает в кровь по мере необходимости. Попадая в кровь железо связывается с трансферрином. Если организм не нуждается в поступлении железа, оно остается в энтероцитах и затем выводится из кишечника в составе сгущавшегося эпителия. Около 3 мг железа циркулирует в крови в комплексе с трансферрином – это железа поступает в клетки посредством TfR1-зависимого рецептор-индуцируемого эндоцитоза. В нормальном состоянии большая часть железа в плазме крови находится в комплексе с трансферрином.
Большинство клеток получают железо из этого комплекса путем рецептор-индуцируемого эндоцитоза (рецепторы TfR1 и TfR2). Трансферрин – гликопротеид, содержащийся в плазме крови в большом количестве, который обладает высокой аффинностью при связывании двух молекул 3-валентного железа. Холотрансферрин (Holotransferrin TF – трансферрин, связанный с двумя молекулами железа) при внеклеточном pH близкому к показателю 7,4 способен быстро вступать в связь с TfR1. Эндоцитоз происходит в окаймленных ямках – специальные структурные образования на плазматической мембране. Такая инвагация окаймленной ямки внутрь клетки формирует окаймленный пузырек, который быстро преобразуется в эндоцитозный пузырек. Кислая среда способна вызывать изменения как в трансферрине, так и в молекуле TfR1, в результате чего происходит диссациация 3-валентного железа от комплекса. При этом трансферрин охраняет связь с рецептором. Затем редуктаза Steap3 восстанавливает Fe3+ до Fe2+, которое переносится из эндосомы в цитоплазму с помощью протеина DMT-1. TfR1 в комплексе с апотрансферрином возвращается на плазматическую мембрану, где может вступать в новый цикл эндоцитоза.
Основная часть этого железа предназначается для развития эритроцитов костного мозга, где его потребление составляет в среднем 22 мг/сут, а также для образования гемоглобина. Примерно 65-70% железа организма содержится в эритроцитах крови. Старые и поврежденные эритроциты удаляются из циркулирующей крови макрофагами ретикулоэндотелиальной системы, где Fe высвобождается из гемоглобина и экспортируется в плазму крови или депонируется в комплексе с ферритином. Частично железо поступает из старых эритроцитов (после фагоцитоза эритроцитов макрофагами Fe попадает в фагосомы, откуда рециркулируется обратно в кровь). Железо присутствует в цитоплазме макрофагов при участии ферропортина и поддержке феррооксидазной активности церулоплазмина и гемовой оксидазы. Также макрофаги располагают белками-транспортерами – DMT-1, IMP (integrin-mobilferrin protein, интегрин-мобилферриновый протеин), HFE (белки-регуляторы) и другие железо-регуляторные протеины. Данный процесс можно структурировать следующим образом:
1. В макрофагах железо высвобождается из порфиринового кольца с помощью гемовой оксидазы.
2. Железо входит в фагосомы макрофагов (в этом процессе задействуются ферропортин и церулоплазмин, обладающий восстановительной способностью).
3. В эндосомах железо вступает в связь с DMT-1 и IMP (белками-транспортерами).
4. Железо передается на апотрансферрин, потом в эритроцитах феррохелатаза «вставляет» 2-валентное железо в протопорфин IX для построения гема. В результате железо, содержащееся в старых эритроцитах, путем ряда последовательных соединений с соответствующими протеинами возвращается в циркулирующую кровь, где вступает в соединение с трансферрином.
Помимо поступления железа из желудочно-кишечного тракта и его высвобождения из погибающих эритроцитов также существует альтернативный путь транспорта железа. 3-валентное железо соединяется с муцином, который передает его на интегрин, затем, после перемещения железа в энтероцит, оно вступает в связь с мобилферритином. В плазму крови из клеток ретикулоэндотелиальной системы высвобождается примерно 22 мг железа в сутки, таким образом компенсируя потребности костного мозга. Другие клетки организма получают железо из плазмы крови в небольшом количестве для синтеза железосодержащих протеинов (например, гемсодержащие цитохромы и содержащие железосерный кластер протеины). В этих протеинах содержится около 10-15% железа организма. Остальные 20% храниться в депо (в основном в макрофагах и гепатоцитах). Организм теряет железо при слущивании ороговевших клеток на коже и слизистых оболочках, а также в результате кровопотери.
Системные регуляторы метаболизма железа
Процесс транспорта железа строго контролируется и регулируется в соответствии с потребностями организма. Необходимый уровень внутриклеточного железа поддерживается отдельными клетками, которые способны менять активность соответствующих протеинов на разных уровнях. Кроме этой «внутренней» регуляции клеточный транспорт железа могут контролировать внешние системные регуляторы (макрофаги ретикулоэндотелиальной системы, энтероциты кишечника, гепатоциты). Несмотря на то, что открытие новых регуляторов обмена железа выявило сложность системы поддержки гомеостаза железа, это помогло значительно продвинуться в изучении общего принципа функционирования этой системы.
Гепцидин
Открытие регуляторного белка гепцидина стало ключевым моментом в понимании принципов регуляции системного гомеостаза железа. Этот протеин состоит из 25 аминокислот, имеет особую волосоподобную структуру и содержит 4 цистиновых мостика. Гепцидин обладает противомикробными свойствами.
Исследователи во главе с Парком (Park) в 2001 году изучали антимикробные свойства разных биологических жидкостей организма человека. В ходе этой работы ученые выделили из мочи новый пептид, который получил название гепцидин (hepcidin). Название нового компонента – комбинация двух слов: hepar («печень» – место синтеза пептида) и cidin («уничтожать» – этот термин подчеркивает антимикробные свойства этого вещества). Последующие исследования показали, что образование гепцидина происходит не только в печени, но и в тубулярной системе почек. Так, ученые во главе с Краузом (Krause) провели независимое от Парка исследование, результатом которого стало выделение похожего пептида из ультрафильтрата плазмы крови, получившего название LEAP1 (liver expressed antimicrobial peptide). Была показана последовательность зрелого протеина, состоящего из 25 аминокислот в отдельном буквенном шифре.
Влияние гепцидина на обмен железа впервые обнаружил ученый Pigeon с группой исследователей при изучении реакций печени на перегрузку железом. Исследования показали, что при стимуляции образования матричной РНК гепцидина происходит не только при парентеральной или алиментарной перегрузке железом, но и при введении мышам липополисахарида. На основании полученных данных специалисты предположили, что процесс синтеза гепцидина взаимосвязан с метаболизмом железа и иммунными реакциями.
Более поздние исследования продемонстрировали ключевую роль гепцидина в регуляции процесса усвоения железа в кишечнике и рециркуляции железа из клеток моноцитарно-макрофаговой системы. Исследования, возглавляемые Николасом (G. Nicolas), показали, что у мышей с изъятым геном USF2 (отвечает за образование гепцидина) развивался гемохроматоз. На основании этих данных специалисты заключили, что гепцидин оказывает негативное влияние на процесс усвоения железа в желудочно-кишечном тракте и ингибирует процессы рециркуляции железа из макрофагов.
Флеминг (R.E. Fleming) и Слай (W.S. Sly) предположили, что чрезмерная продукция гепцидина, которая наблюдается при воспалительных и инфекционных процессах, может играть ключевую роль в развитии анемии при хронических заболеваниях. Так, трансгенные мыши, в организме которых вырабатывалось чрезмерное количество гепцидина, умирали от тяжелого дефицита железа. Таким образом авторы сделали вывод, что гепцидин представляет собой отрицательный регулятор трансплацентарного переноса железа к плоду.
Группа специалистов во главе с Вейнштейном (Weinstein) продемонстрировали двух пациентов с большими аденомами печени и сопутствующей микроцитарной рефрактерной к железу анемией. После проведения полной резекции опухоли у обоих пациентов уровень гемоглобина в крови быстро восстановился. Таким образом было установлено, что одной из причин развития анемии является избыточная продукция гепцидина опухолевой тканью.
Гепцидин синтезируется в клетках печени (гепатоцитах) и выделяется в плазму крови, где препятствует экспорту железа из разных типов клеток в кровь. Синтез гепцидина снижается в ответ на соответствующие стимулы, повышающие экспорт железа из клеток (дефицит железа, высокий уровень эритропоэза), и увеличивается при состояниях, требующих снижение экспорта железа в системное русло (воспалительный процесс, переизбыток железа в крови).
На поверхности клеточной мембраны гепцидин способен непосредственно взаимодействовать с ферропортином и индуцировать его проникновение в цитоплазму с последующей деградацией, тем самым снижая скорость экспорта железа из клетки. На сегодняшний день ученые выяснили 4 регуляторных пути, контролирующих синтез гепцидина:
- Регуляция в ответ на изменение общего уровня железа
- Регуляция в ответ на изменение интенсивности эритропоэза
- Регуляция в ответ на воспаление
- «Обязательный» сигнальный путь (mandatory signaling pathway)
В качестве индикатора общего уровня железа в организме принято считать степень насыщения трансферрина железом в крови. Путь передачи этого сигнала на гепцидин полностью не изучен, однако новые исследования по изучению взаимодействия трансферрина и HFE c TfR1 и TfR2 привели к гипотетической модели, которая демонстрирует, как циркулирующее железо, связанное с трансферрином, оказывает влияние на формирование комплекса HFE с TfR2 на поверхности гепатоцитов. Этот комплекс способен повышать продукцию гепцидина посредством пока не изученного внутриклеточного сигнального пути.
Рецептор трансферрина второго типа стабилизируется холотрансферрином, в результате чего повышается количество TfR2 на клеточной мембране при повышении уровня этой формы протеина. Трансферрин и HFE связываются с рецептором трансферрина первого типа на частично перекрывающихся участках и конкурируют за связывание. Повышение уровня холотрансферрина приводит к вытеснению HFE из комплекса с трансферрином и, как следствие, к перемещению HFE из эндосом, содержащих TfR1, на плазматическую мембрану. При высвобождении TfR1 из комплекса с HFE происходит усиление транспорта железа в клетку. HFE, вытесненный из комплекса с TfR1, вступает в связь с рецептором трансферрина 2-го типа, формируя комплекс, который предположительно передает сигнал на гепцидин.
При гипоксии или анемии низкое парциальное давление кислорода индуцирует стабилизацию фатора гипоксии HIF-1a, что приводит к продукции эритропоэтина в почках. Эритропоэтин повышает интенсивность эритропоэза и потребность железа в костном мозге. Таким образом начинается мобилизация железа из депо и повышение уровня абсорбции энтероцитами посредством понижения уровня гепцидина, несмотря на уровень содержания железа в крови.
Регуляция в ответ на изменение интенсивности эритропоэза осуществляется посредством фактора, отвечающего за передачу сигналов из костного мозга в гепатоциты на гепцидин. Ранее считалось, что за это отвечает растворимая форма рецептора трансферрина первого типа и GDF-15 (Growth Differentiation Factor 15). Но в 2013 году ученые открыли эритроферрон – молекулу, участвующая в регуляции синтеза гепцидина. Ученые установили, что эритроферрон образуется в эритрокариоцитах костного мозга.
Регуляция синтеза гепцидина проходит по принципу обратной связи: чем активнее эритропоэз и больше эритроидных клеток в костном мозге, тем больше синтезируется эритроферрона, при этом ингибируется образование гепцидина. Таким образом обеспечивается высокая доступность железа, необходимого для образования эритроцитов. И наоборот, низкое содержание эритроидных клеток-предшественников обеспечивает низкий уровень эритроферрона, в результате чего повышается секреция гепцидина и, как следствие, доступность железа для эритропоэза снижается.
Третий путь регуляции экспрессии гепцидина контролируется воспалительным процессом. этот путь индуцируется преимущественно интерлейкином-6. При этом активируется Jak/Stat – путь передачи сигнала в ядро и происходит регуляция экспрессии гена гепцидина. Исследования показали, что регуляция уровня гепцидина при изменении общего уровня железа и интенсивности эритропоэза зависит от активности дополнительного пути, который контролирует протеин гемоювелин (HJV). Ученые предполагают, что гемоювелин поддерживает передачу сигнала посредством BMP/Smad – пути сигнальной трансдукции. Мутация гемоювелина приводит к нарушению обоих путей сигнализации. При исследовании промоторной области гена гепцидина были обнаружены области связи разных транскрипционных факторов (C/EBPa, p53, USF, HNF4a), роль которых в процессе регуляции экспрессии гепцидина до сих пор полностью не изучена.
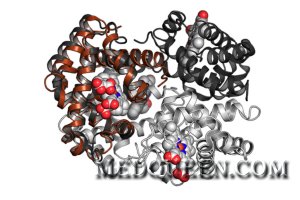
Структура гемоглобина
Гемоглобин состоит из железосодержащего гема и белка глобина. Каждая цепь глобина имеет включение молекулы гема, содержащей атом железа, который связывает кислород. Транспортировать кислород может только 2-валентное железо. У взрослого человека большее количество гемоглобина содержит две цепи: α-глобин (содержит 141 аминокислот) и β-глобин (содержит 146 аминокислот). Эти цепи кодируются генами α-глобиновых кластеров и генами β-глобиновых кластеров, которые находятся в разных хромосомах. Ген α-глобина человека локализуется в 16-й хромосоме (позиция p13.3-pter); ген β-глобина – в 11-й хромосоме (позиция p15.5). Гены, отвечающие за кодирование γ-, β- и ε-цепи, локализуются в 11-й хромосоме. Последовательная экспрессия разных генов глобина при онтогенезе вызывает смену преобладающего типа гемоглобина. Так, у новорожденных преобладает синтез γ-цепей, а не β- (γ-цепи, объединяясь с α-цепями, образуют фетальный гемоглобин – гемоглобин F).
Среди белков эритроцитов примерно 95% приходится на гемоглобин. Молекула гемоглобина представляет собой тетрамер, состоящий из двух гомологичных димеров. У здоровых лиц гемоглобин содержит три компонента. Из всего количество гемоглобина в организме примерно 90% приходится на долю гемоглобина A1, 2,5% составляет гемоглобин A2 и 7,5% – гемоглобин A3. Конфигурация молекулы гемоглобина и отдельных его цепей может меняться, в результате чего образуются формы гемоглобина разной степени аффинитет к кислороду.
Время жизни эритроцитов составляет в среднем 100-120 дней. В конце этого периода клетки стареют и разрушаются путем фагоцитоза макрофагами ретикулоэндотелиальной системы (печени, селезенки, костного мозга), расщепляясь на гем и глобин. Затем глобин распадется на аминокислоты, которые поступают в пул аминокислот печени и используются в зависимости от конкретных потребностей организма. Гем теряет железо, а оставшиеся пиррольные кольца образуют зеленый пигмент биливердин, который преобразуется в билирубин – желтый пигмент, содержащийся в желчи.
Источник
