Сколько гемов в составе молекулы гемоглобина
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
ГЕМОГЛОБИН (от греч. haima- кровь и лат. globus-шар), осн. белок
дыхат. цикла, участвующий в переносе О2 от органов дыхания к
тканям, а в обратном направлении – СО2. Содержится в эритроцитах
крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных.
Гемоглобин позвоночных (мол. м. 6,4*104-6,6*104) состоят
из четырех попарно идентичных субъединиц (их обозначают греч. буквами;
теми же буквами обозначают входящие в состав субъединиц полипептидные цепи,
а также гены, кодирующие эти цепи). Каждая субъединица имеет белковую глобиновую
часть, состоящую из 140-160 аминокислотных остатков, с к-рой нековалентно
связан гем-ферропрото-порфирин (см. ф-лу).
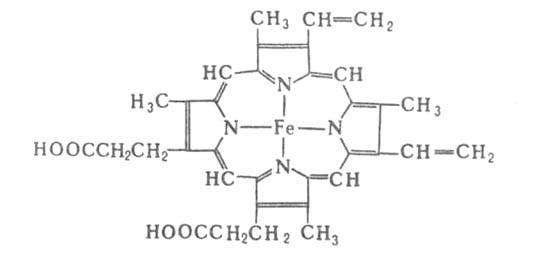
Ф-цию переноса О2 у нек-рых видов беспозвоночных выполняют
крупные гемсодержащие белки-эритрокруорины (мол. м. 0,4*106-6,7*106),
состоящие из 30-400 субъединиц, и хлоркруорины (мол. м. 3,4*106),
состоящие из 190 субъединиц. Эти белки способны обратимо связывать одну
молекулу О2 на группу гема, т.е. на субъединицу. Переносчиком
О2 у др. видов беспозвоночных служат негемовые белки, состоящие
из 8-10 субъединиц,— медьсодержащие гемоцианины (мол. м. 0,05*107*107)
и железосодержащие гемэритрины (мол. м. 1*105). Каждая субъединица
таких белков содержит два атома металла (соотв. Сu + и Fe2+), способных связать одну молекулу О2.
Гемоглобин взрослого человека (НbА) имеет мол. м. 6,49*104 и принадлежит
к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с
осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из
двух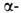 и двух
и двух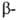 субъединиц,
субъединиц,
их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков.
Известны первичная структура обеих цепей, а также пространств. структура
оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной
формы (содержит Fe3+) НbА. Пространств. структура
субъединиц (рис. 1) характеризуется наличием восьми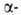 спиральных
спиральных
участков, включающих около 80% аминокислотных остатков, и внутр. полости
-гемового кармана. Фиксирование гема в субъединице осуществляется в результате
гидрофобных взаимод. пиррольных и винильных групп гема с алифатич. и ароматич.
боковыми радикалами аминокислот, выстилающими полость кармана, а также
благодаря координационной связи (направлена перпендикулярно к плоскости
кольца гема) Fe2+ с аксиальным лигандом-имидазольной группой
гистидина (т. наз. проксимальный гистидин). При оксигенации молекула О2
занимает шестое вакантное место в координационной сфере Fe2+.
Связывание происходит обратимо, без окисления железа, с образованием стабильного
оксигенированного комплекса НbО2. Одна молекула гемоглобина способна
присоединить 4 молекулы О2-по одной на группу гема.
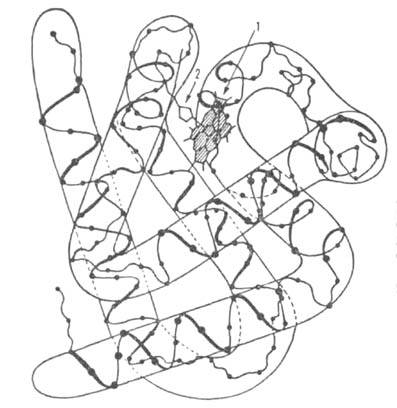
Рис. 1. Схема упаковки полипептидной цепи 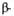 субъединицы
субъединицы
гемоглобина. Точками обозначены положения 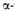 С
С
атомов аминокислотных остатков; 1 -гем; 2-проксимальный остаток гистидина.
Субъединицы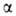
и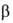 прочно
прочно
удерживаются в составе тетрамера гемоглобина множественными ван-дер-ваальсовыми
взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована
кроме того неск. ионными связями внутри и между субъединицами. Тетрамер
гемоглобина-кооперативная структура, в к-рой существует взаимод. пространственно
разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется
в облегчении присоединения к тетрамеру последующих молекул О2
по мере протекания оксигенирования, что значительно увеличивает эффективность
переноса О2 при физиол. условиях по сравнению с мономерными
гемоглобином и миоглобином (белок, депонирующий О2 в мышцах). Присоединение
О2 к молекуле гемоглобина сопровождается значит. конформационными перестройками
пространств. структуры субъединиц и тетрамера в целом.
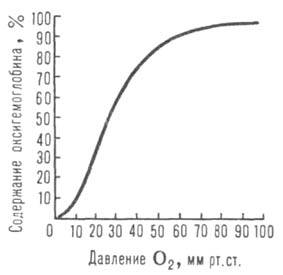
Сродство гемоглобина к О2 является основным физ.-хим. показателем
функциональных св-в гемоглобина; его принято характеризовать зависимостью степени
оксигенирования гемоглобина от парциального давления кислорода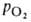
(кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной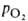 ,
,
при к-рой достигается оксигенирование 50% гемоглобина (р50)- Нормальная
величина р50 НbА в крови при физиол. условиях [37 °С, парциальное
давление СО2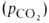
40 мм рт. ст., рН 7,4] составляет 26-28 мм рт. ст. Сигмоидный характер
КДК отражает кооперативный характер оксигенирования. При существующем у
человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±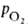
2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92-98% гемоглобина находится
в форме НbО2), отдает в тканях ок. 45 мл О2, при
этом содержание НbО2 в венозной крови составляет 70-75%.

Рис. 2. Зависимость содержания оксигемоглобина от парциального давления
кислорода.
Из клеток тканей СО2 диффундирует через плазму крови в эритроциты,
где гидратируется в р-ции, катализируемой ферментом карбоангидразой:
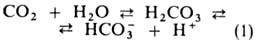
Гидрокарбонат-ионы в эритроцитах замещаются далее на ионы Cl-
из плазмы, сами переходят в плазму и переносятся ею к легким. Определенная
часть СО2 связывается в эритроцитах с N-концевыми аминогруппами
аминогруппами
гемоглобина с образованием остатка карбаминовой к-ты, уменьшая сродство гемоглобина к О2.
Увеличение РСО2 т-ры, ионной силы р-ра и уменьшение рН снижают
сродство гемоглобина к О2. Важнейший внутриэритроцитарный регулятор сродства
– анионы 2,3-дифосфоглицериновой к-ты. Увеличение их концентрации также
уменьшает сродство гемоглобина к О2. Снижение сродства при уменьшении
рН в интервале 9-6 наз. щелочным эффектом Бора, к-рый обусловлен существованием
равновесия:
Этот эффект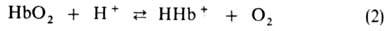
вносит значит. вклад в поддержание постоянного значения рН крови и освобождение
О2 в тканях соотв. уровню обмена в-в [увеличение концентрации
СО2 сдвигает равновесие р-ций (1) и (2) вправо]. В легких, где
рСО2 составляет 40 мм рт. ст., процессы, описываемые р-циями
(1) и (2), идут в обратном направлении, в результате чего СО2,
находящийся в растворенном и связанном с гемоглобином состоянии, освобождается, гемоглобин
оксигенируется и дыхат. цикл завершается.
У человека на разных этапах развития организма обнаружено несколько
гемоглобинов, различающихся составляющими их субъединицами. На ранних стадиях эмбрионального
развития у зародыша обнаруживаются гемоглобины строения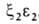 ,
,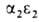 ,
,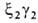
. На более поздних стадиях появляется и доминирует к моменту рождения HbF
(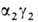 ; т. наз.
; т. наз.
фетальный гемоглобин). Св-ва эмбриональных гемоглобинов обеспечивают выполнение кисло-родтранспортной
ф-ции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого
человека содержится в норме 95-97% НЬА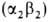
, начинающего преобладать через 2-3 месяца после рождения, и 2-3% НbА2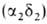
Первичные структуры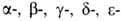
и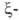 полипептидных
полипептидных
цепей гемоглобина человека, а также мн. др. глобиновых цепей разл. происхождения
известны. Гены, кодирующие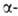 глобиновые
глобиновые
цепи гемоглобина человека, сцеплены и расположены в последовательности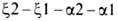
на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих
др. полипептидные цепи, также непосредственно примыкающие один к другому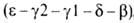 ,
,
локализована на хромосоме 11. Первичная структура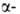 и
и
не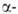 глобиновых
глобиновых
генов человека известна. Для каждого из них установлено наличие двух нитронов
(отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих
участков, находящихся на флангах генов. Биосинтез гема,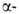
и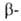 глобиновых
глобиновых
цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках
эритроцитарного ряда и практически завершается к моменту выхода зрелых
эритроцитов (их продолжительность жизни у человека составляет 120-130 дней)
из костного мозга в кровяное русло.
Точковые мутации в экзонах глобиновых генов могут вести к появлению
мутантных гемоглобинов с единичной аминокислотной заменой. Это м. б. причиной молекулярных
болезней — наследств. гемоглобинопатий. наиб. известный пример мутантного
гемоглобина- HbS, в к-ром шестой от N-конца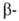 глобиновой
глобиновой
цепи остаток глутаминовой к-ты заменен на остаток валина. Такой гемоглобин содержится
в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция
(выпадение участка ДНК) или другой дефект глобинового гена, локализованный
вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах,
нарушить сбалансированный биосинтез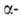 и
и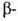 цепей
цепей
и привести к др. распространенной разновидности гемоглобинопатий-талассемии.
===
Исп. литература для статьи «ГЕМОГЛОБИН»: Уайт А., Хендлер Ф., Смит Э., Основы биохимии, пер. с англ.,
т. 3, М, 1981, с. 1218-66; Bunn Н. F., Forget В. G., Ranney Н. М, Нетоglobinopathies,
Phil.- L.- Toronto, 1977; Human hemoglobins and hemoglobinopathies, “Texas
Reports on Biology and Medicine”, 1980-1981, v. 40; Atlas of molecular
structures in bioldgy, ed. by D.C. Philips, P.M. Richards, v. 2, Haemoglobin
and myoglobin, ed. by G. Fermi and M.F. Perutz, Oxf., 1981; Methods in
enzymology, v. 76-Hemoglobins, N. Y.- L.- [a. o.], 1981. B.A. Спивак.
Страница «ГЕМОГЛОБИН» подготовлена по материалам химической энциклопедии.
Еще по теме:
- ГЕМОГЛОБИН – химическая энциклопедия
- Гемоглобин – биохимический справочник
- Гемоглобин – Наглядная биохимия
