Сколько молекул кислорода связывает гемоглобин
14.13.1. Транспорт кислорода
Кислород переносят молекулы гемоглобина, содержащиеся в эритроцитах. Гемоглобин представляет собой тетрамерный белок с мол. массой 68000. В его состав в качестве простетических групп входят четыре молекулы гема, которые присоединены к четырем полипептидным цепям глобина и придают крови характерный красный цвет. Каждый гем содержит один атом двухвалентного железа, непрочно связывающего одну молекулу кислорода (рис. 14.62):
Нb + 4O2 ↔ НbO8.

Рис. 14.62. Строение молекулы гема
Присоединение кислорода к гемоглобину с образованием оксигемоглобина происходит при высоком парциальном давлении кислорода-таком, как в капиллярах легочных альвеол. При низком парциальном давлении кислорода (как в капиллярах метаболически активных тканей) связь между кислородом и гемоглобином становится непрочной, кислород освобождается и диффундирует в окружающие клетки.
Количество кислорода, которое может связаться с гемоглобином, зависит от напряжения кислорода в среде. Последнее выражают как парциальное давление кислорода в атмосфере, находящейся в равновесии с данной средой. Парциальное давление до сих пор выражают в миллиметрах ртутного столба. Например, атмосферное давление на уровне моря составляет 760 мм рт. ст. Кислород составляет около 1/5 атмосферного воздуха; следовательно, его парциальное давление на уровне моря равно примерно 1/5⋅760 = 152 мм рт. ст.
Определяя процент насыщения крови кислородом при различном парциальном давлении O2, получают S-образную кривую, называемую кривой диссоциации оксигемоглобина (рис. 14.63).

Рис. 14.63. Этот график поясняет термины, принятые для описания кривых диссоциации пигментов, переносящих кислород. Напряжение насыщения – это то напряжение кислорода, при котором насыщено кислородом 95% пигмента, а напряжение полунасыщения – то, при котором насыщено кислородом 50% пигмента. (Из Florey, An introduction to general and comparative physiology, 1966, W. B. Saunders and Co.)
Анализ этой кривой показывает, что в физиологическом плане гемоглобин можно считать полностью насыщенным кислородом при таком напряжении О2, при котором фактически насыщается 95% гемоглобина. В примере, приведенном на рис. 14.63, такое напряжение составляет около 73 мм рт. ст. При более высоком парциальном давлении О2 может происходить дальнейшее его поглощение, но 100%-ное насыщение гемоглобина достигается редко. При парциальном давлении кислорода около 30 мм рт. ст. только 50% гемоглобина находится в форме оксигемоглобина, а при нулевом парциальном давлении О2 молекулы гемоглобина вообще не связывают кислород. В области крутого наклона кривой уже при небольшом снижении парциального давления О2 процент насыщения гемоглобина значительно уменьшается. Кислород, освобождаемый пигментом, становится доступным для тканей.
Почему же кривая насыщения имеет S-образную форму? Такая форма кривой объясняется аллостерическим характером взаимодействия гемоглобина с кислородом (разд. 6.6). Когда молекула О2 связывается с атомом двухвалентного железа одного из гемов, конфигурация этого гема слегка изменяется. Это изменение отражается на конфигурации всей молекулы гемоглобина, которая определенным образом меняется. По мере присоединения кислорода к второй и третьей группам гема происходит дальнейшее изменение конфигурации гемоглобина, и в результате каждая последующая молекула О2 присоединяется легче, чем предыдущая (явление кооперативности), так что последний гем связывает кислород в несколько сотен раз легче, чем первый.
Обратный процесс происходит тогда, когда оксигемоглобин оказывается в области низкого парциального давления О2, как это бывает в активно дышащих тканях. Первую молекулу кислорода оксигемоглобин отдает тканям очень легко, но вторая, третья и четвертая молекулы отделяются значительно труднее и только при очень сильном снижении парциального давления O2. При повышении парциального давления СО2 кривая диссоциации оксигемоглобина сдвигается вправо, и это явление называют эффектом Бора (рис. 14.64).

Рис. 14.64. Кривые диссоциации оксигемоглобина при различном парциальном давлении СО2, иллюстрирующие эффект Бора. (Из Garth Chapman, The body fluids and their function, Studies in Biology, № 8, 1967, Arnold.)
14.37. Каково физиологическое значение эффекта Бора?
14.38. Рассмотрите рис. 14.65. Кривая диссоциации оксигемоглобина у плода сдвинута влево по сравнению с кривой для матери. Чем объясняется такое смещение?
14.39. Кривая диссоциации оксигемоглобина у южноамериканских лам, живущих в Андах на высоте около 5000 м над уровнем моря, расположена левее, чем у большинства других млекопитающих (рис. 14.66). Чем это можно объяснить?

Рис. 14.65. Кривые диссоциации оксигемоглобина в крови плода и матери у овцы

Рис. 14.66. Сравнение кривых диссоциации оксигемоглобина у ламы и других млекопитающих
Собираетесь получить наибольшее многообразие в сексе? Всегда очаровательные проститутки имеют очень большой спектр услуг интимного характера, которыми вы при влечении можете попользоваться в абсолютно любое время дня и ночи.
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
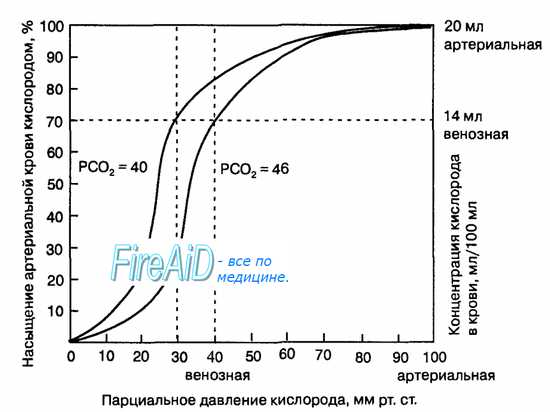
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
– Также рекомендуем “Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.”
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Кислородом гемоглобина диссоциации кривая , которая также называется кривой диссоциации оксигемоглобина или кислорода кривой диссоциации ( ODC ), представляет собой кривую , что участки доля от гемоглобина в его насыщенном ( кислорода -laden) формы на вертикальной оси по отношению к преобладающему напряжения кислорода на Горизонтальная ось. Эта кривая – важный инструмент для понимания того, как наша кровь переносит и выделяет кислород. В частности, кривая диссоциации оксигемоглобина связывает насыщение кислородом (S O 2 ) и парциальное давление кислорода в крови (P O 2 ) и определяется тем, что называется «сродством гемоглобина к кислороду»; то есть насколько легко гемоглобин поглощает и выделяет молекулы кислорода в окружающую его жидкость.
Задний план
Гемоглобин (Hb) – это основной переносчик кислорода в крови . Каждая молекула гемоглобина способна переносить четыре молекулы кислорода. Эти молекулы кислорода связываются с железом из гема группы протезного .
Когда гемоглобин не имеет связанного кислорода или связанного углекислого газа , он имеет несвязанную конформацию (форму). Связывание первой молекулы кислорода вызывает изменение формы гемоглобина, что увеличивает его способность связываться с тремя другими молекулами кислорода.
В присутствии растворенного углекислого газа изменяется pH крови; это вызывает другое изменение формы гемоглобина, которое увеличивает его способность связывать углекислый газ и снижает его способность связывать кислород. С потерей первой молекулы кислорода и связыванием первой молекулы диоксида углерода происходит еще одно изменение формы, которое дополнительно снижает способность связывать кислород и увеличивает способность связывать диоксид углерода. Кислород, связанный с гемоглобином, выделяется в плазму крови и всасывается тканями , а углекислый газ в тканях связывается с гемоглобином.
В легких происходит обратный процесс. С потерей первой молекулы углекислого газа форма снова изменяется, что облегчает высвобождение трех других углекислых газов.
Кислород также переносится растворенным в плазме крови , но в гораздо меньшей степени. Гемоглобин содержится в красных кровяных тельцах . Гемоглобин высвобождает связанный кислород, когда угольная кислота присутствует в тканях. В капиллярах , где вырабатывается углекислый газ , кислород, связанный с гемоглобином, выделяется в плазму крови и всасывается тканями.
То, какая часть этой емкости в любой момент заполнена кислородом, называется насыщением кислородом . Выраженное в процентах, насыщение кислородом – это отношение количества кислорода, связанного с гемоглобином, к способности гемоглобина переносить кислород. Переносимость кислорода гемоглобином определяется типом гемоглобина, присутствующего в крови. Количество кислорода, связанного с гемоглобином в любой момент времени, в значительной степени связано с парциальным давлением кислорода, которому подвергается гемоглобин. В легких на границе альвеол и капилляров парциальное давление кислорода обычно высокое, и поэтому кислород легко связывается с гемоглобином, который присутствует. По мере того как кровь циркулирует в других тканях тела, в которых парциальное давление кислорода меньше, гемоглобин выделяет кислород в ткань, потому что гемоглобин не может поддерживать свою полную способность связывать кислород в присутствии более низких парциальных давлений кислорода.
Сигмовидная форма
Кривая насыщения гемоглобина
Кривая обычно лучше всего описывается сигмовидной диаграммой с использованием формулы следующего вида:
Молекула гемоглобина может обратимым способом связывать до четырех молекул кислорода.
Форма кривой является результатом взаимодействия связанных молекул кислорода с входящими молекулами. Связывание первой молекулы затруднено. Однако это облегчает связывание второго, третьего и четвертого, это происходит из-за индуцированного конформационного изменения структуры молекулы гемоглобина, вызванного связыванием молекулы кислорода.
В самом простом виде кривая диссоциации оксигемоглобина описывает соотношение между парциальным давлением кислорода (ось x) и насыщением кислородом (ось y). Сродство гемоглобина к кислороду увеличивается по мере связывания последовательных молекул кислорода. По мере увеличения парциального давления кислорода связывается больше молекул, пока не будет достигнуто максимальное количество, которое может быть связано. По мере приближения к этому пределу происходит очень небольшое дополнительное связывание, и кривая выравнивается по мере насыщения гемоглобина кислородом. Следовательно, кривая имеет сигмоидальную или S-образную форму. При давлениях выше примерно 60 мм рт. Ст. Стандартная кривая диссоциации относительно плоская, что означает, что содержание кислорода в крови существенно не изменяется даже при значительном увеличении парциального давления кислорода. Чтобы получить больше кислорода в ткани, потребовалось бы переливание крови для увеличения количества гемоглобина (и, следовательно, способность переносить кислород) или дополнительного кислорода, который увеличил бы растворенный в плазме кислород. Хотя связывание кислорода с гемоглобином продолжается до некоторой степени при давлениях около 50 мм рт.ст., поскольку парциальное давление кислорода снижается в этой крутой области кривой, кислород легко выгружается в периферические ткани, поскольку сродство гемоглобина уменьшается. Парциальное давление кислорода в крови, при котором гемоглобин насыщен на 50%, обычно около 26,6 мм рт. Ст. (3,5 кПа) для здорового человека, известно как P 50 . P 50 – это стандартная мера сродства гемоглобина к кислороду. При наличии заболевания или других состояний, которые изменяют сродство гемоглобина к кислороду и, следовательно, сдвигают кривую вправо или влево, P 50 изменяется соответственно. Повышенное значение P 50 указывает на сдвиг стандартной кривой вправо, что означает, что необходимо большее парциальное давление для поддержания 50% насыщения кислородом. Это указывает на пониженное сродство. И наоборот, более низкий P 50 указывает на сдвиг влево и более высокое сродство.
«Плато» кривой диссоциации оксигемоглобина – это диапазон, который существует в легочных капиллярах (минимальное снижение переносимого кислорода до тех пор, пока p (O 2 ) не упадет на 50 мм рт.
«Крутой» участок кривой диссоциации оксигемоглобина – это диапазон, который существует в системных капиллярах (небольшое падение p (O 2 ) в системных капиллярах может привести к высвобождению большого количества кислорода для метаболически активных клеток).
Чтобы увидеть относительное сродство каждого последующего кислорода при удалении / добавлении кислорода из / в гемоглобин из кривой, сравните относительное увеличение / уменьшение p (O 2 ), необходимое для соответствующего увеличения / уменьшения s (O 2 ).
Факторы, влияющие на стандартную кривую диссоциации
На силу связывания кислорода с гемоглобином влияет несколько факторов. Эти факторы сдвигают или изменяют форму кривой диссоциации оксигемоглобина. Сдвиг вправо указывает на то, что исследуемый гемоглобин имеет пониженное сродство к кислороду. Это затрудняет связывание гемоглобина с кислородом (требуется более высокое парциальное давление кислорода для достижения такого же насыщения кислородом), но облегчает гемоглобину высвобождение связанного с ним кислорода. Эффект этого сдвига кривой вправо увеличивает парциальное давление кислорода в тканях, когда это больше всего необходимо, например, во время физических упражнений или геморрагического шока. Напротив, кривая сдвигается влево из-за противоположного этим условиям. Этот сдвиг влево указывает на то, что исследуемый гемоглобин имеет повышенное сродство к кислороду, поэтому гемоглобин легче связывает кислород, но более неохотно его разгружает. Смещение кривой влево является признаком повышенного сродства гемоглобина к кислороду (например, в легких). Точно так же сдвиг вправо показывает снижение аффинности, которое может появиться при повышении температуры тела, концентрации ионов водорода, 2,3-бисфосфоглицерата (2,3-BPG) или концентрации диоксида углерода.
| Факторы контроля | + Изменить | Сдвиг кривой |
|---|---|---|
| Температура | ↑ | → |
| ↓ | ← | |
| 2,3-БПГ | ↑ | → |
| ↓ | ← | |
| pCO 2 | ↑ | → |
| ↓ | ← | |
| Кислотность [H + ] | ↑ | → |
| ↓ | ← |
Заметка:
- Сдвиг влево: более высокое сродство к O 2
- Сдвиг вправо: меньшее сродство к O 2
- гемоглобин плода имеет более высокое сродство к O 2, чем гемоглобин взрослого; в первую очередь из-за значительно пониженного сродства к 2,3-бисфосфоглицерату .
Причины сдвига вправо можно запомнить с помощью мнемоники « КАДЕТ , лицо вправо!» для C O 2 , A CID, 2,3- D PG, E xercise и T емпера тура. Факторы, которые сдвигают кривую диссоциации кислорода вправо, – это те физиологические состояния, при которых тканям требуется больше кислорода. Например, во время упражнений у мышц выше скорость метаболизма, и, следовательно, им требуется больше кислорода, они производят больше углекислого газа и молочной кислоты, и их температура повышается.
pH
Уменьшение pH (увеличение концентрации ионов H + ) сдвигает стандартную кривую вправо, а увеличение – влево. Это происходит потому, что при более высокой концентрации ионов H + различные аминокислотные остатки, такие как гистидин 146, существуют преимущественно в протонированной форме, что позволяет им образовывать ионные пары, которые стабилизируют дезоксигемоглобин в состоянии T. Состояние Т имеет более низкое сродство к кислороду , чем состояние R, так и с повышенной кислотностью, гемоглобин связывает меньше O 2 для заданного P O2 (и более H + ). Это известно как эффект Бора . Снижение общей связывающей способности гемоглобина по отношению к кислороду (т.е. смещение кривой вниз, а не только вправо) из-за снижения pH называется корневым эффектом . Это наблюдается у костистой рыбы. Сродство связывания гемоглобина с O 2 является наибольшим при относительно высоком pH.
Углекислый газ
Углекислый газ влияет на кривую двумя способами. Во-первых, накопление CO 2 вызывает образование карбаминовых соединений посредством химических взаимодействий, которые связываются с гемоглобином, образуя карбаминогемоглобин . CO 2 считается аллостерической регуляцией, поскольку ингибирование происходит не в месте связывания гемоглобина. Во-вторых, он влияет на внутриклеточный pH за счет образования бикарбонат-иона. Образование карбаминогемоглобина стабилизирует Т-состояние гемоглобина за счет образования ионных пар. Только около 5–10% от общего содержания CO 2 в крови транспортируется в виде карбаминовых соединений, тогда как (80–90%) транспортируется в виде ионов бикарбоната, а небольшое количество растворяется в плазме. Образование бикарбонат-иона будет высвобождать протон в плазму, снижая pH (повышенная кислотность), что также сдвигает кривую вправо, как обсуждалось выше; низкий уровень CO 2 в кровотоке приводит к высокому pH и, таким образом, обеспечивает более оптимальные условия связывания гемоглобина и O 2 . Это физиологически предпочтительный механизм, поскольку гемоглобин будет терять больше кислорода, поскольку концентрация углекислого газа резко возрастает, когда тканевое дыхание происходит быстро и кислород нуждается.
2,3-БПГ
2,3-Bisphosphoglycerate или 2,3-БПГ (ранее названный 2,3-ДФГ или 2,3-ДФГ – ссылка) является фосфорорганическими формируется в красных кровяных клеток в процессе гликолиза и является сопряженное основание из 2,3-bisphosphoglyceric кислота . Производство 2,3-BPG, вероятно, является важным адаптивным механизмом, потому что производство увеличивается при нескольких состояниях в присутствии пониженной доступности O 2 в периферических тканях , таких как гипоксемия , хроническое заболевание легких, анемия и застойная сердечная недостаточность , среди прочих. . Высокие уровни 2,3-БПГ смещают кривую вправо (как в детстве), в то время как низкие уровни 2,3-БПГ вызывают сдвиг влево, наблюдаемый при таких состояниях, как септический шок и гипофосфатемия . В отсутствие 2,3-БПГ повышается сродство гемоглобина к кислороду. 2,3-BPG действует как гетероаллостерический эффектор гемоглобина, снижая сродство гемоглобина к кислороду за счет связывания преимущественно с дезоксигемоглобином. Повышенная концентрация БПГ в эритроцитах способствует формированию Т (напряженного или напряженного) состояния гемоглобина с низким сродством, и поэтому кривая связывания кислорода смещается вправо.
Температура
Повышение температуры сдвигает ODC вправо. Если при сохранении температуры повышать температуру , то насыщение кислородом снижается, потому что связь между железом и железом денатурируется. Точно так же с повышением температуры также увеличивается парциальное давление кислорода. Таким образом, у человека будет меньший процент насыщения гемоглобина при таком же или более высоком парциальном давлении кислорода. Таким образом, любая точка кривой сместится вправо (из-за повышенного парциального давления кислорода) и вниз (из-за ослабления связи). Следовательно, сдвиг кривой вправо.
Монооксид углерода
Гемоглобин связывается с оксидом углерода в 210 раз быстрее, чем с кислородом. Из-за более высокого сродства гемоглобина к окиси углерода, чем к кислороду, окись углерода – очень успешный конкурент, который вытесняет кислород даже при крохотных парциальных давлениях. Реакция HbO 2 + CO → HbCO + O 2 практически необратимо вытесняет молекулы кислорода, образуя карбоксигемоглобин ; Связывание монооксида углерода с железным центром гемоглобина намного сильнее, чем у кислорода, и сайт связывания остается заблокированным до конца жизненного цикла затронутого эритроцита. При повышенном уровне окиси углерода человек может страдать от тяжелой гипоксии тканей при сохранении нормального pO 2, поскольку карбоксигемоглобин не переносит кислород к тканям.
Последствия метгемоглобинемии
Метгемоглобинемия – это форма аномального гемоглобина, при которой центр железа был окислен из состояния окисления двухвалентного железа +2 (нормальная форма) до состояния трехвалентного железа +3 . Это вызывает сдвиг влево кривой диссоциации кислородного гемоглобина, поскольку любой остаточный гем с оксигенированным двухвалентным железом (состояние +2) не может выгрузить связанный кислород в ткани (поскольку 3+ железо нарушает кооперативность гемоглобина), тем самым увеличивая его сродство с кислородом. . Однако метгемоглобин имеет повышенное сродство к цианиду и поэтому полезен при лечении отравления цианидом . В случае случайного проглатывания введение нитрита (например, амилнитрита ) можно использовать для преднамеренного окисления гемоглобина и повышения уровня метгемоглобина, восстанавливая функционирование цитохромоксидазы . Нитрит также действует как вазодилататор , способствуя снабжению клеток кислородом, а добавление соли железа обеспечивает конкурентное связывание свободного цианида в виде биохимически инертного иона гексацианоферрата (III) , [Fe (CN) 6 ] 3– . Альтернативный подход включает введение тиосульфата , тем самым превращая цианид в тиоцианат , SCN – , который выводится через почки. Метгемоглобин также образуется в небольших количествах, когда диссоциация оксигемоглобина приводит к образованию метгемоглобина и супероксида O 2 – вместо обычных продуктов. Супероксид является свободным радикалом и вызывает биохимические повреждения, но нейтрализуется действием фермента супероксиддисмутазы .
Эффекты ITPP
Мио-инозитолтриспирофосфат (ITPP), также известный как OXY111A, представляет собой инозитолфосфат, который вызывает сдвиг вправо в кривой диссоциации кислородного гемоглобина за счет аллостерической модуляции гемоглобина в красных кровяных тельцах. Это экспериментальный препарат, предназначенный для уменьшения гипоксии тканей . Эффект длится примерно до тех пор, пока пораженные эритроциты остаются в обращении.
Гемоглобин плода
Кривая насыщения гемоглобина плода
Гемоглобин плода (HbF) структурно отличается от нормального гемоглобина взрослого человека (HbA), что придает HbF более высокое сродство к кислороду, чем HbA. HbF состоит из двух альфа и двух гамма цепей, тогда как HbA состоит из двух альфа и двух бета цепей. Кривая диссоциации плода смещена влево относительно кривой для нормального взрослого человека из-за этих структурных различий.
Обычно артериальное давление кислорода у плода ниже, чем у взрослых. Следовательно, более высокое сродство к связыванию кислорода требуется при более низких уровнях парциального давления у плода, чтобы обеспечить диффузию кислорода через плаценту . В плаценте образуется более высокая концентрация 2,3-BPG , и 2,3-BPG легко связывается с бета-цепями, а не с альфа-цепями. В результате 2,3-BPG более прочно связывается с гемоглобином взрослого человека, заставляя HbA выделять больше кислорода для поглощения плодом, чей HbF не зависит от 2,3-BPG. Затем HbF доставляет связанный кислород к тканям с еще более низким парциальным давлением, откуда он может высвобождаться.
Смотрите также
- Автоматический анализатор
- Эффект Бора
Примечания
Ссылки
внешние ссылки
- Носек, Томас М. «Раздел 4 / 4ч5 / с4ч5_18» . Основы физиологии человека . Архивировано из оригинала на 2016-03-24.
- Интерактивная кривая диссоциации оксигемоглобина
- Моделирование параметров CO 2 , pH и температуры на кривой диссоциации кислород-гемоглобин (сдвиг влево или вправо)
