Содержание оксигемоглобина в крови в норме
Несмотря на то, что исследование кислотно-основного состояния, строго говоря, подразумевает исследование только величины pH (концентрации ионов H+), в реальности в него также включается исследование физиологически важных газов, присутствующих в крови – O2 и CO2. Анализ газов показывает эффективность газообмена по величинам парциальных давлений – pO2 и pCO2.
Через альвеолярную мембрану молекулы любых газов перемещаются диффузно по градиенту концентрации. Молекулы O2 атмосферного воздуха поступают из альвеол в кровь, а молекулы CO2 из крови в альвеолы до тех пор пока их парциальные давления не выровняются.
Величина парциального давления – это процентная доля газа в общем объеме.
Углекислый газ
Концентрация СО2 в альволярном воздухе столь низка, а в крови столь высока, что диффузия этого газа в альвеолы чрезвычайно эффективна и скорость его удаления зависит только от альвеолярной вентиляции – общего объема воздуха, транспортируемого в минуту между альвеолами и атмосферой (“скорости выдувания”).
Следовательно,
- при усиленной вентиляции легких углекислый газ быстро выводится, и показатель pCO2в крови снижается. Это означает потерю организмом угольной кислоты (ионов H+), что является причиной защелачивания крови – алкалоза, называемого дыхательным или респираторным.
- при недостаточной альвеолярной вентиляции величина рСО2 повышается, что свидетельствует о недостаточном его удалении и накоплении H2CO3. Иными словами, повышение в крови показателя рСО2 является причиной дыхательного ацидоза.
Увеличенное pCO2 (гиперкапния) всегда свидетельствует о снижении альвеолярной вентиляции.
Кислород
Вопросы, связанные с оксигенацией крови и транспортом кислорода более сложны. Связано это с тем, что в виде свободных (растворенных) молекул O2 находится лишь небольшая доля общего кислорода крови. Основная часть кислорода связана с гемоглобином (оксигемоглобин) и истинное содержание кислорода зависит от двух дополнительных параметров – концентрации Hb и насыщения (сатурации) гемоглобина кислородом.
Оксигемоглобин
Оксигемоглобин (HbО2) – процентное содержание в крови, является отношением фракции оксигемоглобина (HbО2) к сумме всех фракций (общему гемоглобину).
Насыщение гемоглобина кислородом
Насыщение гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Отличия между двумя показателями HbО2 и HbOSAT заключаются в том, что у пациентов возможно наличие в крови такой формы гемоглобина, которая не способна акцептировать О2 (Hb‑CO, metHb, сульфоHb). Но так как большинство больных не имеют в крови повышенного содержания этих форм гемоглобина, значения HbО2 и SО2 обычно очень близки.
Например, если при отравлении нитритами количество metHb составляет 15%, тогда величина HbО2 никогда не сможет превысить 85%, но насыщение (HbOsat) может быть различно – от максимума (HbOsat=95-98%) при полном насыщении до низких величин при отсутствии кислорода.
Показатель насыщения кислородом показывает процент доступных мест связывания на гемоглобине.
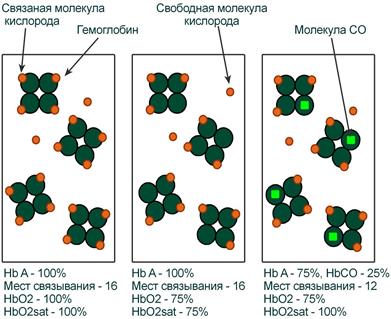
Иллюстрация понятий оксигемоглобина (HbO2) и насыщения гемоглобина (HbO2sat)
Парциальное давление кислорода (pO2)
Парциальное давление O2 выступает как движущая сила, приводящая к насыщению гемоглобина кислородом. И хотя, как правило, чем выше pO2 тем выше HbOsat, эта зависимость не является линейной.

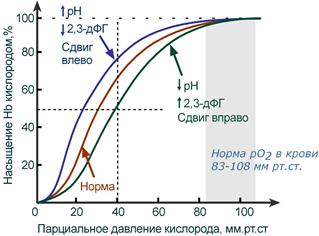
Кривая диссоциации гемоглобина в норме и
при изменении pH и концентрации 2,3-дифосфоглицерата
В центральной части кривой насыщения (или кривой диссоциации) гемоглобина малейшие сдвиги pO2 приводят к резким изменениям насыщения гемоглобина. И наоборот, при высоком pO2 (80-90-100 мм рт.ст) кривая становится плоской, насыщение гемоглобина мало зависит от колебаний кислорода в плазме.
Сдвиг влево происходит при защелачивании и снижении концентрации 2,3-дифосфоглицерата и сигнализирует об увеличении сродства кислорода к гемоглобину (в легких). Сдвиг вправо – это снижение сродства кислорода к гемоглобину (в тканях), обеспечивается закислением среды и накоплением 2,3-дифосфоглицерата.
Показатель pO2 не отражает содержание кислорода в цельной крови! Но хотя pO2 и не показывает общее количество кислорода в крови, но это общее количество зависит от pO2 через показатель сатурации гемоглобина.
В свою очередь имеются факторы, влияющие на величину pO2:
1. Альвеолярная вентиляция. Хотя она влияет как на pO2 так и на pCO2, но доля кислорода в альвеолах при гипервентиляции может лишь слегка увеличиться, приближаясь к pO2 атмосферного воздуха, при гиповентиляции – стремительно падает, вытесняясь поступающим из крови CO2. В то же время доля CO2 в альвеолах быстро снижается при усиленной вентиляции.
2. Вентиляционно-перфузионное соотношение, определяется тем, что
- не вся кровь, притекающая к легким, соприкасается с хорошо вентилируемыми альвеолами (спадение альвеол, уплотнение стенки).
- не все хорошо вентилируемые альвеолы получают достаточно крови (правожелудочковая сердечная недостаточность).
3. Концентрация кислорода во вдыхаемом воздухе (FiO2, fraction of inspired oxygen).
В таблице приведены сравнительные величины концентрации кислорода и углекислого газа в воздухе, крови и тканях.
Необходимо обратить внимание на перепады концентраций кислорода и углекислого газа в крови и альвеолярном воздухе. Важной особенностью является то, что pO2 в альвеолярном воздухе и артериальной крови очень близки, т.е. в обычных условиях глубоким и/или частым дыханием невозможно повысить потребление кислорода и насыщение им гемоглобина. В то же время разность концентраций pCO2 в венозной крови и альвеолярном воздухе позволяет эффективно его удалять при частом дыхании.
| pO2, мм рт.ст. | pCO2, мм рт.ст | |
| Вдыхаемый воздух | 159 | 0,23 |
| Альвеолярный воздух | 105-110 | 40 |
| Артериальная кровь | 83-108 | 35-45 |
| Ткани | 10-20 | 50-60 |
| Венозная кровь | 35-49 | 46-51 |
| Выдыхаемый воздух | 116 | 32 |
Источник
Гемоглобин — белок крови, отвечающий за клеточное дыхание. Очень важно, чтобы его уровень всегда находился в пределах физиологической нормы. К чему могут привести отклонения концентрации и как их избежать — об этом пойдет речь в нашем обзоре.
Что такое гемоглобин и как определить его уровень?
Одна из первостепенных функций крови — снабжение организма кислородом и удаление углекислого газа. Эта задача осуществляется эритроцитами, клетками с высоким содержанием особого белка, нигде более не синтезирующегося, — гемоглобина. Эта крупная молекула содержит ионы железа, способного связывать кислород. В легких, где содержание кислорода высоко, гемоглобин легко «забирает» молекулы этого газа. С током крови эритроциты переносятся к капиллярам, где отсутствует доступ к свободному кислороду. Там непрочная связь кислорода с гемоглобином разрывается, клетки получают кислород, а эритроциты забирают углекислый газ и уносят его вместе с венозной кровью назад, к легким, где цикл повторяется снова.
Концентрация гемоглобина в крови — очень чувствительный к сбоям в работе организма показатель. Именно поэтому оценку уровня данного белка включают в стандартный — общий клинический анализ крови. Он назначается при диагностике, лечении, а также при профилактических осмотрах.
Норма содержания гемоглобина в крови
Какое содержание гемоглобина в крови соответствует норме? Дело в том, что этот показатель довольно динамичный и зависит от возраста, пола и даже образа жизни.
Норма содержания гемоглобина в крови у мужчин составляет 130–160 г/л, у женщин — 120–150 г/л. Причем это значение меняется с возрастом. В первые дни после рождения уровень гемоглобина достигает 198 г/л, тогда как на втором месяце жизни показатель снижается до 94 г/л. С этого возраста и до достижения 12 лет концентрация гемоглобина в крови ребенка постепенно повышается, достигая взрослой нормы. После 45 лет, показатели нормы гемоглобина в крови начинают постепенно увеличиваться. У людей старше 65 лет речь идет о 117–161 г/л и 126–174 г/л у женщин и мужчин соответственно.
При беременности и в период лактации ресурсы женского организма направляются на развитие сначала плода, а потом и малыша. Поэтому пониженное содержание гемоглобина является в этот период нормой. Конечно, в разумных пределах.
Повышение гемоглобина в крови тоже не всегда признак патологических процессов в организме. Например, у профессиональных спортсменов и альпинистов повышенный гемоглобин в крови является в некотором смысле нормой.
Повышенный гемоглобин в крови
При отсутствии серьезных физических нагрузок высокий уровень гемоглобина свидетельствует о наличии заболеваний, например, диабете или развитии опухолей. Кроме того, состояние представляет угрозу само по себе. Кровь становится гуще, а значит, повышается риск образования тромбов. Это может привести к развитию инфаркта или инсульта. Чтобы снизить риски, врачи в дополнение к основной терапии рекомендуют исключать из рациона красное мясо и другие богатые железом, а также жирами продукты.
Помимо диеты при устойчивых повышенных показателях уровня гемоглобина в крови могут быть назначены препараты, разжижающие кровь, а также процедура эритроцитафереза — частичное очищение крови от эритроцитов.
Пониженный гемоглобин в крови
Состояния, когда гемоглобин в крови понижен, встречаются гораздо чаще. Самой распространенной причиной является нехватка в организме железа. По данным ВОЗ, от дефицита железа страдает более 30% населения Земли . Провоцирует состояние в первую очередь несбалансированное питание, бедное железом и необходимыми для его усвоения витаминами B9 и B12. Пониженный гемоглобин также может быть следствием кровопотерь, инфекционных и аутоиммунных заболеваний.
Состояние, когда содержание гемоглобина в крови падает, называют анемией. Степень ее тяжести определяется по выраженности снижения концентрации гемоглобина в крови пациента. Легкая анемия часто проходит на фоне отсутствия симптомов и сопровождается показателями в 90–110 г/л. Дальнейшее снижение содержания гемоглобина крови (70–90 г/л), как правило, приводит к ухудшению самочувствия. Развивается слабость, снижается концентрация внимания, человек выглядит бледным и утомленным. В этом случае речь идет об анемии средней степени. При концентрации гемоглобина ниже 70 г/л ставится диагноз «анемия тяжелой степени». Ей, помимо прочего, присущи ломкость ногтей, «заеды» в уголках губ, снижение иммунитета.
Лечение железодефицитной анемии предполагает устранение заболевания, приведшего к ее развитию, а также компенсацию потерь железа с помощью лекарственных препаратов и изменения образа жизни. Больной должен чаще бывать на свежем воздухе, вести по возможности активный образ жизни и пересмотреть рацион. Предпочтительно питаться продуктами, богатыми железом, такими как мясо, печень и рыба. От молочных продуктов во время основных приемов пищи лучше отказаться. Содержащийся в них белок казеин связывает железо, в результате чего оно не усваивается. Повысить поступление в организм витаминов В и С, способствующих всасыванию железа, помогут как витаминные комплексы, так и включение в рацион бобовых, отрубей, зеленого лука и капусты.
При серьезных формах анемии необходимо принимать лекарственные препараты. Курс лечения длится несколько месяцев.
Итак, уровень содержания гемоглобина в крови — и взрослым, и детям, — важно держать под контролем. Не стоит бить тревогу, если вы обнаружили отклонение от нормы, возможно, это временное изменение, вызванное, например, стрессом. Однако при любых, особенно длительных, изменениях данного показателя следует обратиться к врачу за комментариями. Скорее всего, при незначительном повышении уровня гемоглобина ваш доктор посоветует скорректировать рацион питания, а при небольшом падении концентрации — помимо «богатой железом» диеты, принимать профилактические средства, например, биологически активные добавки к пище (БАДы) или витаминно-минеральные комплексы.
Источник
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник
