Соединение гемоглобина с диоксидом углерода называется

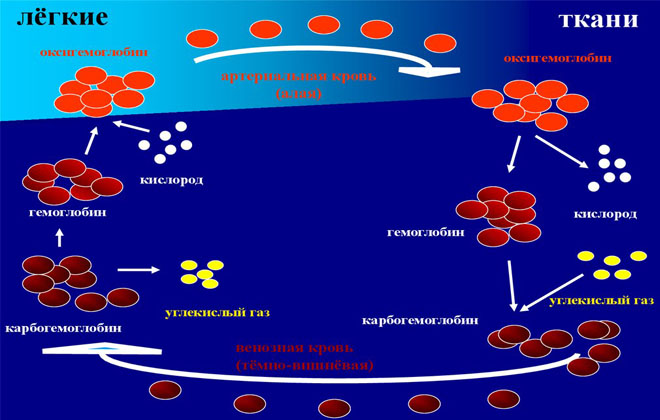
Дыхание — непременное условие жизнедеятельности клеток организма, которые поглощают кислород и выделяют двуокись углерода. Функцию транспортного средства, доставляющего О2 и выводящего СО2, выполняет кровь. Карбогемоглобин — это ее важная составляющая, участвующая в газообмене.
Что это такое
Гемоглобин (Hb) состоит из гема, соединения, содержащего железо, и белкового вещества глобина. Связываясь с О2, поступающим в кровь из легких, Hb снабжает им ткани, а соединяясь с СО2, очищает их от двуокиси углерода и доставляет ее к альвеолам, через которые этот газ удаляется в атмосферу.
Существуют 3 фракции (вида, модификации) гемоглобина, обусловленные физиологическими функциями. Соединяясь с О2, Hb превращается в оксигемоглобин НbО2. Это ярко-красное вещество преобладает в артериальной крови. Кроме того, оно содержится и в миокарде, во всех скелетных мышцах. Мышечный гемоглобин связывает около 10-14% всего О2 в организме. Миоглобин обеспечивает мышцы кислородом, когда они сокращаются, поскольку в это время кровоток приостанавливается.
НbО2, отдав тканям кислород, преобразуется в восстановленный (редуцированный) гемоглобин HНb. Эта субстанция содержится в венозной крови, обуславливая ее темно-вишневую окраску.
Соединение гемоглобина с углекислым газом называется карбогемоглобином. НbСO2 выводит двуокись углерода из клеток и транспортирует в легкие до 20% этого газа. Карбогемоглобин тоже содержится в венозной крови. Hb непрерывно преобразуется из оксигемоглобина в карбогемоглобин и обратно.
Кроме того, Hb образует стойкое соединение с глюкозой, содержащейся в крови. При диабете уровень гликированного гемоглобина HbA1c существенно возрастает. По динамике его концентрации можно судить об эффективности лечения этого заболевания.
Еще одна модификация Hb — фетальный гемоглобин, который содержится в крови новорожденных и исчезает к 1 году. Его наличие у взрослых свидетельствует о нарушениях в организме.
Однако Hb может видоизменяться, образуя и патологические модификации. Соединение гемоглобина с угарным газом называется карбоксигемоглобином. HbСО утрачивает способность транспортировать О2, поэтому клетки испытывают острое кислородное голодание. Анализ на наличие карбоксигемоглобина используется в криминалистике, поскольку позволяет выявить скрытые следы крови. Так, например, отсутствие HbСО в костной ткани трупного материала доказывает, что погибший был уже мертв до начала пожара.
От сильной гипоксии ткани также страдают, когда Hb окисляется и двухвалентное железо в геме замещается трехвалентным Fe. Образующийся при этом метгемоглобин HbMet настолько прочно связывается с О2, что практически не отдает его клеткам. Такое патологическое состояние наступает при отравлении нитратами, нитритами, анилинами, перекисью водорода, марганцовокислым калием, бертолетовой солью и другими веществами-окислителями.
Норма и отклонения
Количество гемоглобина в крови считается оптимальным в следующих пределах (г/л):
- у мужчин: 130-160, после 55-60 лет — 120-140;
- у женщин: 120-140, при беременности — 110-150;
- у детей: до 6 лет — 110-140, до 15 лет — 115-150;
- у жителей высокогорных районов: на 10-20 г/л выше.
Карбоксигемоглобин обнаруживается у некурящих в диапазоне от 0,5 до 1,5%, а у курильщиков — от 4 до 9% от всего объема Hb. О тяжелых отравлениях свидетельствуют показатели более 20%.
Норма в крови метгемоглобина — 0,04-1,52 %. При отравлениях концентрация HbMet достигает более 15%. Летальный исход наступает, если отклонения в показателях превышают 70%.
Проведение и расшифровка анализа
Результаты исследования Hb в медучреждениях нередко отличаются друг от друга, поскольку лаборатории оснащены приборами разных поколений. При проведении анализов крови нередко сказывается и субъективный фактор, зависящий от квалификации лаборанта. Кроме того, следует иметь в виду, что количество гемоглобина максимально вечером и минимально утром.
Сегодня наиболее распространен традиционный метод Сали. Содержание Hb определяют, добавляя к крови соляную кислоту. При этом гем, соединяясь с HCl, преобразуется в кристаллический гемин. Анализы биоматериалов на гемин применяются в судебной медицине для выявления следов крови.
Наиболее точные результаты дает автоматизированный метод с использованием гемометра. Такое исследование проводится гораздо быстрее. Но и при этом методе возможны незначительные расхождения показателей. Однако при расшифровке анализа следует обращать внимание на большие отклонения от нормы Hb, которые свидетельствуют о патологических процессах.
Так, избыток гемоглобина может быть следствием:
- легочной недостаточности;
- обезвоживания организма;
- химических отравлений;
- заболеваний крови, печени, кишечника;
- пороков сердца и др.
Дефицит Hb может быть признаком:
- анемий различной этиологии;
- нарушений менструального цикла;
- эрозий и изъязвлений ЖКТ;
- внутренних кровотечений;
- инфекций;
- воспалительных процессов с отечностью;
- сахарного диабета;
- заболеваний почек;
- злокачественных опухолей и других патологий.
При существенных отклонениях гемоглобина от нормы следует незамедлительно пройти углубленное обследование организма. Вовремя назначенное лечение позволит избежать развития многих опасных заболеваний.
Источник
Гемоглобин (Нв) – основной компонент эритроцитов, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. По химической природе он относится к хромопротеидам. У мужчин в крови содержится в среднем 130-160 г/л гемоглобина, у женщин – 120-150 г/л. Молекулярная масса гемоглобина составляет около 60000 Да. Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода.
Гем содержит двухвалентное железо, которое играет ключевую роль в деятельности гемоглобина, являясь его активной (простетической) группой. Гемоглобин синтезируется эритро- и нормобластами костного мозга. Для нормального синтеза гемоглобина необходимо достаточное поступление железа с пищей. При разрушении эритроцитов гемоглобин, после отщепления гема, превращается в билирубин – желчный пигмент, который поступает, в основном, в кишечник в составе желчи, где превращается в стеркобилин, выводящийся из организма с каловыми массами. Часть билирубина удаляется с мочой в виде уробилина.
Основная функция гемоглобина – перенос кислорода и углекислого газа. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Соединение гемоглобина с кислородом происходит в капиллярах легких. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом носит название карбгемоглобина. Соединение гемоглобина с углекислым газом происходит в капиллярах тканей организма. Это соединение легко распадается. В виде этого соединения переносится 20 % СО2. Оксигемоглобин и карбгемоглобин являются физиологическими соединениями гемоглобина.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц, его можно рассматривать, как депо О2 в мышцах.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. Первые 7-12 нед. внутриутробного развития зародыша его красные кровяные тельца содержат примитивный гемоглобин. У плода содержится гемоглобин F (80 %) или фетальный гемоглобин (от англ. Faetus – плод) гемоглобин. Он обладает более высокой способностью связывать кислород. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови. После рождения гемоглобин F практически полностью заменяется на взрослый – гемоглобин А (от англ. adult – взрослый). В эритроцитах взрослого человека содержатся гемоглобин А (95-98 % Hb A1 и 2-3 % HbA2 ).
Гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином – это патологическое соединение, в норме его не существует, т.к. в атмосфере отсутствует СО. Является прочным соединением. Гемоглобин блокирован в нем угарным газом и не способен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни. При этом более критическим является не концентрация угарного газа, а длительность его вдыхания. Даже предельно низкое содержание СО в воздухе, но при длительном вдыхании, например, во время сна может оказаться летальным. Вследствие своего высокого сродства угарный газ в виде карбоксигемоглобина способен циркулировать в крови предельно долго.
Часто отравления угарным газом возникают у водителей при длительном нахождении в закрытом гараже с включенным двигателем автомобиля. Другим распространенным клинически значимым источником СО являются древесный дым, а также сырой кирпич печей изб и свежий печной лак. Поэтому при первом или после длительного перерыва протапливании таких печей необходимо тщательное проветривание помещения.
Особенностью угарного газа является то, что он не обладает запахом, поэтому отравление развивается незаметно. Часто пострадавший осознает это, когда проявляется миорелаксирующее (расслабление скелетной мускулатуры) действие угарного газа, при этом человек не может самостоятельно покинуть помещение.
Первая помощь при отравлении угарным газом. Пострадавшего следует переместить на свежий воздух. Следует учитывать, что при значительном отравлении сохранность самостоятельного дыхания не снимает необходимости проведения дальнейших действий по оказанию помощи. Наиболее оптимальным будет подача воздуха с повышенным содержание О2, например, из кислородной подушки. При отсутствии таковой – произвести искусственное дыхание. Во время искусственного дыхания в легкие потерпевшего воздух нагнетается под давлением, большим атмосферного.
При этом парциальное давление О2 в таком воздухе оказывается большим, чем в норме, что способствует его большему растворению в крови, а также лучшему вытеснению угарного газа из связи с гемоглобином. Если же пострадавший будет дышать самостоятельно, парциальное давление О2 во вдыхаемом воздухе окажется меньшим (примерно, 100 мм рт.ст.), что окажется недостаточным для вытеснения из карбоксигемоглобина угарного газа, т. к. сродство Нb к СО значительно выше, чем О2. В дальнейшем пострадавший должен быть доставлен в больницу.
При воздействии на гемоглобин экзогенных сильных окислителей происходит окисление железа гема с переходом его в 3-х валентную форму. В результате этого образуется метгемоглобин, который не способен присоединять ни О2, ни СО2. В результате окисления гемоглобин прочно удерживает кислород и теряет способность отдавать его тканям, что может привести к гибели организма.
К подобным сильным окислителем относятся нитраты и нитриты, содержащиеся, например, в химических удобрениях, также опасность представляют пероксиды, нитрокраски, анилиновые красители и ряд других веществ бытовой химии. В норме ежедневно около 0,5 % всего гемоглобина превращается в метгемоглобин, но затем она снова восстанавливается в гемоглобин специальным ферментом метгемоглобинредуктазой. Встречаются наследственные метгемоглобинемии, когда снижена активность метгемоглобинредуктазы в эритроцитах, что вызывает кислородное голодание. Метгемоглобин, также как карбоксигемоглобин, относится к группе патологических соединений гемоглобина.
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гем – это комплексное соединение протопорфирина ІX с железом. Он крайне неустойчив и легко превращается либо в гематин с окислением двухвалентного железа до трехвалентного и присоединением к последнему ОН, либо в гемин, содержащий вместо ОН- ионизированнный хлор. Структура гема идентична для гемоглобина всех видов животных. Различия в свойствах гемоглобина обусловлены различиями белкового компонента. Как известно, молекула гемоглобина представляет собой тетрамер, состоящий из двух пар полипептидных цепей, каждая из которых соединена с гемом. Совокупность четырех попарно одинаковых полипептидных цепей образует белковую часть молекулы гемоглобина – глобин.
ГЕМОГЛОБИН, ЕГО СОСТАВ И ЗНАЧЕНИЕ
Гемоглобин (от греческого haema – кровь и латинского glomus – шарик) относится к числу важнейших дыхательных белков, осуществляющих транспорт кислорода от легких к тканям, а также косвенно участвующих в переносе углекислоты. Гемоглобин – основной компонент эритроцитов крови всех позвоночных и некоторых беспозвоночных животных. В каждом эритроците содержится около 280 млн. молекул гемоглобина. Гемоглобин – сложный протеин, относится к классу так называемых хромопротеидов (гемопротеинов), состоит из железосодержащих групп гема и белкового остатка глобина. На долю гема приходится 4%, и на белковую часть – 96%. Молекулярная масса гемоглобина составляет 64 500 Д.
Динамическое взаимодействие гема с глобином придает гемоглобину уникальные свойства, необходимые для обратимого процесса транспорта кислорода.
В крови взрослого человека содержится в основном НbА (95-98%), а
также НbА2 (2-2,5%), HbF (0,1-2%). На протяжении всей жизни соотношение
НbА и НbА2 в норме составляет 30:1. Молекула НbА включает две α- и две β-полипептидные цепи. В настоящее время полностью определена первичная структура глобиновых цепей молекулы НbА. α – и β -цепи отличаются как по числу, так и по составу аминокислот; α -цепи состоят из 141 аминокислотного остатка, β -цепи – из 146 аминокислотных остатков, связанных в генетически определенной последовательности. В целом в составе молекулы гемоглобина содержится 574 аминокислотных остатка.
Кроме нормальных типов гемоглобина, существуют аномальные гемоглобины, обусловленные различными генными мутациями на уровне структурных или регуляторных генов, управляющих синтезом полипептидных цепей. Аномальные гемоглобины отличаются своими физико-химическими свойствами, структурой глобиновой части молекулы. В настоящее время установлено более 200 аномальных гемоглобинов.
Внутри эритроцита имеются определенные особенности расположения гемоглобина. Ближе к мембране молекулы гемоглобина располагаются в строго перпендикулярном направлении, что облегчает взаимодействие гемоглобина с кислородом. В центре эритроцита обнаружено более хаотическое расположение его молекул. Гиалоплазма содержит многочисленные гранулы гемоглобина размером около 4-5 нм.
У мужчин содержание гемоглобина в среднем составляет 130-160 г/л, у женщин- 120-140 г/л.
Эритроциты, нормально насыщенные гемоглобином, получили название нормохромных, со сниженным количеством – гипохромных, а с повышенным содержанием гемоглобина — гиперхромных.
Важнейшими соединениями гемоглобина являются оксигемоглобин и восстановленный (редуцированный) гемоглобин. В составе этих соединений гемоглобина сохраняется двухвалентное железо, а следовательно, не изменяется способность гемоглобина к связи с О2.
При воздействии на гемоглобин окислителей (перекисей, супероксидного анион-радикала, нитритов, нитропроизводных органических веществ — хининов) происходит истинное окисление гемоглобина с отнятием электрона, превращением железа гемоглобина из двухвалентного в трехвалентное и соответствующими изменениями центральной части геминовой группы. В связи с этим образуется метгемоглобин, который не способен вступать в обратимую реакцию с О2 и обеспечивать его транспорт.
Из тканей различных органов, особенно кишечника, постоянно поступают в кровь вещества, вызывающие образование метгемоглобина в условиях нормы в очень небольших количествах. Это связано с наличием в эритроцитах антиоксидантов, в частности системы глютатиона, аскорбиновой кислоты, препятствующих образованию метгемоглобина или обеспечивающих его восстановление при участии фермента НАД-Н-метгсмоглобинредуктазы.
В условиях патологии при поступлении в кровь значительного количества метгемоглобинобразователей возникает недостаточность антиоксидантной системы эритроцитов, что приводит к чрезмерному образованию метгемоглобина и отравлению организма.
Если количество метгемоглобина в крови превышает 50% общего количества гемоглобина, то возникает тяжелая гемическая гипоксия, обусловленная недостаточностью транспорта О2 эритроцитами, и угроза летального исхода отравления. Метгемоглобин может быть быстро восстановлен в гемоглобин при помощи различных органических и неорганических восстановителей (аскорбиновой кислоты, глютатиона, гидросульфита и др.) лишь in vitro. Между тем in vivo эти средства непригодны либо из-за медленного проникновения их в эритроциты или вследствие их ядовитости.
Восстановление метгемоглобина в гемоглобин в эритроцитах происходит в процессе ферментативных реакций с участием дегидрогеназ и соответствующих субстратов – молочной кислоты, глюкозы, глюкозо-6-фосфата.
Карбоксигемоглобин– соединение гемоглобина с угарным газом — окисью углерода (СО). Закономерности насыщения гемоглобина окисью углерода такие же, что и для насыщения гемоглобина кислородом. Разница заключается в том, что сродство СО к гемоглобину в 300 раз выше, чем О2 к гемоглобину; распад карбоксигемоглобина происходит в 10 000 раз медленнее, чем оксигемоглобина.
Высокое сродство гемоглобина к СО обусловливает высокую ядовитость угарного газа. Примесь даже 0,1% СО в окружающем воздухе приводит к тому, что почти 80% гемоглобина оказывается связанным с угарным газом и выключается из функции переноса кислорода.
Миоглобин– вещество, близкое по структуре гемоглобину, находится в мышцах (миогемоглобин). В большом количестве он содержится в сердечной мышце, особенно в сердце животных, способных долго находиться под водой — тюленей, дельфинов, китов. Связывая О2, миоглобин создает некоторый его запас, своеобразное депо кислорода, который используется при снижении кислородной емкости крови, при развитии гипоксии различного происхождения. За счет миоглобина осуществляется также обеспечение кислородом работающих мышц. При сокращении мышц наблюдаются сдавление капилляров, нарушение кровотока с развитием гипоксического состояния в мышцах. Однако благодаря наличию кислорода, связанного с миоглобином, в течение некоторого времени мышечные волокна снабжаются кислородом. Касаясь структурных особенностей миоглобина, следует отметить, что структура простетической группы его такая же, как и у гемоглобина; между тем белковая часть обладает меньшей молекулярной массой (около 17 000 Д) и включает 153 аминокислотных остатка. Миоглобин обладает большим сродством к кислороду, присоединяет около 14% общего количества кислорода в организме. Сродство миоглобина к окиси углерода значительно меньше, чем у гемоглобина.
Главными функциями гемоглобина являются дыхательная и буферная. Выполнение указанных функций гемоглобином возможно лишь при сохранении целостности эритроцитов, так как при гемолизе эритроцитов и выходе гемоглобина в плазму крови он быстро выводится из организма за счет фагоцитоза клетками мононуклеарной фагоцитирующей системы, а также в силу быстрого удаления через почки.
Один моль гемоглобина может связать до 4 молей кислорода, а 1 г гемоглобина может связать 1,345 мл кислорода. Кислородная емкость крови — это максимальное количество кислорода, которое может быть связано 100 мл крови. Насыщение гемоглобина кислородом составляет 96-98%.
Связывание кислорода происходит в процессе так называемой оксигенации, а не истинного окисления. Железо в оксигемоглобине остается двухвалентным. Кислород, соединяясь с гемом первой α-цепи, вызывает конформационные перестройки в геме, что облегчает присоединение кислорода ко второй α-цепи. При этом возникает вновь разрыв двух солевых мостиков между α1 и α2- субъединицами с выделением протонов. Конформационные перестройки α -цепей в процессе оксигенации приводят к изменению положения валина в β -цепях и освобождению места для присоединения О2. Оксигенация β-цепей также сопровождается разрывом солевых мостиков между α-β и β-β -цепями с выделением протонов и переходом всей молекулы в оксиконформацию.
При выполнении дыхательной функции молекула гемоглобина изменяет свои размеры подобно дышащей грудной клетке. Это послужило основанием для того, чтобы назвать гемоглобин «дышащей молекулой, или молекулярными легкими».
Соотношение между количеством гемоглобина и оксигемоглобина определяется в значительной степени парциальным давлением кислорода в крови, хотя при этом и не соблюдается линейная зависимость. Это соотношение выражается в виде кривой диссоциации оксигемоглобина.
Участие гемоглобина в регуляции рН крови (буферная функция) связано с его ролью в транспорте кислорода и углекислого газа. Следует отметить наличие в организме гемоглобиновой и оксигемоглобиновой буферных систем.
Дата добавления: 2014-01-20; Просмотров: 4059; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
Источник
