Соединение гемоглобина с кислородом является химическая потому что

Гемоглобин и его соединения
Гемоглобин – особый белок хромопротеида, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. У мужчин в крови содержится в среднем 130–160 г/л гемоглобина, у женщин – 120–150 г/л.
Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется, т. е. железо остается двухвалентным. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом, носит название карбгемоглобина. Это соединение также легко распадается. В виде карбгемоглобина переносится 20% углекислого газа.
В особых условиях гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином. Карбоксигемоглобин является прочным соединением. Гемоглобин блокирован в нем угарным газом и неспособен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни.
При некоторых патологических состояниях, например, при отравлении сильными окислителями (бертолетовой солью, перманганатом калия и др.) образуется прочное соединение гемоглобина с кислородом – метгемоглобин, в котором происходит окисление железа, и оно становится трехвалентным. В результате этого гемоглобин теряет способность отдавать кислород тканям, что может привести к гибели человека.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. У плода содержится гемоглобин F. В эритроцитах взрослого человека преобладает гемоглобин А (90%). Различия в строении белковой части определяют сродство гемоглобина к кислороду. У фетального гемоглобина оно намного больше, чем у гемоглобина А. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови.
Ряд заболеваний связан с появлением в крови патологических форм гемоглобина. Наиболее известной наследственной патологией гемоглобина является серповидноклеточная анемия. Форма эритроцитов напоминает серп. Отсутствие или замена нескольких аминокислот в молекуле глобина при этом заболевании приводит к существенному нарушению функции гемоглобина.
В клинических условиях принято вычислять степень насыщения эритроцитов гемоглобином. Это так называемый цветовой показатель. В норме он равен 1. Такие эритроциты называются нормохромными. При цветовом показателе более 1,1 эритроциты гиперхромные, менее 0,85 – гипохромные. Цветовой показатель важен для диагностики анемий различной этиологии.
Следующая глава >
Похожие главы из других книг:
Гемоглобин
Обычно исследуют капиллярную кровь, которую получают путем укола иглой-скарификатором в мякоть IV пальца левой руки (реже – мочки уха) или венозную кровь из локтевой вены (при работе на автоматических анализаторах).За идеальную норму принимают концентрацию
Гликолизированный гемоглобин
Гликолизированный гемоглобин (HbAlc) – используется как показатель риска развития осложнений сахарного диабета. В соответствии с рекомендациями ВОЗ этот тест признан оптимальным и необходимым для контроля за качеством лечения
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
Гемоглобин
Снижение содержания гемоглобина говорит об анемии. Она может развиться в результате потери гемоглобина при кровотечениях, при заболеваниях крови, сопровождающихся разрушением эритроцитов. Низкий гемоглобин также возникает вследствие переливания
Гликозилированный гемоглобин
Это биохимический показатель крови, отражающий среднее содержание сахара в крови за длительный период времени (до 3 месяцев), в отличие от исследования глюкозы крови, которое дает представление об уровне глюкозы крови только на момент
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).
NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
«ГЕМОГЛОБИН»
Вымойте говяжью печень, нарежьте ее ломтиками и слегка обжарьте на масле, чтобы она оставалась полусырой. Затем положите на ломтик черного хлеба и посыпьте сверху тертым сыром. На сыр положите ломтик сала и плотно, штука к штуке, уложите поверх сала маслины,
ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Фосфорорганические соединения снижают активность холинэстеразы в организме, что способствует накоплению ацетилхолина. Самый распространенный из фосфорорганических пестицидов – тиофос – представляет собой прозрачную бесцветную
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Кроме желудочно-кишечного тракта, для хлорорганических пестицидов «входными воротами» служат дыхательные пути и слизистые оболочки. Большинство этих веществ являются жирорастворимыми, поэтому они могут накапливаться в жировой ткани
Гемоглобин
Гемоглобин (ИЬ) составляет 95% от белков эритроцита. Отсутствие ядра в эритроците предоставляет место для большего количества молекул гемоглобина. Это означает, что клетка может нести больше кислорода. Дело в том, что кислород очень плохо растворяется в плазме
Как увеличить гемоглобин
Игнатьева Татьяна Во время беременности вы можете столкнуться и с так называемой «физиологической анемией», когда уровень гемоглобина опускается до 100 мг% (в норме для женщин 120–140 мг%). Это происходит из-за увеличения объёма крови, усиления
Фенольные соединения
Эти вещества содержат ароматические кольца с гидроксильной группой, а также их функциональные производные. Фенольные соединения, в ароматическом кольце которых имеется более одной гидроксильной группы, называют полифенолами.Большинство
Скелет и его соединения
Скелет (от греч. skeleton – высохший, высушенный) – формообразующая конструкция тела – выполняет множество функций. Главными из них являются опора, защита, преодоление силы тяжести. Кости представляют собой систему рычагов, которые под влиянием
 Методы исследования газов крови. Впервые И. М. Сеченову в 1858 г. удалось при помощи сконструированного им прибора извлечь из крови газы и исследовать их. Прибор, названный им абсорбциометром, был основан на том, что при помощи ртутного насоса над кровью создавался вакуум, куда и поступали выходящие при этом из крови газы. После нескольких повторных извлечений все газы крови из нее выкачивались. Извлеченные таким образом газы затем исследовались.
Методы исследования газов крови. Впервые И. М. Сеченову в 1858 г. удалось при помощи сконструированного им прибора извлечь из крови газы и исследовать их. Прибор, названный им абсорбциометром, был основан на том, что при помощи ртутного насоса над кровью создавался вакуум, куда и поступали выходящие при этом из крови газы. После нескольких повторных извлечений все газы крови из нее выкачивались. Извлеченные таким образом газы затем исследовались.
Большинство современных приборов основано на том же принципе, что и прибор И. М. Сеченова. В некоторых приборах применяются химические вытеснители. Добавляя к крови раствор виннокаменной кислоты, достигают вытеснения углекислоты. Кислород же вытесняется путем вливания в кровь раствора железосинеродистого калия. Вытесненные газы собирают в специальные приемники и исследуют.
Рис. ОБРАЗОВАНИЕ ОКСИГЕМОГЛОБИНА ПРИ РАЗНЫХ ПАРЦИАЛЬНЫХ ДАВЛЕНИЯХ КИСЛОРОДА
В клинике и в физиологических лабораториях широко применяется прибор оксигемометр, который позволяет определить содержание кислорода в крови в целом организме без взятия крови и ее химического анализа. С помощью этого прибора, основанного на изучении спектра крови, можно установить степень насыщения кислородом крови, протекающей через мочки уха человека.
Связывание, перенос и отдача кислорода
Кислород и углекислый газ находятся в крови в физически растворенном состоянии (растворение газов в жидкости называется абсорбцией) и в химически связанном виде.
Из 100 мл крови можно выделить только 20 мл кислорода; между тем в физически растворенном состоянии в 100 мл крови может находиться только 0,3 мл кислорода. Так как количество кислорода, содержащегося в 100 мл крови, во много раз больше, чем может находиться в растворенном состоянии, то ясно, что кислород в основном находится в химически связанном виде.
Веществом, вступающим в химическую связь с кислородом, является гемоглобин. Кислород из воздуха диффундирует в плазму крови, а из плазмы поступает в эритроциты и вступает в химическую связь с гемоглобином. Гемоглобин при этом превращается в оксигемоглобин; 1 г гемоглобина может связать 1,34 мл кислорода.
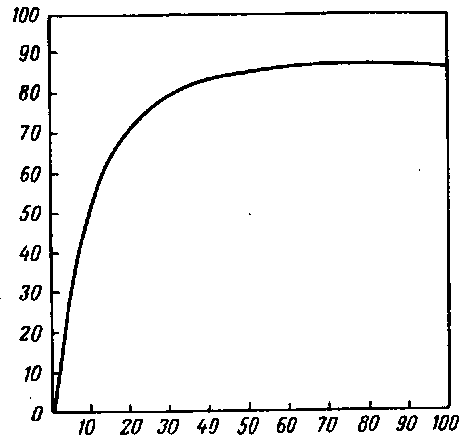
Превращение гемоглобина в оксигемоглобин, т. е. степень насыщения гемоглобина кислородом, связано с величиной парциального давления кислорода, но зависимость эта не прямо
пропорциональная. Гемоглобин обладает особым свойством, имеющим очень важное биологическое значение: он может энергично вступать в соединение с кислородом даже при его незначительном парциальном давлении. Приводимые ниже цифры дают представление об этом свойстве гемоглобина.
Давление кислорода в мм рт. ст.
10
20
40
100
Процент оксигемоглобина
55
72
84
92
Из этих данных следует, что гемоглобин энергично соединяется с кислородом уже при его низком парциальном давлении;с увеличением парциального давления кислорода возрастает степень насыщения им гемоглобина, но чем выше становится давление кислорода, тем медленнее нарастает степень образования оксигемоглобина. Так, при парциальном давлениикислорода, равном 10 мм рт. ст., 55% гемоглобина превращается в оксигемоглобин, а при давлении 40 мм рт. ст. 84% гемоглобина насыщены кислородом. При дальнейшем увеличении давления степень насыщения гемоглобина кислородомвозрастает более медленно.
Это взаимоотношение между величиной парциального давления кислорода и степенью насыщения гемоглобина кислородом выражено кривой, которая приведена на рис.
В альвеолярном воздухе парциальное давление кислорода равно 100—110 мм рт. ст.. чего вполне достаточно для того, чтобы 97% гемоглобина артериальной крови насытились кислородом.
По оси абсцисс отложено давление кислорода в миллиметрах ртутного столба, по оси ординат — процент насыщения гемоглобина кислородом.
При таком насыщении гемоглобина кислородом в кровь поступает около 1000 мл кислорода. Это следует из уже известных нам данных: в 100 мл крови находится 420 мл кислорода, общее количество крови в среднем равно 5000 мл, следовательно, в кровь может поступить около 1000 мл кислорода. При мышечной работе потребность в кислороде возрастает и равняется 4000—5000 мл в минуту. Доставка необходимого количества кислорода обеспечивается за счет усиления кровообращения, в результате чего кровь несколько раз в течение минуты совершает свой кругооборот. Артериальная кровь, насыщенная в легких кислородом, идет в капиллярную сеть большого круга кровообращения, где оксигемоглобин отдает тканям кислород. Оксигемоглобин, отдавший кислород, называется восстановленным гемоглобином. В артериальной крови почти весь гемоглобин превращен в оксигемоглобин, а в венозной крови, оттекающей от капилляров большого круга кровообращения, преобладает восстановленный гемоглобин.
Что же способствует отдаче кислорода в капиллярах? В переходе кислорода из крови к тканям решающее значение имеет разность напряжений кислорода в артериальной крови и в тканях. Кислород из крови поступает в тканевую жидкость и из нее в клетки, где принимает участие в окислительных процессах.
Это возможно потому, что напряжение кислорода, растворенного в артериальной крови, протекающей через капилляры, равно 100—110 мм рт. ст., в тканевой жидкости — 20— 40 мм рт. ст., а в клетках свободного кислорода нет. Разность напряжения растворенного кислорода, равная 70—80 мм рт. ст., обеспечивает энергичный переход кислорода из плазмы крови в тканевую жидкость.
Оксигемоглобин, который является нестойким соединением, отдает кислород в плазму; в силу разности напряжения растворенный кислород переходит в тканевую жидкость и оттуда в клетку, где вступает в окислительные процессы.
Помимо разности в напряжении растворенного кислорода, настепень отдачи кислорода оксигемоглобином сильно влияет величина напряжения углекислого газа, растворенного в крови. Специальными исследованиями доказано, что чем выше напряжение углекислого газа, растворенного в крови, тем слабее становится связь гемоглобина с кислородом, т. е. тем больше кислорода освобождается.
В капиллярах большого круга кровообращения наряду с переходом кислорода из крови в тканевую жидкость происходит и переход углекислого газа из тканевой жидкости в кровь. Количество углекислого газа растет и его напряжение в крови возрастает, а это обстоятельство вызывает ослабление связи гемоглобина с кислородом и способствует больнему освобождению кислорода.
В легких же происходит отдача углекислого газа; его напряжение в крови падает и благодаря этому сродство гемоглобина с кислородом повышается, т.е. гемоглобин начинает более энергично соединяться с кислородом и превращаться в оксигемоглобин.
Кроме концентрации углекислого газа, на прочность связи гемоглобина с кислородом влияет также реакция крови. Незначительный сдвиг реакции в кислую сторону влечет за собой усиление отдачи кислорода. Такой сдвиг реакции происходит в мышцах, где образовавшаяся во время работы молочная кислота поступает в кровь. При этом освобождение кислорода на крови и его переход в ткани происходят более усиленно, что полностью соответствует во время работы возрастающей потребности мышц в больших количествах кислорода.
Напрочность связи гемоглобина с кислородом влияет также температура. При повышенной температуре связь ослабевает, при пониженной — увеличивается. Связывание и перенос углекислоты. В 100 мл крови может раствориться 3 мл углекислого газа, между тем из такого количества крови можно извлечь 50 мл этого газа. Следовательно, углекислый газ, как и кислород, находится в крови не только в виде физического раствора, но и в химически связанном виде. Угольная кислота в крови в основном соединена со щелочамии образует двууглекислые соли, или бикарбонаты. Углекислота находится в крови преимущественно в виде бикарбонатовнатрия и калия.
Кроме этих солей, в переносе углекислого газа участвует и гемоглобин.
Еще в конце прошлого века И. М. Сеченов показал, что гемоглобин участвует в переносе углекислого газа. Им было показано, что гемоглобин в капиллярах тканей вступает в химическую связь с углекислым газом и отдает его в легких.
Связь углекислого газа с гемоглобином является непрочной и легко нарушается.
Для поступления углекислого газа в кровь и перехода из крови в альвеолярный воздух требуется наличие разности его давления.
В тканевой жидкости напряжение растворенного углекислого газа составляет около 60 мм рт. ст., а в артериальной крови — 40 мм рт. ст.; следовательно, имеется достаточная разность, и углекислый газ диффундирует в кровь. В венозной крови его напряжение составляет 47 мм рт. ст., а его парциальное давление в альвеолярном воздухе — 40 мм рт. ст. Такая разность давлений вполне достаточна для перехода углекислого газа в альвеолярный воздух.
Большое значение в переходе углекислого газа из крови в альвеолярный воздух имеет процесс образования оксигемоглобина.
Мы уже знаем, что в легких почти весь гемоглобин переходит в оксигемоглобин. Образовавшийся оксигемоглобин способствует усиленному выделению углекислого газа. В капиллярах же тканей оксигемоглобин переходит в восстановленный гемоглобин, а восстановленный гемоглобин способствует усиленному поглощению углекислого газа.
На процесс освобождения углекислого газа очень большое влияние оказывает фермент карбоангидраза. Этот фермент в 1500—2000 раз ускоряет расщепление угольной кислоты на воду и углекислый газ, который и поступает в альвеолярный воздух.
Этот же фермент в капиллярах тканей способствует образованию угольной кислоты.
Следовательно, карбоангидраза в капиллярах тканей содействует образованию угольной кислоты, а в капиллярах легких — ее расщеплению.
Статья на тему Роль крови в дыхании
Первичная разновидность гемоглобина появляется еще у эмбриона на первых неделях беременности. По мере развития плода, а также после рождения ребенка, образуются разные физиологические виды гемоглобина — это связано с разными условиями и задачами, которые стоят перед кроветворной системой и гемоглобином в разные моменты развития человеческой жизни. Помимо физиологических, еще имеются аномальные виды гемоглобина, которые образуются в результате мутаций генов, ответственных за синтез гемоглобина.
Виды гемоглобина
Эмбриональный
С первых недель развития эмбриона в эмбриональном мешке образуются первые виды гемоглобина — Gover 1 и Gover 2. В норме к 12 недели развития плода эмбриональный гемоглобин полностью замещается фетальным.
Фетальный
Плодный гемоглобин (HbF) является следующим этапом в усовершенствовании гемоглобина. Он является основным видом на протяжении всей беременности и имеет более высокое сродство к кислороду, чем . К моменту родов его доля от общего количества гемоглобина составляет 50-80%. После рождения фетальный гемоглобин ребенка начинает усиленно распадаться и постепенно заменяется взрослым гемоглобином (HbA).
Именно ускоренный распад фетального гемоглобина обеспечивает физиологическую желтуху новорожденных, а также резкое снижение уровня гемоглобина в крови у детей в возрасте 1-2 месяцев.
Взрослый
В первые месяцы жизни ребенка взрослый вид гемоглобина (HbA) полностью замещает плодный (HbF) и сохраняется на протяжении всей жизни человека. Имеют разные виды гемоглобина HbA:
- HbA1 — 98% от всего количества гемоглобина в крови
- HbA2 — 2%
- HbA3 — может встречаться в старых эритроцитах
- HbA1c — гликированный гемоглобин А
 Виды гемоглобинов и цепи глобина в их составе
Виды гемоглобинов и цепи глобина в их составеПатологические виды Hb
Мутации генов, ответственных за синтез альфа- и бета-цепей белка глобина, приводят к появления аномальных видов гемоглобина. В настоящее время известно более 100 аномальных гемоглобинов. В большинстве известных случаев способность гемоглобина переносить кислород и углекислый газ сохранена.
Сюда же можно отнести и гемоглобинопатии (например, серповидноклеточная анемия) и талассемии.
Формы гемоглобина
В процессе жизнедеятельности гемоглобин может связываться не только с кислородом и углекислым газом, но и некоторыми другими химическими элементами, которые непосредственным образом влияют на возможность гемоглобина выполнять свои функции.
 Газообмен в легких: окси-, дезокси- и карбгемоглобин
Газообмен в легких: окси-, дезокси- и карбгемоглобин- Оксигемоглобин — так называется соединение гемоглобина с кислородом. Обозначается — HbO2. Именно такой формой гемоглобина насыщена артериальная кровь от легких и до капилляров тканей.
- Миоглобин — мышечная разновидность гемоглобина, которая содержится в скелетной мускулатуре и миокарде. Он является не переносчиком кислорода, а его депо на случай гипоксии. При снижении кислородной емкости крови, а также при гипоксии мышечной ткани при повышенной нагрузке, миоглобин начинает отдает тканям свой кислород. Миоглобин — это резерв кислорода для сердца и скелетных мышц при недостаточном его поступлении с обычным гемоглобином крови.
- Дезоксигемоглобин (HbH) — это «пустой» гемоглобин, который отдал кислород в тканях и не присоединил углекислый газ или, наоборот, отдал углекислый газ в легких, но не присоединил кислород. В подавляющем большинстве — это короткая промежуточная стадия в тканях или легких. В венозной или артериальной крови такой гемоглобин тоже встречается, но в небольшом количестве.
- Карбгемоглобин (HbCO2) — соединение гемоглобина с углекислым газом. Это соединение содержится в венозной крови, т.е. после капиллярной сети тканей и до легких.
- Метгемоглобин (HbOH) — образуется при окислении Fe2+ до Fe3+ под воздействием свободных радикалов, оксида азота, метиленового синего и др. Метгемоглобин утрачивает способность к переносу кислорода, поэтому повышение его в крови опасно для жизни.
- Цианметгемоглобин (HbCN) — патологическая форма гемоглобина, образующаяся в крови при присоединении цианидов (CN-) к метгемоглобину. Соединение цианидов с метгемоглобином применяется при лечении отравлений синильной кислотой.
- Карбоксигемоглобин (HbCO) — патологическая разновидность гемоглобина — очень стойкое соединение с угарным газом. Прочность связи углекислого газа с гемоглобином в 200 раз больше, чем у кислорода. В норме содержание HbCO в крови не должно превышать 1%.
При содержании во вдыхаемом воздухе 0,1% СО, 80% гемоглобина принимает форму карбоксигемоглобина. Если такое воздействие на организм сохранится несколько часов, то это может привести к летальному исходу. У курильщиков уровень карбоксигемоглобина в крови достигает 5-20%.
