Соединение гемоглобина с угарным газом происходит в капиллярах
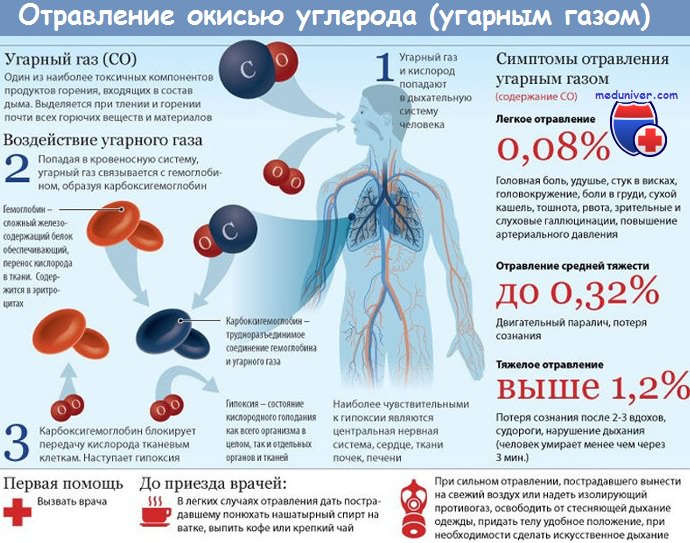
Отравление угарным газом. КарбоксигемоглобинемияКлассическим примером повреждающего действия на кровь с нарушением ее дыхательной функции, обусловленным инактивацией кровяного пигмента — гемоглобина, служит образование карбоксигемоглобина (НbСО) под влиянием оксида углерода. Превращение гемоглобина в НbСО приводит к изменению спектральных характеристик крови, что легло в основу количественного определения его в крови. НbСО образуется в результате взаимодействия оксида углерода (СО) с железом гемоглобина, что лишает его способности к оксигенации, приводит к нарушению транспортной функции и как результат вызывает развитие гемической гипоксии. Появление НbСО служит следствием поступления СО в легкие с вдыхаемым воздухом. Образование НbСО начинается с периферии эритроцитов уже в легочных капиллярах. В дальнейшем с увеличением содержания СО во вдыхаемом воздухе НbСО образуется не только в периферических отделах эритроцита, но и в центральных его отделах. Причем скорость образования НbСО прямо пропорциональна величине концентрации СО во вдыхаемом воздухе, а максимум его в крови определяется временем контакта. Способность гемоглобина связывать 02 и СО одинакова при условии, что 1 г гемоглобина может связывать 1,33—1,34 мл 02. Эта зависимость носит название константы Хюфнера. Вместе с тем сродство гемоглобина к СО в 250—300 раз больше, чем к 02. Примечательно, что оболочка эритроцитов служит своего рода защитным барьером при образовании НbСО, так как во взвеси эритроцитов этого деривата гемоглобина образуется на 20 % меньше, чем в растворе гемоглобина. Валентность железа в НbСО остается неизмененной, происходит лишь перестройка связей Fe2+. Все непарные электроны участвуют в образовании НbСО. Параллельно с образованием связей между СО и Fe2+ изменяется характер связи железа с глобином и порфирином. Она теряет свой ионный характер и превращается в ковалентную. Взаимодействие СО с Нb02 выражается взаимно сопряженными реакциями. нbо2 + со -> нbсо + о2
Скорость этих реакций и образование НЬСО определяются парциальным давлением СО и О2 в воздухе. При этом количество образовавшегося НbCO мо пропорционально давлению СО в окружающей среде и обратно пропорционально давлению 02. Несмотря на высокое, как указывалось выше, сродство СО к гемоглобину, ассоциация его с гемоглобином происходит в 10 раз медленнее, чем таковая с 02. Однако при этом диссоциация HbСО протекает в 3600 раз медленнее, чем диссоциация Нb02. По этой причине HbCO очень быстро накапливается в крови даже при сравнительно небольшом содержании СО во вдыхаемом воздухе. Таким образом, помимо выключения части гемоглобина из транспорта кислорода, еще одним патогенетически важным звеном в нарушении дыхательной функции крови на фоне карбоксигемоглобинемии служит замедление диссоциации оксигемоглобина под влиянием НЬСО, что известно под названием эффекта Холдена. Так в физиологических условиях повышение концентрации С02 в крови способствует ускоренному отщеплению 02 от НЬ02, при наличии НЬСО этот сбалансированный процесс нарушается. Принято считать, что суть эффекта Холдена заключается в том, что при взаимодействии СО с гемоглобином поступивший в кровь СО соединяется только с 3 из 4 атомов железа в молекуле гемоглобина, тогда как с 4-м атомом железа соединяется 02, сродство которого к этому атому железа резко возрастает, что, естественно, затрудняет диссоциацию оксигемоглобина. Еще одним причинным фактором угнетения диссоциации Нb02 под влиянием СО служит снижение уровня промежуточного метаболита 2,3-дифосфоглицерата, который образуется в процессе реакции гликолиза. 2,3-Дифосфоглицерат обладает способностью усиливать процесс диссоциации НbСО за счет вызываемых им конформационных изменений гемоглобина, поэтому естественно, что дефицит этого метаболита косвенно тормозит высвобождение 02 из Нb02. Итак, основным пусковым механизмом развития специфической гемической гипоксии при отравлении СО является образование НbСО, который утрачивает способность переносить кислород в сочетании с угнетающим влиянием на процесс диссоциации Нb02. Неопровержимое доказательство того, что первопричиной развития СО-интоксикации является карбоксиге-моглобинемия, — прямая зависимость между уровнем НbСО в крови и тяжестью интоксикации. Так, по данным V.E.Henderson, при содержании НbСО в крови, равном 10 %, отмечена лишь одышка при физическом напряжении, при 40—50 % НbСО появляются явные признаки интоксикации: головная боль, помрачение сознания вплоть до его потери, концентрация НbСО в крови свыше 60 % ведет к летальному исходу. Во всяком случае у людей, впадающих в коматозное состояние или погибающих от острого отравления СО, содержание НbСО, как правило, не менее 50 %. Однако не всегда прослеживается прямая связь между содержанием в крови НbСО и тяжестью отравления. Известны случаи, когда тяжелая форма отравления развивалась уже при 20 % НbСО и, наоборот, при 60 % НbСО встречаются легкие формы отравления. Во многом это объясняется достаточно большой индивидуальной чувствительностью к СО, которую связывают с генетическим фактором. – Также рекомендуем “Диагностика карбоксигемоглобинемии. Изменения красной крови при карбоксигемоглобинемии” Оглавление темы “Алкилирующие яды. Отравление угарным газом”: |
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
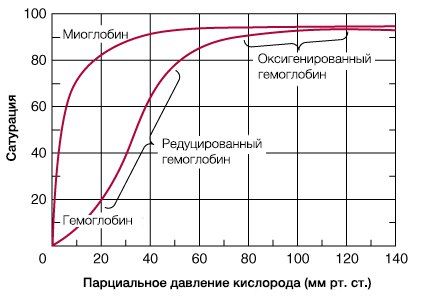
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.

При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
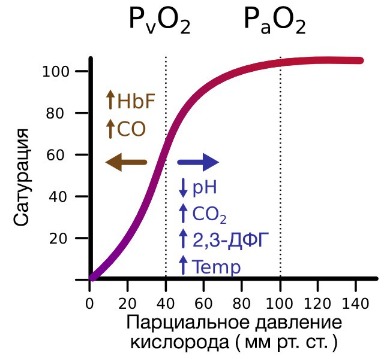
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
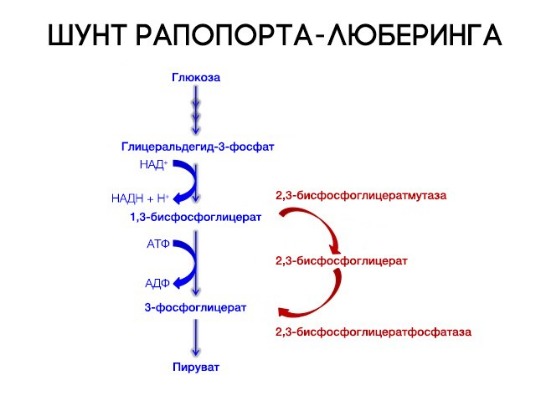
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
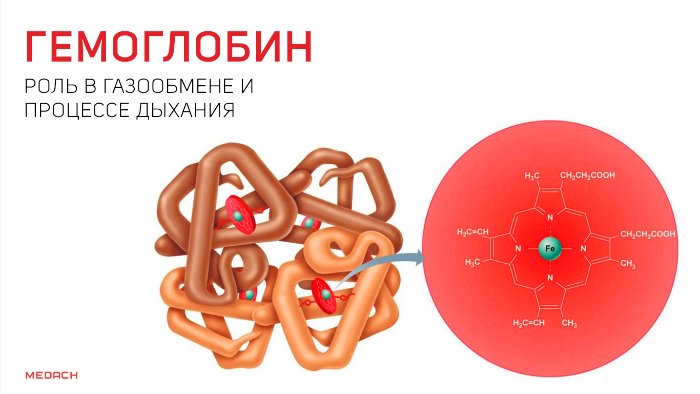
Гемоглобин (Нв) – основной компонент эритроцитов, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. По химической природе он относится к хромопротеидам. У мужчин в крови содержится в среднем 130-160 г/л гемоглобина, у женщин – 120-150 г/л. Молекулярная масса гемоглобина составляет около 60000 Да. Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода.
Гем содержит двухвалентное железо, которое играет ключевую роль в деятельности гемоглобина, являясь его активной (простетической) группой. Гемоглобин синтезируется эритро- и нормобластами костного мозга. Для нормального синтеза гемоглобина необходимо достаточное поступление железа с пищей. При разрушении эритроцитов гемоглобин, после отщепления гема, превращается в билирубин – желчный пигмент, который поступает, в основном, в кишечник в составе желчи, где превращается в стеркобилин, выводящийся из организма с каловыми массами. Часть билирубина удаляется с мочой в виде уробилина.
Основная функция гемоглобина – перенос кислорода и углекислого газа. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Соединение гемоглобина с кислородом происходит в капиллярах легких. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом носит название карбгемоглобина. Соединение гемоглобина с углекислым газом происходит в капиллярах тканей организма. Это соединение легко распадается. В виде этого соединения переносится 20 % СО2. Оксигемоглобин и карбгемоглобин являются физиологическими соединениями гемоглобина.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц, его можно рассматривать, как депо О2 в мышцах.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. Первые 7-12 нед. внутриутробного развития зародыша его красные кровяные тельца содержат примитивный гемоглобин. У плода содержится гемоглобин F (80 %) или фетальный гемоглобин (от англ. Faetus – плод) гемоглобин. Он обладает более высокой способностью связывать кислород. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови. После рождения гемоглобин F практически полностью заменяется на взрослый – гемоглобин А (от англ. adult – взрослый). В эритроцитах взрослого человека содержатся гемоглобин А (95-98 % Hb A1 и 2-3 % HbA2 ).
Гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином – это патологическое соединение, в норме его не существует, т.к. в атмосфере отсутствует СО. Является прочным соединением. Гемоглобин блокирован в нем угарным газом и не способен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни. При этом более критическим является не концентрация угарного газа, а длительность его вдыхания. Даже предельно низкое содержание СО в воздухе, но при длительном вдыхании, например, во время сна может оказаться летальным. Вследствие своего высокого сродства угарный газ в виде карбоксигемоглобина способен циркулировать в крови предельно долго.
Часто отравления угарным газом возникают у водителей при длительном нахождении в закрытом гараже с включенным двигателем автомобиля. Другим распространенным клинически значимым источником СО являются древесный дым, а также сырой кирпич печей изб и свежий печной лак. Поэтому при первом или после длительного перерыва протапливании таких печей необходимо тщательное проветривание помещения.
Особенностью угарного газа является то, что он не обладает запахом, поэтому отравление развивается незаметно. Часто пострадавший осознает это, когда проявляется миорелаксирующее (расслабление скелетной мускулатуры) действие угарного газа, при этом человек не может самостоятельно покинуть помещение.
Первая помощь при отравлении угарным газом. Пострадавшего следует переместить на свежий воздух. Следует учитывать, что при значительном отравлении сохранность самостоятельного дыхания не снимает необходимости проведения дальнейших действий по оказанию помощи. Наиболее оптимальным будет подача воздуха с повышенным содержание О2, например, из кислородной подушки. При отсутствии таковой – произвести искусственное дыхание. Во время искусственного дыхания в легкие потерпевшего воздух нагнетается под давлением, большим атмосферного.
При этом парциальное давление О2 в таком воздухе оказывается большим, чем в норме, что способствует его большему растворению в крови, а также лучшему вытеснению угарного газа из связи с гемоглобином. Если же пострадавший будет дышать самостоятельно, парциальное давление О2 во вдыхаемом воздухе окажется меньшим (примерно, 100 мм рт.ст.), что окажется недостаточным для вытеснения из карбоксигемоглобина угарного газа, т. к. сродство Нb к СО значительно выше, чем О2. В дальнейшем пострадавший должен быть доставлен в больницу.
При воздействии на гемоглобин экзогенных сильных окислителей происходит окисление железа гема с переходом его в 3-х валентную форму. В результате этого образуется метгемоглобин, который не способен присоединять ни О2, ни СО2. В результате окисления гемоглобин прочно удерживает кислород и теряет способность отдавать его тканям, что может привести к гибели организма.
К подобным сильным окислителем относятся нитраты и нитриты, содержащиеся, например, в химических удобрениях, также опасность представляют пероксиды, нитрокраски, анилиновые красители и ряд других веществ бытовой химии. В норме ежедневно около 0,5 % всего гемоглобина превращается в метгемоглобин, но затем она снова восстанавливается в гемоглобин специальным ферментом метгемоглобинредуктазой. Встречаются наследственные метгемоглобинемии, когда снижена активность метгемоглобинредуктазы в эритроцитах, что вызывает кислородное голодание. Метгемоглобин, также как карбоксигемоглобин, относится к группе патологических соединений гемоглобина.