Соединения гемоглобина и их свойства
Гемоглобин и его соединения
Гемоглобин – особый белок хромопротеида, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. У мужчин в крови содержится в среднем 130–160 г/л гемоглобина, у женщин – 120–150 г/л.
Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется, т. е. железо остается двухвалентным. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом, носит название карбгемоглобина. Это соединение также легко распадается. В виде карбгемоглобина переносится 20% углекислого газа.
В особых условиях гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином. Карбоксигемоглобин является прочным соединением. Гемоглобин блокирован в нем угарным газом и неспособен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни.
При некоторых патологических состояниях, например, при отравлении сильными окислителями (бертолетовой солью, перманганатом калия и др.) образуется прочное соединение гемоглобина с кислородом – метгемоглобин, в котором происходит окисление железа, и оно становится трехвалентным. В результате этого гемоглобин теряет способность отдавать кислород тканям, что может привести к гибели человека.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. У плода содержится гемоглобин F. В эритроцитах взрослого человека преобладает гемоглобин А (90%). Различия в строении белковой части определяют сродство гемоглобина к кислороду. У фетального гемоглобина оно намного больше, чем у гемоглобина А. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови.
Ряд заболеваний связан с появлением в крови патологических форм гемоглобина. Наиболее известной наследственной патологией гемоглобина является серповидноклеточная анемия. Форма эритроцитов напоминает серп. Отсутствие или замена нескольких аминокислот в молекуле глобина при этом заболевании приводит к существенному нарушению функции гемоглобина.
В клинических условиях принято вычислять степень насыщения эритроцитов гемоглобином. Это так называемый цветовой показатель. В норме он равен 1. Такие эритроциты называются нормохромными. При цветовом показателе более 1,1 эритроциты гиперхромные, менее 0,85 – гипохромные. Цветовой показатель важен для диагностики анемий различной этиологии.
Следующая глава >
Похожие главы из других книг:
Гемоглобин
Обычно исследуют капиллярную кровь, которую получают путем укола иглой-скарификатором в мякоть IV пальца левой руки (реже – мочки уха) или венозную кровь из локтевой вены (при работе на автоматических анализаторах).За идеальную норму принимают концентрацию
Гликолизированный гемоглобин
Гликолизированный гемоглобин (HbAlc) – используется как показатель риска развития осложнений сахарного диабета. В соответствии с рекомендациями ВОЗ этот тест признан оптимальным и необходимым для контроля за качеством лечения
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
Гемоглобин
Снижение содержания гемоглобина говорит об анемии. Она может развиться в результате потери гемоглобина при кровотечениях, при заболеваниях крови, сопровождающихся разрушением эритроцитов. Низкий гемоглобин также возникает вследствие переливания
Гликозилированный гемоглобин
Это биохимический показатель крови, отражающий среднее содержание сахара в крови за длительный период времени (до 3 месяцев), в отличие от исследования глюкозы крови, которое дает представление об уровне глюкозы крови только на момент
Гемоглобин
Норма: не обнаруживается («ОТРИЦАТЕЛЬНО»).
NB! Положительный результат отражает присутствие свободного гемоглобина или миоглобина в моче. Это результат внутрисосудистого, внутрипочечного, мочевого гемолиза эритроцитов с выходом гемоглобина или повреждения и
«ГЕМОГЛОБИН»
Вымойте говяжью печень, нарежьте ее ломтиками и слегка обжарьте на масле, чтобы она оставалась полусырой. Затем положите на ломтик черного хлеба и посыпьте сверху тертым сыром. На сыр положите ломтик сала и плотно, штука к штуке, уложите поверх сала маслины,
ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Фосфорорганические соединения снижают активность холинэстеразы в организме, что способствует накоплению ацетилхолина. Самый распространенный из фосфорорганических пестицидов – тиофос – представляет собой прозрачную бесцветную
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Кроме желудочно-кишечного тракта, для хлорорганических пестицидов «входными воротами» служат дыхательные пути и слизистые оболочки. Большинство этих веществ являются жирорастворимыми, поэтому они могут накапливаться в жировой ткани
Гемоглобин
Гемоглобин (ИЬ) составляет 95% от белков эритроцита. Отсутствие ядра в эритроците предоставляет место для большего количества молекул гемоглобина. Это означает, что клетка может нести больше кислорода. Дело в том, что кислород очень плохо растворяется в плазме
Как увеличить гемоглобин
Игнатьева Татьяна Во время беременности вы можете столкнуться и с так называемой «физиологической анемией», когда уровень гемоглобина опускается до 100 мг% (в норме для женщин 120–140 мг%). Это происходит из-за увеличения объёма крови, усиления
Фенольные соединения
Эти вещества содержат ароматические кольца с гидроксильной группой, а также их функциональные производные. Фенольные соединения, в ароматическом кольце которых имеется более одной гидроксильной группы, называют полифенолами.Большинство
Скелет и его соединения
Скелет (от греч. skeleton – высохший, высушенный) – формообразующая конструкция тела – выполняет множество функций. Главными из них являются опора, защита, преодоление силы тяжести. Кости представляют собой систему рычагов, которые под влиянием
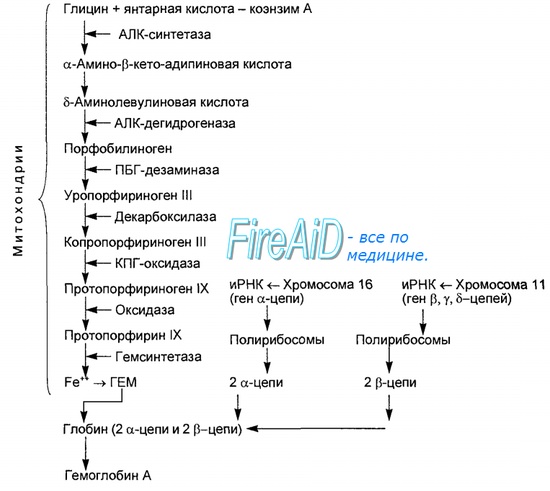
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
- Биология
- Физиология человека
- Физиология человека: Учебник/В двух томах. Т. I
Основные функции эритроцитов обусловлены наличием в их составе особого белка хромопротеида — гемоглобина. Молекулярная масса гемоглобина человека равна 68 800. Гемоглобин состоит из белковой (глобин) и железосодержащей (гем) частей. На 1 молекулу глобина приходится 4 молекулы гема.
В крови здорового человека содержание гемоглобина составляет 120—165 г/л (120—150 г/л для женщин и 130—160 г/л для мужчин). У беременных содержание гемоглобина может понижаться до 110 г/л, что не является патологией.
Основное назначение гемоглобина — транспорт 02 и СОг. Кроме того, гемоглобин обладает буферными свойствами, а также способностью связывать некоторые токсичные вещества.
Гемоглобин человека и различных животных имеет разное строение. Это касается белковой части — глобина, так как гем у всех представителей животного мира имеет одну и ту же структуру. Гем состоит из молекулы порфирина, в центре которой расположен ион Fe2*, способный присоединять Ог. Структура белковой части гемоглобина человека неоднородна, благодаря чему белковая часть разделяется на ряд фракций. Большая часть гемоглобина взрослого человека (95—98%) состоит из фракции А (от лат. adultus — взрослый); от 2 до 3% всего гемоглобина приходится на фракцию А2; наконец, в эритроцитах взрослого человека находится так называемый фетальный гемоглобин (от лат. fetus — плод), или ге-х моглобин F, содержание которого в норме подвержено значительным колебаниям, хотя редко превышает 1—2%. Гемоглобины А и А2 обнаруживаются практически во всех эритроцитах, тогда как гемоглобин F присутствует в них не всегда.
Гемоглобин F содержится преимущественно у плода. К моменту рождения ребенка на его долю приходится 70—90%. Гемоглобин F имеет большее сродство к 02, чем гемоглобин А, что позволяет тканям плода не испытывать гипоксии, несмотря на относительно низкое напряжение 02 в его крови. Эта приспособительная реакция объясняется тем, что гемоглобин F труднее вступает в связь с 2,3-дифосфоглицернновой кислотой, которая уменьшает способность
гемоглобина переходить в оксигемоглобин, а следовательно, и обеспечивать легкую отдачу Ог тканям.
Гемоглобин обладает способностью образовывать соединения с Ог, СОг и СО. Гемоглобин, присоединивший Ог, носит наименование оксигемоглобина (ННЬ02); гемоглобин, отдавший Ог, называется восстановленным, или редуцированным (ННЬ). В артериальной крови преобладает содержание оксигемоглобина, от чего ее цвет приобретает алую окраску. В венозной крови до 35% всего гемоглобина приходится на ННЬ. Кроме того, часть гемоглобина через аминную группу связывается с СОг, образуя карбогемоглобин (ННЬСОг), благодаря чему переносится от 10 до 20% всего транспортируемого кровью СО2.
Гемоглобин способен образовывать довольно прочную связь с СО. Это соединение называется карбоксигемоглобином (ННЬСО). Сродство гемоглобина к СО значительно выше, чем к 02, поэтому гемоглобин, присоединивший СО, неспособен связываться с 02. Однако при вдыхании чистого О2 резко возрастает скорость распада карбоксигемоглобина, чем пользуются на практике для лечения отравлений СО.
Сильные окислители (ферроцианид, бертолетова соль, пероксид, или перекись, водорода и др.) изменяют заряд от Fe2+ до Fe3+, в результате чего возникает окисленный гемоглобин — прочное соединение гемоглобина с 02, носящее наименование метгемоглобина. При этом нарушается транспорт Ог, что приводит к тяжелейшим последствиям для человека и даже смерти.
Источник: Под ред. В. М. Покровского, Г. Ф. Коротько., «Физиология человека: Учебник/В двух томах. Т. I» 1997
А так же в разделе «Гемоглобин и его соединения »
- Эритроциты
- Цветовой показатель
- Функции эритроцитов
- Эритрон. Регуляция эритропоэза
- Лейкоциты
- Физиологические лейкоцитозы. Лейкопении
- Лейкоцитарная формула
- Характеристика отдельных видов лейкоцитов
- Регуляция лейкопоэза
- 6.2.2.S. Неспецифическая резистентность и иммунитет
- Тромбоциты
Гемоглобин (Нв) – основной компонент эритроцитов, благодаря которому эритроциты выполняют дыхательную функцию и поддерживают рН крови. По химической природе он относится к хромопротеидам. У мужчин в крови содержится в среднем 130-160 г/л гемоглобина, у женщин – 120-150 г/л. Молекулярная масса гемоглобина составляет около 60000 Да. Гемоглобин состоит из белка глобина и 4 молекул гема. Гем имеет в своем составе атом железа, способный присоединять или отдавать молекулу кислорода.
Гем содержит двухвалентное железо, которое играет ключевую роль в деятельности гемоглобина, являясь его активной (простетической) группой. Гемоглобин синтезируется эритро- и нормобластами костного мозга. Для нормального синтеза гемоглобина необходимо достаточное поступление железа с пищей. При разрушении эритроцитов гемоглобин, после отщепления гема, превращается в билирубин – желчный пигмент, который поступает, в основном, в кишечник в составе желчи, где превращается в стеркобилин, выводящийся из организма с каловыми массами. Часть билирубина удаляется с мочой в виде уробилина.
Основная функция гемоглобина – перенос кислорода и углекислого газа. Гемоглобин, присоединивший к себе кислород, превращается в оксигемоглобин. Соединение гемоглобина с кислородом происходит в капиллярах легких. Это соединение непрочное. В виде оксигемоглобина переносится большая часть кислорода. Гемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. Гемоглобин, соединенный с углекислым газом носит название карбгемоглобина. Соединение гемоглобина с углекислым газом происходит в капиллярах тканей организма. Это соединение легко распадается. В виде этого соединения переносится 20 % СО2. Оксигемоглобин и карбгемоглобин являются физиологическими соединениями гемоглобина.
В скелетных и сердечной мышцах находится мышечный гемоглобин, называемый миоглобином. Он играет важную роль в снабжении кислородом работающих мышц, его можно рассматривать, как депо О2 в мышцах.
Имеется несколько форм гемоглобина, отличающихся строением белковой части – глобина. Первые 7-12 нед. внутриутробного развития зародыша его красные кровяные тельца содержат примитивный гемоглобин. У плода содержится гемоглобин F (80 %) или фетальный гемоглобин (от англ. Faetus – плод) гемоглобин. Он обладает более высокой способностью связывать кислород. Это помогает плоду не испытывать гипоксии при относительно низком парциальном напряжении кислорода в его крови. После рождения гемоглобин F практически полностью заменяется на взрослый – гемоглобин А (от англ. adult – взрослый). В эритроцитах взрослого человека содержатся гемоглобин А (95-98 % Hb A1 и 2-3 % HbA2 ).
Гемоглобин может вступать в соединение и с другими газами. Соединение гемоглобина с угарным газом (СО) называется карбоксигемоглобином – это патологическое соединение, в норме его не существует, т.к. в атмосфере отсутствует СО. Является прочным соединением. Гемоглобин блокирован в нем угарным газом и не способен осуществлять перенос кислорода. Сродство гемоглобина к угарному газу выше его сродства к кислороду, поэтому даже небольшое количество угарного газа в воздухе является опасным для жизни. При этом более критическим является не концентрация угарного газа, а длительность его вдыхания. Даже предельно низкое содержание СО в воздухе, но при длительном вдыхании, например, во время сна может оказаться летальным. Вследствие своего высокого сродства угарный газ в виде карбоксигемоглобина способен циркулировать в крови предельно долго.
Часто отравления угарным газом возникают у водителей при длительном нахождении в закрытом гараже с включенным двигателем автомобиля. Другим распространенным клинически значимым источником СО являются древесный дым, а также сырой кирпич печей изб и свежий печной лак. Поэтому при первом или после длительного перерыва протапливании таких печей необходимо тщательное проветривание помещения.
Особенностью угарного газа является то, что он не обладает запахом, поэтому отравление развивается незаметно. Часто пострадавший осознает это, когда проявляется миорелаксирующее (расслабление скелетной мускулатуры) действие угарного газа, при этом человек не может самостоятельно покинуть помещение.
Первая помощь при отравлении угарным газом. Пострадавшего следует переместить на свежий воздух. Следует учитывать, что при значительном отравлении сохранность самостоятельного дыхания не снимает необходимости проведения дальнейших действий по оказанию помощи. Наиболее оптимальным будет подача воздуха с повышенным содержание О2, например, из кислородной подушки. При отсутствии таковой – произвести искусственное дыхание. Во время искусственного дыхания в легкие потерпевшего воздух нагнетается под давлением, большим атмосферного.
При этом парциальное давление О2 в таком воздухе оказывается большим, чем в норме, что способствует его большему растворению в крови, а также лучшему вытеснению угарного газа из связи с гемоглобином. Если же пострадавший будет дышать самостоятельно, парциальное давление О2 во вдыхаемом воздухе окажется меньшим (примерно, 100 мм рт.ст.), что окажется недостаточным для вытеснения из карбоксигемоглобина угарного газа, т. к. сродство Нb к СО значительно выше, чем О2. В дальнейшем пострадавший должен быть доставлен в больницу.
При воздействии на гемоглобин экзогенных сильных окислителей происходит окисление железа гема с переходом его в 3-х валентную форму. В результате этого образуется метгемоглобин, который не способен присоединять ни О2, ни СО2. В результате окисления гемоглобин прочно удерживает кислород и теряет способность отдавать его тканям, что может привести к гибели организма.
К подобным сильным окислителем относятся нитраты и нитриты, содержащиеся, например, в химических удобрениях, также опасность представляют пероксиды, нитрокраски, анилиновые красители и ряд других веществ бытовой химии. В норме ежедневно около 0,5 % всего гемоглобина превращается в метгемоглобин, но затем она снова восстанавливается в гемоглобин специальным ферментом метгемоглобинредуктазой. Встречаются наследственные метгемоглобинемии, когда снижена активность метгемоглобинредуктазы в эритроцитах, что вызывает кислородное голодание. Метгемоглобин, также как карбоксигемоглобин, относится к группе патологических соединений гемоглобина.
