Спектр поглощения гемоглобина и оксигемоглобина
Анализ многокомпонентных смесей можно производить по производным спектра поглощения смеси и ее компонентов. Так, например описан анализ смеси красителей, используемых в фармацевтических препаратах по вторым производным [121], а также определение содержания гемоглобина, метгемоглобина и оксигемоглобина в кровн решением переопределенной системы уравнений типа (3.22), применен ной к первым производным спектра поглощения [122]. [c.86]
Спектр поглощения оксигемоглобин а, В пробирку к капле крови прибавляют 2 мл [c.189]
Гемоглобин, оксигемоглобин и карбоксигемоглобин имеют характерные спектры поглощения, обычно используемые для идентификации этих соединений. [c.454]
После восстановления ферригемоглобина в замороженной матрице быстрыми электронами более 80 % белка находится в неравновесной восстановленной низко-спиновой форме, характеризующейся спектром поглощения типа оксигемоглобина [c.77]
Гемоглобин, оксигемоглобин, карбоксигемоглобин и метгемоглобин могут быть качественно охарактеризованы присущими им спектрами поглощения. [c.183]
При одном из этих разведений совершенно отчетливо виден спектр поглощения оксигемоглобина — две полосы поглощения в желтой и зеленой части спектра (578,1 ммк и 541,7 ммк) между линиями D и Е (рис. 20). [c.183]
Все указанные факты, как уже упоминалось выше, подтверждают предположение о том, что железо гема соединено с имидазольной группой гистидина. Известно, однако, что спектры поглощения гемоглобина и оксигемоглобина, легко смещающиеся при воздействии разведенных кислот, устойчивы к действию концентрированных растворов щелочей [144]. Эти последние данные свидетельствуют, скорее, в пользу того, что железо гема соединено с кислотной группой, например с карбоксильной [126] или сульфгидрильной, Сульфгидрильные группы не обнаруживаются в нативном глобине при нейтральной реакции раствора они появляются, однако, при подщелачивании растворов глобина [145] или при денатурации его [146]. [c.245]
Все изменения в состоянии атома железа и в его связях с глобином сопровождаются изменениями спектров поглощения гемоглобинов. Как известно, для диамагнитных соединений — оксигемоглобина, карбоксигемоглобина и гемохромогена — характерными являются две полосы поглощения в зеленой части видимой области спектра [150]. [c.246]
Горовиц показал, что при высушивании восстановленного гемоглобина происходит весьма заметное изменение его спектра поглощения, состоящее в том, что одна размытая полоса, соответствующая 555 Щ х, заменяется двумя резкими полосами, типичными для гемохромогена [4]. Добавление воды приводит к появлению восстановленного гемоглобина в неизмененном виде. Оксигемоглобин не обнаруживает таких свойств, его характерный цвет и спектр поглощения одинаковы для раствора и для сухого состояния. Кроме того, сухой оксигемоглобин при низких давлениях кислорода не диссоциирует на гемоглобин и кислород, однако при добавлении воды происходит [c.190]
Кровь. К основным, как правило наблюдающимся, патологическим процессам при воздействии окиси углерода относятся изменения крови. Специфическим при этом является образование патологического пигмента — карбоксигемоглобина (СОНЬ). Спектр поглощения СОНЬ трудно отличить от спектра поглощения оксигемоглобина. Альфа- и бета-полосы поглощения карбоксигемоглобина лишь незначительно смещены в коротковолновую область спектра и расположены соответственно при 570 и 538 тр, (альфа- и бета-полосы поглощения оксигемоглобина расположены соответственно при 576 и 540 тр). [c.202]
Оксигемоглобин имеет в видимой части спектра две полосы поглощения при X 589—577 и X 556—536 нм, восстановленный гемоглобин при X 596—543 им, карбоксигемоглобин Х=579—564 и Я 536—523 нм. [c.366]
Красный пигмент крови гемин ХСШ и содержащие гемин белки — гемоглобин и оксигемоглобин также включают эту циклическую систему спектры их поглощения используются в аналитических целях и для диагностики в биохимических и медицинских исследованиях [96, 122]. [c.121]
Для получения карбоксигемоглобина дефибринированную кровь насыщают окисью углерода или светильным газом, который содержит окись углерода. Разбавленные растворы карбоксигемоглобина дают в спектре две п о-лосы поглощения, сходные с полосами поглощения оксигемоглобина, но сдвинутые к фиолетовой части спектра (рис. 33 4). [c.239]
Подобно хлорофиллу, спектры поглощения гема и гемопротеинов характеризуются интенсивными полосами Соре в районе 400 нм, а также другими интенсивными пиками поглощения между 500 и 600 нм. Максимумы поглощения деаокси-гемоглобина ( — 425 и 560 нм) и оксигемоглобина ( — 414, 543 и 578 нм) различны и очень характерны (рис. 5.11). Гемоглобин [c.174]
Гемоглобин (НЬ) относится к группе сложных белков хромопротеинов. Он состоит из белка глобина и простетической группы — гема, содержащего двухвалентное железо. Гемоглобин легко соединяется с кислородом воздуха, образуя оксигемоглобин НЬОа. В этом виде в крови содержится основная часть гемоглобина. При вдыхании угарного газа СО в крови образуется карбок-сигемоглобин НЬСО, соединение более проч юе, чем оксигемоглобин, что приводит к отравлению организма. При действии на кровь окислителей двухвалентное железо гемоглобина окисляется в трехвалентное и гемоглобин превращается в метгемоглобин (МНЬ), который, как и карбоксигемоглобин, неспособен присоединять кислород. Гемоглобин и его производные обладают способностью поглощать излучение различной длины волн и давать характерные спектры поглощения. Исследование спектров поглощения производных гемоглобина имеет большое значение при диагностике некоторых заболеваний и отравлений, при определении степени профессиональной вредности производства, в судебно-медицинской практике. [c.189]
В равновесном гемоглобине ион железа (Fe +) лежит вне порфиринового кольца (примерно на 1 Л). Он имеет четыре электрона и магнитный момент, равный 5,5 Боровских магнетонов. Оптический спектр поглощения имеет широкую полосу с = 5,56 нм. В равновесном оксигемоглобине ион железа (Fe +) находится точно в плоскости порфиринового кольца, все электроны спарены (оксигемоглобин диамагнитен). В спектре оптического поглощения видны две характеристические полосы при 542 и 576 нм. В ферригемоглобине (метгемоглобин) при нейтральных значениях pH молекула кислорода замешается молекулой воды, не связанной химически с ионом железа (Fe ). Ион железа лежит значительно ближе к порфириновому кольцу, чем в феррогемоглобине (почти в плоскости), имеет пять неспаренных электронов и магнитный момент равный 5,91 Боровских магнетона. Спектр поглощения в видимой области не имеет выраженных характеристических полос. [c.75]
Карбоксигемоглобин (НЬСО). Насытить кровь светильным газом, который всегда содержит окись углерода. Кровь при этом приобретает ярко-розовый цвет. Разбавить ее водой в 30 раз и наблюдать в спектроскопе спектр карбоксигемоглобина — две полосы поглощения (572—537 ммк) между линиями О и Е. Этот сиектр очень сходен со спектром поглощения оксигемоглобина. Для того чтобы отличить спектр НЬСО от спектра НЬОг, к раствору карбоксигемоглобина прибавить несколько капель реактива, содержащего 2 г Ре304 и 3 г винной кислоты в 100 мл воды. При этом в противоположность НЬОг не происходит никакого изменения спектра, так как карбоксигемоглобин не переходит при действии реактива в гемоглобин. [c.184]
Гоппе-Зейлер впервые описал спектры оксигемоглобина (1862), а первые рисунки этих спектров дали Валентин (1863) и Стокс (1863—1864) Наблюдения, проводимые до начала XX в., показали полную аналогию в спектрах поглощения оксигемоглобина всех исследуемых родов крови и артеоияльной крови или вообще крови, насыщенной кислородом. [c.161]
Оксигемоглобин. Наиболее важным производным гемоглобина является оксигемоглобии (НЬОг), который получается путем прямого присоединения молекулярного кислорода к гемоглобину. Кислород присоединяется к гемоглобину через железо при помощи добавочных связей. Оксигемоглобин очень нестоек и легко диссоциирует на гемоглобин и кислород уже при простом уменьшении парциального давления кислорода. При добавлении к раствору оксигемоглобина некоторых реактивов (например, многосернистого аммония), отнимающих кислород от оксигемоглобина, последний превращается в гемоглобин, имеющий другой спектр поглощения и другой цвет (вишневый). Таким путем можно отличить при спектроскопическом исследовании оксигемоглобин от карбоксигемоглобииа. Последний дает очень сходный с НЬОз спектр поглощения, который, однако, не изменяется под влиянием указанных реактивов. [c.65]
В форме супероксид-аниона Fe(III)—Ог . Это предположение было сделано главным образом на основе сравнения спектров поглощения в видимой области комплексов, координированных кислородом, со спектрами низкоспинового гидроксиметмиоглобина. Поскольку окснгемоглобин диамагнитен [105], гипотеза [179, 180] об образовании низкоспинового иона Ре(И1) с электронной конфигурацией d в оксигемоглобине или оксимиоглобине требует спаривания парамагнитного низкоспинового катиона Ре(П1) с парамагнитным супероксид-анионом Ог”. Такое спаривание, хотя и возможно, но не доказано. Как гипотеза Полинга [173, 174], так и модель супероксид-аниона [179, 180] приводят к увеличению длины связи О—О при координации с гемовым железом по сравнению с длиной 121 пм, характерной для молекулы кислорода [58]. Наблюдаемое расстояние О—О для супероксид-аниона составляет 128 пм. Маловероятно, чтобы для кристаллических гемопротеинов, координированных кислородом, точность рентгеноструктурных данных позволила бы обнаружить это удлинение. [c.74]
Хорошо известно, что окись углерода вытесняет кислород из соединения с гемоглобином. Спектр поглощения, форма кристаллов и некоторые другие свойства карбоксигемоглобина напоминают свойства оксигемоглобина. Главное различие между этими двумя соединениями состоит в том, что карбоксигемоглобин представляет собой гораздо более стойкое соединение, чем оксигемоглобин, и его диссоциация на гемоглобин и окись углерода происходит значительно медленнее [164]. Кроме того, карбоксигемо-1 лобин расщепляется на свои компоненты на свету [165], причем каждая молекула карбоксигемоглобина поглощает 1 квант [166]. В отличие от гемоглобина и оксигемоглобина карбоксигемоглобин не имеет полосы поглощения в области, близкой к инфракрасной (X =900—1 ООО т л) [167]. Карбоксигемоглобин легко отличить от оксигемоглобина по яркокрасной окраске его растворов, которая сохраняется даже после обработки растворов сульфатом меди, едким натром или таннином. Оксигемоглобин после такой обработки превращается в соединение, имеющее коричневый цвет. Устойчивость карбоксигемоглобина к действию указанных выше веществ также свидетельствует о большей стабильности молекулы карбоксигемоглобина по сравнению с молекулой оксигемоглобина, которая, расщепляясь при этих условиях, образует производные гемина, имеющие коричневый цвет. [c.249]
Хотя спектр поглощения и сродство гемоглобина к кислороду являются функцией простетической группы, оба эти свойства до определеппой степени зависят и от глобина. Так, например, рас-сюяпие между максимумами поглощения оксигемоглобина и [c.253]
В клинических лабораториях. Так как ни гемоглобин, ни оксигемоглобин не являются стойкими соединениями, они не могут быть использованы в качестве стандартов. Часто в качестве стандарта применяют раствор кислого гематина, имеющий коричневую окраску. Исследуемая кровь при этом методе предварительно смешивается с разведенной соляной кислотой. Необходимо, однако, отметить, что указанный метод дает часто ошибочные данные в связи с помутнением растворов вследствие постепенной флокуляции пигмента. Это помутнение означает, что падающий на раствор свет не только поглощается, но и рассеивается [209]. Помутнение растворов может быть обусловлено также липидами крови [210] или флокуляцией белков плазмы [211]. Более надежные результаты получаются при колориметри-ровании щелочных растворов, наилучшим же методом является колориметрическое или фотометрическое определение цианида метгемоглобина [212], образующегося при прибавлении к крови соляной кислоты и цианистого калия [213]. Этот метод был испытан в различных лабораториях, и полученные результаты оказались очень хорошими [214]. Большим преимуществом этого метода является также то, что можно использовать в качестве стандарта циангематин, который имеет такую же окраску и такой же спектр поглощения, как и цианид метгемоглобина. Хорошие результаты при определении гемоглобина дает также газовый метод Ван-Слайка. Содержание гемоглобина в крови нормальных людей при определении указанными методами оказалось равным 15,7—16,1% [215]. Метгемоглобин в присутствии гемоглобина может быть определен путем насыщения крови кислородом или окисью углерода до и после восстановления крови дитионитом (Ыа23204) [216]. Эта соль является одним из немногих восстановителей, которые могут быть использованы для превращения оксигемоглобина или метгемоглобина в гемоглобин, так как большинство других восстановителей одновременно необратимо денатурируют глобин. Однако некоторым недочетом этого метода является то, что небольшие количества неактивного пигмента , не способного присоединять кислород, также превращаются при действии N328204 в гемоглобин [217]. Очень малые количества кислорода и оксигемоглобина могут быть определены полярографическим методом [218]. Карбоксигемоглобин и метгемоглобин можно определять также путем спектрофотометрии в инфракрасном свете [219]. Спектрофотометрические методы применяются и тогда, когда необходимо определить какое-либо производное гемоглобина, находящееся в смеси с другими его производными [171, 220]. [c.255]
Наиболее надежно отравление окисью углерода можно установить с помощью видимого спектра поглощения крови. НЬОг и НЬСО имеют две характерные полосы в зеленой области. При добавлении восстановителя (сульфида аммония) полосы в первом случае исчезают, а во втором случае остаются. Лечение состоит в абсолютном покое и вдыхании кислорода для восстановления равновесия в сторону образования оксигемоглобина. [c.481]
При спектроскопическом исследовании крови, содержащей окись углерода, также видны две полосы поглощения, принад-у1ежащие карбоксигемоглобину, при сравнении со спектром окси-гемоглобина оказывается, что эти полосы по своему расположению не вполне совпадают с полосами оксигемоглобина (рис. Йб, спектр 3). [c.259]
Гемоглобин (НЬ). К раствору крови, который дал в предыдущем опыте ясно видимую картину спектра оксигемоглобина, прибавить несколько капель реактива, содержаш.его 2 г Ре304 и 3 г винной кислоты в 100 мл воды. Происходит восстановление оксигемоглобина в гемоглобин и в спектроскопе видна характерная для гемоглобина одна широкая полоса поглощения (555—558 -илгк) между линиями О и Е. Полученный раствор гемоглобина встряхнуть для того, чтобы смешать с воздухом, и затем наблюдать в спектроскопе. Спектр гемоглобина переходит снова в спектр оксигемоглобина, т. е. появляются две полосы поглощения. [c.184]
ХИМИИ и природы связи в комплексе гем — кислород может быть достигнут при строгом теоретическом анализе спектроскопических свойств оксигенированных гемопротеинов. Недавно на основе спектроскопического исследования поглощения поляризованного света в монокристаллах, Макинен и Итон [134] определили интенсивность, поляризацию и положение в спектре трех полос переноса заряда железо — кислород в оксигемоглобине. В частности, одна из этих полос вблизи инфракрасной области при 925 нм (рис. 10) характерна только для оксигемоглобина. Сопоставление результатов этих спектроскопических исследований с результатами теоретических расчетов молекулярных орбиталей позволяет сделать выбор между различными моделями, предложенными для стереохимии железо — кислород в оксигенированном комплексе гемоглобина. [c.75]
Реакция с диметил-п-фенилендиамином [13]. К раствору ацетона (одна капля в 5 л(л воды) добавляют несколько капель раствора, приготовленного из 2 г диметил-п-фенилендиамина и 100 мл воды появляется фиолетовая окраска, переходящая в розовую и через сутки—в красную. В спектре, который дает этот раствор, имеются две полосы поглощениямежду линиями Д и , аналогичные полосам поглощения оксигемоглобина. Окраска исчезает от прибавления щелочи и снова появляется при подкислении. [c.206]
Химические свойства. Водный раствор имеет нейтральную реакцию. Почти мгновенно окисляется кислородом воздуха в двуокись азота. Образует с гемоглобином соединение — NO-гемоглобин, имеющее спекто поглощения, сходный со спектром оксигемоглобина. [c.112]
Методы и достижения бионеорганической химии (1978) — [
c.53
]
Лабораторная работа №22
Изучение оптических свойств
различных форм гемоглобина
Каждая форма гемоглобина
характеризуется определенным спектром поглощения, представляющим собой зависимость
оптической плотности раствора гемоглобина от длины волны света. Наиболее
интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая
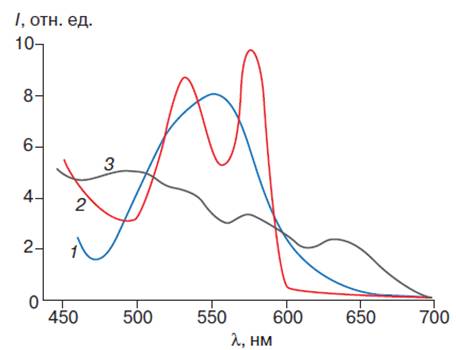
порфириновой части его молекулы (рис. 5).

Рис. 5. Спектр поглощения
производных гемоглобина. Спектры поглощения дезоксигемоглобина (1),
оксигемоглобина (2) и ферригемоглобина (3)
По изменению положения и
интенсивности поглощения этой полосы можно судить о структурных изменениях
молекул различных форм гемоглобина (табл. 22).
Таблица 22
Спектральные характеристики различных форм
гемоглобина
Формы гемоглобина | α-Полоса | β-Полоса | Полоса | |||
λ, | ελ, | λ, | ελ, | λ, | ελ, | |
Оксигемоглобин | 557 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоголобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Оборудование
и материалы. СФ-(46) или другой спектрофотометр,
центрифуга на 9000 об/мин, центрифужные пробирки, кюветы, пенициллиновые
флаконы, пипетки Пастера, прибор для получения оксида углерода, гемоглобин кристаллический,
хлористый натрий, гепарин, бихромат калия, феррицианид калия, дитионит натрия.
Получение
раствора оксигемоглобина. Для работы рекомендуется использовать
свежеприготовленные растворы гемоглобина. Кровь берут у декапитированных животных.
Цельную кровь стабилизируют гепарином, растворенным в 0,85%-ном растворе
хлористого натрия. Для отделения плазмы стабилизированную кровь центрифугируйте
в течение 10 мин при 3000 об/мин. Плазму крови отберите пипеткой. К эритроцитам
добавьте трехкратный объем 0,85%-ного раствора хлористого натрия, осторожно при
этом размешивая суспензию стеклянной палочкой. Суспензию центрифугируйте в течение
5 мин при 6000 об/мин. Промойте эритроциты 3 раза. Промытые эритроциты
подвергните гемолизу дистиллированной водой в течение 20 мин. Стромы осадите центрифугированием
при 9000 об/мин в течение 15 мин. В прозрачном гемолизате определите содержание
гемоглобина с помощью приведенного в работе № 20 метода.
Ход
анализа
Регистрация
спектра поглощения оксигемоглобина. Раствор
оксигемоглобина разбавьте дистиллированной водой до оптической плотности
раствора, попадающей в диапазон 0,4-0,5. Снимите спектр поглощения раствора
оксигемоглобина в интервале длин волн 380-600 нм (оптическая плотность раствора
измеряется через каждые 5 нм).
Регистрация
спектра поглощения метгемоглобина. Добавьте к раствору
оксигемоглобина 1-2 капли насыщенного раствора феррицианида калия. Визуально
оцените изменение окраски. Раствор метгемоглобина имеет коричневую окраску.
Снимите спектр поглощения раствора гемоглобина в интервале длин волн 380-600
нм. Для компенсации светопоглощения за счет феррицианида в контроль добавьте
такой же объем раствора этого вещества, какой был добавлен к раствору
оксигемоглобина.
Регистрация
спектра поглощения метгемоглобина. Добавьте к водному
раствору оксигемоглобина несколько кристаллов дитионита натрия (Na2S2O4).
Визуально оцените изменение окраски. Ярко алая окраска (цвет оксигемоглобина)
переходит в синевато-красную, характерную для гемоглобина. Снимите спектр
поглощения раствора в интервале длин волн 380-600 нм.
ЗАДАНИЕ
1. Представьте в графическом виде
зависимость оптической плотности различных состояний гемоглобина от длины
поглощаемого света (спектр поглощения), откладывая по оси ординат оптическую
плотность раствора, а по оси абсцисс соответствующие длины волн.
2. Найдите минимумы и максимумы
поглощения гемоглобинов и сделайте вывод.
