Спектральный анализ гемоглобина это

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Щуплова Е.А.
1
Фадеев С.Б.
1
1 Институт клеточного и внутриклеточного симбиоза, Уральское отделение РАН (ИКВС УрО РАН)
Цель работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности. Материал и методы. Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры проб (сканирующий спектрофотометр «Genesys 5», США), состоящих из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В работе использовались 30 штаммов стафилококков, обладающих антигемоглобиновой активностью. Результаты. Под влиянием супернатантов штаммов стафилококков происходило снижение оптической плотности проб, содержащих гемолизат эритроцитов, в диапазонах 220-450 нм. Наиболее выраженное снижение оптической плотности происходило под действием супернатантов штаммов с высокой антигемоглобиновой активностью (р
спектральный анализ
бактерии
гемоглобин
эритроциты
1. Артюхов В.Г., Вашанов Г.А., Козлова И.Е. УФ-чувствительность димеров гемоглобина в свободном состоянии и в составе гибридов валентности: модификация серотонином // Радиационная биология. Радиоэкология. – 2001. – Т. 41, № 2. – С. 190-194.
2. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Взаимодействие бактерий и эритроцитов // Журн. микробиол. – 2005. – № 4. – С. 89-96.
3. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Определение антигемоглобиновой активности микроорганизмов : патент России № 2262705.2005. Бюл. № 19.
4. Икрянникова С.В. Влияние экологических факторов на антиоксидантный статус и спектральные характеристики гемоглобина жителей промышленного города : дис. … канд. биол. наук. – Оренбург, 2006. – 119 с.
5. Ланг Т.А., Сесик М. Как описывать статистику в медицине. Аннотированное руководство для авторов, редакторов и рецензентов / пер. с англ. под ред. В.П. Леонова. – М. : Практическая медицина, 2011. – 480 с. : ил.
6. Путинцева О.В., Артюхов В.Г., Калаева Е.А. Оценка степени фотоповреждения хромофоров гемового и глобинового компонентов УФ-облученных молекул и электрофоретических фракций карбоксигемоглобина человека // Радиационная биология. Радиоэкология. – 2000. – Т. 40, № 4. – С. 439-445.
7. Справочник по микробиологическим и вирусологическим методам исследования / М.О. Биргер. – М. : Медицина, 1982. – 462 с.
8. Byrne D.P. Role of the cysteine protease interpain A of Prevotella intermedia in breakdown and release of hem from hemoglobin // J. Biochemistry. – 2010. – Vol. 425. – P. 257–264.
9. Perutz M.F., Heedner E.J., Zadner J.E. et al. Influence of globin structure on the state of the heme III changes in heme spectra accompanying allosteric transitions in methemoglobin and their implications for heme-heme interaction // J. Biochemistry. – 1974. – Vol. 13. – P. 2187-2200.
10. Pishchany G., Skaar E. P. Taste for Blood: Hemoglobin as a Nutrient Source for Pathogens // PLoS Pathogens. – 2012. – V. 8. – P. 1-4.
Введение
Гемоглобин эритроцитов представляет собой гетерогенную систему, включающую не только его производные (сульфгемоглобин, метгемоглобин, цианметгемоглобин), но и ряд продуктов необратимой окислительной деградации гемоглобина, причем соотношение между компонентами этой системы может меняться под воздействием различных экзогенных и эндогенных факторов. На молекулярном уровне эти изменения могут вызывать конформационные перестройки четвертичной структуры белковой части гемоглобина, влиять на состояние его простетической группы, изменять спиновое состояние гемового железа, степень его окисления (образования метгемоглобина), а также влиять на структурно-функциональные системы эритроцита [6]. Данные процессы взаимосвязаны и могут снижать сродство тетрамерной молекулы гемоглобина к кислороду, что в конечном итоге способствует развитию тканевой гипоксии и связанных с ней клеточных повреждений [4]. При развитии инфекционных процессов, сопровождающихся бактериемией, может наблюдаться феномен инвазии микроорганизмов внутрь эритроцитов [2]. При этом между эритроцитами, а точнее консолидированными компонентами крови и бактериями может происходить конкурентная борьба за гемовое железо, являющееся важным компонентом биохимических процессов, обеспечивающих рост, размножение бактериальных клеток и образование факторов патогенности [10]. Особенности влияния микроорганизмов на систему гемоглобина изучены недостаточно.
Цель настоящей работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности.
Материал и методы
В работе использовали 30 клинических штаммов рода Staphylococcus (виды: S.epidermidis, S.saprophyticus, S.cohni и др.), выделенные из очагов гнойно-воспалительных заболеваний различной локализации [7], из них 15 штаммов с высоким уровнем (>3 г/л) антигемоглобиновой активности [3] и 15 – с низким (<3 г/л).
Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры пробы (сканирующий спектрофотометр «Genesys 5», США), состоящей из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В качестве контрольной использовали пробу, состоящую из 2 мл мясо-пептонного бульона (МПБ) и 0,5 мл взвеси эритроцитов в той же концентрации. Исследования проводили при постоянном температурном режиме 37 °С. Для проведения каждого измерения 0,5 мл исследуемой пробы смешивали с 0,5 мл дистиллированной воды с целью гемолиза эритроцитов. Оптическую плотность (ОП) определяли в диапазоне 450-700 нм. Полученные данные трактовали как изменение гемовой части гемоглобина [9]. Для оценки изменений в белковой части гемоглобина, вышеуказанную часть пробы дополнительно разводили дистиллированной водой в 2 раза и определяли оптическую плотность исследуемого раствора в диапазоне 220-450 нм [9].
Для оценки спектральных параметров метгемоглобина рассчитывали разностные спектры, которые строили относительно модельного спектра, содержащего оксигемоглобин [4]. Для нивелирования отличий спектральных характеристик, обусловленных разной концентрацией гемоглобина в пробах, вычисляли разностные спектры по нормированным спектрам относительно поглощения проходящего света с длиной волны 576 нм [6]. При оценке полученных графиков анализировали точки (диапазоны длин волн), соответствующие частотным интервалам поглощения проходящего света метгемоглобином и различными аминокислотами. Частотные интервалы метгемоглобина составляли для видимой области спектра: 502-505; 538-542; 560-565; 619-620; 629-632 нм и для ультрафиолетовой части спектра – 252; 268-272; 408-415 [4].
Полученные результаты были подвергнуты статистической обработке в компьютерной оболочке Windows с помощью процессора электронных таблиц Microsoft Office Excel 2007 c вычислением средней арифметической (M); средней ошибки (m); критерия значимости (t) Стьюдента. Различия считались значимыми (достоверными) при р<0,05 [5].
Результаты исследования
На первом этапе спектрального анализа гемоглобина под действием супернатантов исследуемых штаммов было установлено, что после 2 часов инкубации проб регистрировалось повышение значений оптической плотности в спектральном диапазоне (230-450 нм), соответствующем белковой части гемоглобина. При этом наибольшие значения ОП (0,130±0,001 ед.) регистрировались под действием штаммов с высоким уровнем АнтиНbА при длине волны 252 нм, что соответствует спектру поглощения ароматических аминокислот. При действии супернатантов штаммов с низким уровнем АнтиНbА, при равных условиях, значения ОП исследуемых проб (0,037±0,001 ед. ОП; р<0,05) было в 3,5 раза меньше. В контрольной пробе показания оптической плотности стремились к 0 (в сравнении с разностными спектрами), что свидетельствовало об отсутствии конформационных перестроек в белковой части гемоглобина.
При оценке спектра ОП контрольной и опытных проб через 6 ч инкубации с эритроцитами особое внимание обращали на диапазоны 246-270 нм, соответствующие полосам поглощения света аминокислотами белковой части гемоглобина и 398-422 нм – характерных для «порфиринового кармана». Показания оптической плотности проб в диапазоне, соответствующем аминокислотам (246-270 нм), под действием штаммов с высоким уровнем АнтиНbА снижались до отрицательных значений (рис. 1). Это может свидетельствовать о том, что гемовая часть в молекуле гемоглобина становится менее «защищенной» белковой структурой гемоглобина. Под действием штаммов с низким уровнем АнтиНbА наблюдали менее выраженное понижение значений оптической плотности проб в аналогичном интервале до -0,137±0,003 ед. ОП, однако в диапазоне 271-350 нм ОП увеличивалась до 0,225±0,002 ед. Такое изменение оптической плотности под действием штаммов с низким уровнем АнтиНbА свидетельствует о конформационных перестройках в белковой части гемового кармана. В контрольной пробе в диапазонах 254-366 нм (область, характерная для задержки проходящего света ароматическими и серосодержащими аминокислотами) значения ОП также оставались близкими к 0, т.е. структурные изменения белковой части гемоглобина не происходили. Под действием штаммов с высоким уровнем АнтиНbА в диапазоне 398-422 нм наблюдали снижение ОП до уровня -0,198±0,002 ед. При увеличении длины волны проходящего света регистрировалось повышение ОП этой же пробы до значения 0,063±0,006 ед. ОП (р<0,05). Такая существенная разница, по-видимому, свидетельствует о том, что наибольшие значения оптической плотности, соответствующие гемовой части гемоглобина, «смещаются» из коротковолновой в длинноволновую часть спектра. Данные изменения, вероятнее всего, связаны с тем, что микроорганизмы, изменяя белковую часть гемоглобина, затрагивают «порфириновый карман», где в гемовой части может происходить окисление железа, реализующееся в увеличении доли метгемоглобина в исследуемых пробах.
Под действием штаммов с низким уровнем АнтиНbА наблюдали аналогичные изменения ОП, которые характеризовались более низкими значениями: от -0,134±0,001 до 0,045±0,001 ед., свидетельствующие о меньшем воздействии на «порфириновый карман» и накоплении метгемоглобина.
При анализе спектральных характеристик опытных проб через 24 ч инкубации супернатантов исследуемых штаммов с эритроцитами наблюдали незначительное волнообразное изменение ОП, что говорило о дальнейших конформационных изменениях в белковой части гемоглобина. В контрольной пробе в диапазонах 230-290 нм наблюдали отрицательные значения оптической плотности.

Рисунок 1 – Изменения спектров белковой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (6 ч инкубации)
Второй этап исследований заключался в проведении спектрального анализа гемоглобина под действием супернатантов исследуемых культур в видимой области спектра (450-700 нм), позволяющего оценить долю образовавшегося метгемоглобина (МetHb). Через 2 ч инкубации происходило более выраженное увеличение оптической плотности опытных проб при длине волны проходящего света 560 нм (спектр поглощения, характерный для метгемоглобина) под действием штаммов с высоким уровнем АнтиНbА, чем с низким (0,024±0,001 против 0,019±0,001 ед. ОП; р<0,05; при пересчете на долю метгемоглобина – 6% против 4%). В контрольной пробе через 2 часа выявлялись отрицательные значения спектральных параметров полос поглощения света (при 502 нм – -0,025±0,001 ед. ОП; при 630 нм – -0,020±0,001 ед. ОП), что свидетельствует о снижении уровня метгемоглобина.
В ходе спектральной оценки образования метгемоглобина (при соответствующей длине волны проходящего света 502 нм) было установлено, что ОП проб после шестичасовой инкубации эритроцитов с супернатантами штаммов с высокой АнтиНbА характеризовались большими значениями, чем после воздействия на эритроциты штаммов с низким уровнем АнтиНbА (0,144±0,003 ед. ОП против – 0,063±0,002 ед. ОП, р<0,05; при пересчете на долю образующего метгемоглобина оказалось 9% против 4%). Спектральная оценка при длине волны 562 нм показала, что влияние штаммов с высоким уровнем АнтиНbА на образование метгемоглобина привело к большему снижению оптической плотности проб (0,032±0,001 ед. ОП; в пересчете на долю метгемоглобина – 8%), чем при воздействии изолятов с низким уровнем АнтиНbА (0,040±0,001 ед. ОП; при пересчете на долю метгемоглобина – 10%). Продолжение измерений при большей длине волны 632 нм выявило, что штаммы с высоким уровнем АнтиНbА, напротив, повышали оптическую плотность проб (0,070±0,004 ед. ОП; 9% МеtHb), по сравнению со штаммами, обладающими низким уровнем АнтиНbА (0,047±0,001 ед. ОП; р<0,05; 5% – МеtHb). В контрольной пробе значения спектральных параметров гемоглобина оказались отрицательными, что свидетельствует о наименьшем образовании метгемоглобина.
После 24 ч инкубации опытных проб наблюдали наиболее выраженные изменения значений спектров, соответствующих метгемоглобину, под действием штаммов с высоким уровнем АнтиНbА, чем с низким уровнем данного свойства (рис. 2). 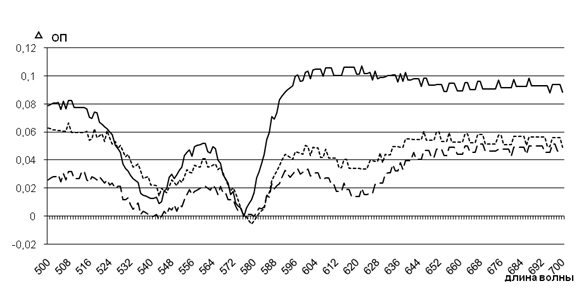
![]() – – – контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
– – – контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
Рисунок 2 – Изменения спектров гемовой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (24 ч инкубации)
При длине волны 619 нм наблюдали максимальные значения оптической плотности спектров проб под действием штаммов с высоким уровнем АнтиНbА, что в 3,1 раза выше, чем спектральные параметры проб под действием штаммов с низким уровнем данного свойства (0,106±0,001 против 0,034±0,001 ед. ОП; р<0,05), что указывает на значимое повышение долей метгемоглобина (в 3,3 раза, 13% против 4% соответственно). Спектральные характеристики контрольной пробы показали незначительное повышение оптической плотности полос поглощения света, что при пересчете на долю метгемоглобина составило 2-2,2%.
Обсуждение полученных результатов
Инфекционные процессы, сопровождающиеся транзиторной или постоянной бактериемией, как правило, клинически характеризуются развитием гипохромной анемии. Однако только в последние годы стало уделяться внимание взаимодействию гемоглобина и бактерий. Как известно, гемоглобин обладает антимикробным действием [2]. С другой стороны, микроорганизмы содержат широкий спектр средств защиты от факторов неспецифической противоинфекционной резистентности, в том числе и антигемоглобиновую активность [2]. Важным моментом во взаимодействии микроорганизмов с эритроцитами является возможность получения гемового железа при внутриклеточном персистировании.
В настоящей работе показано, что продукты жизнедеятельности стафилококков могут вызывать конформационные изменения белковой части гемоглобина, делая для бактерий доступным «порфириновый карман», содержащий собственно гем. Причем стафилококки с высоким уровнем АнтиНbА нарушают белковую структуру гемоглобина в большей степени, чем микроорганизмы с низкими показателями активности. Следующий момент воздействия бактерий на гемоглобин заключается в повышении доли его производного – метгемоглобина, содержащего не двух-, а трехвалентные ионы железа. Неспособность метгемоглобина рыхло и обратимо связывать кислород в конечном итоге может быть одним из факторов развития тканевой гипоксии. При этом штаммы с высоким уровнем АнтиНbА более «успешны», под их действием доля метгемоглобина увеличивается до 13%, тогда как под влиянием стафилококков с низкой АнтиНbА доля метгемоглобина через 6 часов инкубации достигает 10%, а к 24-м часам снижается до 4%. В последнем случае трансформация гемоглобина носит отчасти обратимый характер. В целом полученные результаты раскрывают первые этапы взаимодействия микроорганизмов с эритроцитами человека – нарушение конформационной структуры белковой части гемоглобина, «открытие» порфиринового кармана, переход оксигемоглобина в метгемоглобин. Все это дает возможность бактериям захватывать железо непосредственно из гема и использовать его для собственного бактериального метаболизма. Аналогичные результаты были получены зарубежными авторами при изучении влияния протеазы Prevotella intermedia на образование метгемоглобина [8]. В других работах были показаны изменения в молекуле гемоглобина под действием УФ-света, также приводящие к повышению образования метгемоглобина [1; 6].
Таким образом, спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности показал, что продукты жизнедеятельности бактерий способны нарушать конформационную структуру белковой части гемоглобина, а также влиять на гем, увеличивая долю метгемоглобина.
Авторы выражают благодарность к.б.н. Икрянниковой С.В. и д.м.н., профессору Красикову С.И. (кафедра медицинской и фармацевтической химии ОрГМА) за помощь в проведении исследований.
Рецензенты:
Карташова О.Л., д.б.н., профессор кафедры микробиологии и заразных болезней ФГБОУ ВПО «Оренбургский государственный аграрный университет», г. Оренбург.
Чайникова И.Н., д.м.н., профессор кафедры микробиологии, иммунологии и вирусологии ФГБОУ ВПО «Оренбургская медицинская академия», г. Оренбург.
Библиографическая ссылка
Щуплова Е.А., Фадеев С.Б. СПЕКТРАЛЬНЫЙ АНАЛИЗ ГЕМОГЛОБИНА ПОД ДЕЙСТВИЕМ МИКРООРГАНИЗМОВ С РАЗНЫМ УРОВНЕМ АНТИГЕМОГЛОБИНОВОЙ АКТИВНОСТИ // Современные проблемы науки и образования. – 2013. – № 2.;
URL: https://science-education.ru/ru/article/view?id=8791 (дата обращения: 20.11.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
7.5.2. Пигменты крови
Пигментами называются вещества различной химической
структуры, обладающие определенным цветом и окрашивающие среду, в которой они
находятся. Цвет пигментов обусловлен наличием в их молекулах хромофорных групп,
поглощающих свет определенной длины волны. Выполняемые пигментами физиологические
функции разнообразны. Основные из них — перенос и депонирование 02 и
СО2, участие в тканевом дыхании, в окислительно—восстановительных
реакциях. В процессе эволюции внутренней среды появилось несколько типов таких
пигментов. Все они являются белками, содержащими металл.
|
Рис. 7.7 Молекула гемоглобина и формула гема |
Гемоглобин, миоглобин, гемеритин, хлоркруорин
содержат железо, гемоцианин — медь, гемованадин — ванадий. Важнейшими из
пигментов являются хромопротеиды. Это белки, молекула которых состоит из
белка и окрашенной простетической группы. В качестве простетической группы
многие пигменты содержат металлопроизводные порфиринов.
Порфирины
привлекают особое внимание. Это связано с тем, что они входят в основной
пигмент крови — гемоглобин и в зеленый пигмент растений — хлорофилл.
В плазме крови беспозвоночных животных обнаружены железопорфирин—дыхательные
пигменты. В крови и лимфе многих беспозвоночных имеются голубые или зеленовато—голубые
дыхательные пигменты, содержащие медь. В состав окрашенного белка цитокупреина
включены медь и цинк.
Гемоглобин.
Гемоглобин является наиболее распространенным кровяным пигментом. Он содержится
в эритроцитах всех позвоночных и некоторых беспозвоночных животных (черви,
моллюски, членистоногие, иглокожие), а также в корневых клубеньках некоторых
бобовых растений. Многие свойства гемоглобина зависят от особенностей его
химического строения. Молекулярная масса гемоглобина эритроцитов человека
составляет 64,5 кДа.
В одном эритроците находится около 400 млн. молекул
гемоглобина. В состав гемоглобина входят соединенные между собой гистидиновым
мостиком простои белок глобин и пигментная группа гем (рис. 7.7) в
соотношении 96 и 4 % от массы молекулы соответственно. Молекула гемоглобина
содержит четыре одинаковые группы гема. Глобин представляет собой белок типа
альбумина. У разных видов животных он отличается по своему
аминокислотному составу что определяет различие в свойствах гемоглобина.
Строение гема одинаково у всех видов животных. Он построен из пиррольных колец
и содержит двухвалентное железо (рис. 7.7). Именно железо играет
ключевую роль в деятельности гемоглобина, являясь его активной прocmemuчecкoй
группой. Одна из валентностей железа реализуется при связывании гема с
глобином, ко второй присоединяется О2 или другие лиганды — вода, С02,
азиды. Белковая и простетическая части молекулы не только связаны, но и
постоянно оказывают друг на друга сильное влияние. Глобин изменяет свойства
гема определяя его способность к связыванию кислой рода. В свою очередь, гем
обеспечивает устойчивость глобина к действию физических факторов, расщеплению
ферментами и т. д.
Количество гемоглобина в крови подвержено индивидуальным
колебаниям. Средней нормальной величиной у человека считают 140 г/л крови, что,
например, для индивидуума массой 65 кг составляет более 600 г. Высчитано также
что 1 г гемоглобина содержит 3,5 мг железа, и, таким образом, во всех
эритроцитах организма его находится 2,1 г.
В процессе переноса кислорода гемоглобин превращается
в оксигемоглобин (HbO2). Для того чтобы специально подчеркнуть, что при
этом соединении валентность железа не меняется, реакцию связывания кислорода с
гемоглобином называют не окислением, а оксигенацией. Противоположный
процесс именуют дезоксигенацией. В том случае, когда необходимо
акцентировать внимание на том, что гемоглобин не связан с кислородом, широко
употребляют термин дезоксигемоглобин.
Оксигемоглобин (НbО2) имеет ярко—алый цвет, что и определяет цвет артериальной крови.
Образование оксигемоглобина происходит в капиллярах легких, где напряжение 02
высоко. Количество гемоглобина в эритроцитах обусловливает кислородную
емкость крови. Следовательно, кровь человека, содержащая около 600 г
оксигемоглобина, будучи вся насыщена кислородом, может связать более 800 см3O2. Кислородную емкость выражают как количество
кислорода, связываемое 1 см3 крови. Соответственно этому кислородная
емкость нормальной крови, содержащей в каждом кубическом сантиметре 0,14 г
гемоглобина, составляет около 0,190 см3 02.
В отличие от капилляров легких, в капиллярах тканей
кислорода меньше, его напряжение ниже и здесь оксигемоглобин распадается на
гемоглобин и кислород. Гемоглобин, отдавший кислород, называют восстановленным,
или редуцированным, гемоглобином (Нb). Именно он определяет вишневый цвет венозной крови.
Следовательно, гемоглобин представляет собой своеобразное химическое вещество,
вступающее в обратимое соединение с кислородом при любом его напряжении.
Способность гемоглобина связывать и отдавать кислород отражается кислородно—диссоциационной
кривой. Эта кривая характеризует процент насыщения гемоглобина кислородом в
зависимости от его напряжения (Ро2).
По мере того как кровь проходит через ткани и отдает
02, она попутно вбирает в себя конечный продукт окислительных
обменных процессов в клетках — СO2. Реакция связывания гемоглобина с
СО2. сложнее, чем присоединение 02. Это
объясняется прежде всего ролью СO2 в создании кислотно—щелочного
равновесия в организме. Механизмы, обеспечивающие транспорт газа, призваны
также поддерживать и это равновесие. Гемоглобин, связанный с С02,
называют карбогемоглобином.
Гемоглобин особенно легко соединяется с угарным газом
— оксидом углерода — СО. Происходит образование карбоксигемоглобина
(НЬСО), не способного к переносу 02. В этом случае
закономерности его реакции те же, что и для кислорода, но химическое сродство
СО к гемоглобину почти в 300 раз выше, чем к 02, Это означает, что достаточно
в воздухе оказаться небольшому количеству СО, чтобы произошло образование
значительного числа связанных молекул гемоглобина. Образовавшееся соединение —
блокированный угарным газом гемоглобин — уже не может служить переносчиком
кислорода. Так, при концентрации СО в воздухе, равной 0,1%, около 80%
гемоглобина крови оказываются связанными не с кислородом, а с угарным газом. В
результате в организме возникают тяжелые последствия кислородного голодания
(рвота,
головная
боль, потеря сознания).
Слабые отравления угарным газом являются процессом
обратимым: СО постепенно отщепляется и выводится при дыхании свежим воздухом.
Использование искусственного дыхания чистым кислородом ускоряет примерно в 20
раз эту реакцию. При концентрации СО, равной 1%, через несколько минут
наступает гибель организма. В нормальных условиях на долю НЬСО приходится лишь
1% общего количества гемоглобина крови, у курильщиков его содержание достигает
3%, а после глубокой затяжки — 10%.
Гемоглобин, приведенный в соприкосновение с сильнодействующими
окислителями (перманганат калия, бертолетова соль, нитробензол, анилин),
образует соединение метгемоглобин (НЬОН), имеющее коричневый цвет. При
этом происходит окисление железа и переход его в трехвалентную форму. В
результате истинного окисления гемоглобин прочно удерживает кислород и в итоге
перестает быть его переносчиком. При наследственной метгемоглобинемии
происходит нарушение равновесия между процессами окисления гемоглобина и
метгемоглобина и восстановления гемоглобина. Проявляется на первом году жизни
синюшным цветом кожи (цианоз) и повышением содержания в крови метгемоглобина
Миоглобин.
В скелетных и сердечной мышцах животных различных классов и групп находится
мышечный гемоглобин — миоглобин (табл. 7.3). Это дыхательный пигмент красного
цвета. По своей биохимической характеристике миоглобин близок к гемоглобину
крови. Сходство выражается в наличии одной и той же простетической группы,
одинакового количества железа в способности вступать в обратимые соединения с О2
и CO2.
Однако кислородо—связывающие свойства миоглобина значительно отличаются от
таковых гемоглобина. В связи с меньшей, чем у гемоглобина, плотностью у него
резко возрастает сродство к кислороду. Поэтому миоглобин исключительно
приспособлен к депонированию О2. Это имеет большое значение для
снабжения кислородом мышц, особенно производящих ритмические сокращения в
течение длительных периодов времени: мышц крыльев птиц, мышц конечностей
теплокровных животных, жевательных мышц, сердечной мышцы. При деятельности всех
этих мышц в фазе сокращения происходит пережатие капилляров, так что кровоток
через ткань в эту фазу фактически прекращается. Именно в этот момент миоглобин
служит важным источником кислорода, так как он «запасает» О2 при
расслаблении и отдает его во время сокращения мышц. Благодаря высокому сродству
к кислороду полунасыщение им миоглобина происходит в обычных условиях быстрее
чем за 0,1 с.
В сердце теплокровного животного содержится около
0,5% миоглобина. При падении напряжения O2 с 40
до 5 мм рт. ст. это количество высвобождает 2 мл O2 на
каждый 1 г ткани сердечной мышцы. Такого объема газа оказывается достаточно,
чтобы покрыть потребности сердца в кислороде во время систолы.
У животных содержание миоглобина зависит от видовой
принадлежности условий существования, типа мышцы и степени ее активности.
Определенное значение имеет и трофическая иннервация автономной нервной
системой.
Таблица 7.3
Содержание миоглобина в сердечных и скелетных мышцах
некоторых классов позвоночных животных, г на 100 г сухой ткани
Класс, группа животных, | Мышца сердца | Скелетная мышца |
Рыбы | 0,2—0,5 | 0,1—0,4 |
Амфибии | 0,1—0,6 | 0—0,1 |
Рептилии | 0,8—2,6 | 0.2—2,4 |
Птицы домашние | 1,0—2,0 | 0,9—1,8 |
Птицы дикие | 2,1—6,5 | 0,7—5,3 |
Млекопитающие домашние | 0,9—4,4 | 0,2—8,5 |
Млекопитающие дикие | 1,1—6,2 | 0,02—5,13 |
Человек | 1,5 | 1,4—3,9 |
Особенно высокое содержание миоглобина характерно
для водных животных, некоторых беспозвоночных (красные мышцы моллюсков), птиц (гладкая
мускулатура мышечного желудка). В нормальных условиях в крови и моче миоглобин
отсутствует.
Спектральный анализ гемоглобина и его производных. Использование
спектрографических методов при рассмотрении раствора оксигемоглобина выявляет в
желто—зеленой части спектра между фраунгоферовскими линиями D и Е две
системные полосы поглощения, у восстановленного гемоглобина в той же части
спектра имеется лишь одна широкая полоса. Различия в поглощении излучения
гемоглобином и оксигемоглобином послужили основой для метода изучения степени
насыщения крови кислородом — оксигемометрии.
Карбгемоглобин по своему спектру близок к оксигемоглобину, однако при
добавлении восстанавливающего вещества у карбгемоглобина появляются две полосы
поглощения. Спектр метгемоглобина характеризуется одной узкой полосой
поглощения слева на границе красной и желтой части спектра, второй узкой
полосой на границе желтой и зеленой зон, наконец, третьей широкой полосой в
зеленой части спектра.

