Спектральный анализ соединений гемоглобина

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Щуплова Е.А.
1
Фадеев С.Б.
1
1 Институт клеточного и внутриклеточного симбиоза, Уральское отделение РАН (ИКВС УрО РАН)
Цель работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности. Материал и методы. Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры проб (сканирующий спектрофотометр «Genesys 5», США), состоящих из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В работе использовались 30 штаммов стафилококков, обладающих антигемоглобиновой активностью. Результаты. Под влиянием супернатантов штаммов стафилококков происходило снижение оптической плотности проб, содержащих гемолизат эритроцитов, в диапазонах 220-450 нм. Наиболее выраженное снижение оптической плотности происходило под действием супернатантов штаммов с высокой антигемоглобиновой активностью (р
спектральный анализ
бактерии
гемоглобин
эритроциты
1. Артюхов В.Г., Вашанов Г.А., Козлова И.Е. УФ-чувствительность димеров гемоглобина в свободном состоянии и в составе гибридов валентности: модификация серотонином // Радиационная биология. Радиоэкология. – 2001. – Т. 41, № 2. – С. 190-194.
2. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Взаимодействие бактерий и эритроцитов // Журн. микробиол. – 2005. – № 4. – С. 89-96.
3. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Определение антигемоглобиновой активности микроорганизмов : патент России № 2262705.2005. Бюл. № 19.
4. Икрянникова С.В. Влияние экологических факторов на антиоксидантный статус и спектральные характеристики гемоглобина жителей промышленного города : дис. … канд. биол. наук. – Оренбург, 2006. – 119 с.
5. Ланг Т.А., Сесик М. Как описывать статистику в медицине. Аннотированное руководство для авторов, редакторов и рецензентов / пер. с англ. под ред. В.П. Леонова. – М. : Практическая медицина, 2011. – 480 с. : ил.
6. Путинцева О.В., Артюхов В.Г., Калаева Е.А. Оценка степени фотоповреждения хромофоров гемового и глобинового компонентов УФ-облученных молекул и электрофоретических фракций карбоксигемоглобина человека // Радиационная биология. Радиоэкология. – 2000. – Т. 40, № 4. – С. 439-445.
7. Справочник по микробиологическим и вирусологическим методам исследования / М.О. Биргер. – М. : Медицина, 1982. – 462 с.
8. Byrne D.P. Role of the cysteine protease interpain A of Prevotella intermedia in breakdown and release of hem from hemoglobin // J. Biochemistry. – 2010. – Vol. 425. – P. 257–264.
9. Perutz M.F., Heedner E.J., Zadner J.E. et al. Influence of globin structure on the state of the heme III changes in heme spectra accompanying allosteric transitions in methemoglobin and their implications for heme-heme interaction // J. Biochemistry. – 1974. – Vol. 13. – P. 2187-2200.
10. Pishchany G., Skaar E. P. Taste for Blood: Hemoglobin as a Nutrient Source for Pathogens // PLoS Pathogens. – 2012. – V. 8. – P. 1-4.
Введение
Гемоглобин эритроцитов представляет собой гетерогенную систему, включающую не только его производные (сульфгемоглобин, метгемоглобин, цианметгемоглобин), но и ряд продуктов необратимой окислительной деградации гемоглобина, причем соотношение между компонентами этой системы может меняться под воздействием различных экзогенных и эндогенных факторов. На молекулярном уровне эти изменения могут вызывать конформационные перестройки четвертичной структуры белковой части гемоглобина, влиять на состояние его простетической группы, изменять спиновое состояние гемового железа, степень его окисления (образования метгемоглобина), а также влиять на структурно-функциональные системы эритроцита [6]. Данные процессы взаимосвязаны и могут снижать сродство тетрамерной молекулы гемоглобина к кислороду, что в конечном итоге способствует развитию тканевой гипоксии и связанных с ней клеточных повреждений [4]. При развитии инфекционных процессов, сопровождающихся бактериемией, может наблюдаться феномен инвазии микроорганизмов внутрь эритроцитов [2]. При этом между эритроцитами, а точнее консолидированными компонентами крови и бактериями может происходить конкурентная борьба за гемовое железо, являющееся важным компонентом биохимических процессов, обеспечивающих рост, размножение бактериальных клеток и образование факторов патогенности [10]. Особенности влияния микроорганизмов на систему гемоглобина изучены недостаточно.
Цель настоящей работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности.
Материал и методы
В работе использовали 30 клинических штаммов рода Staphylococcus (виды: S.epidermidis, S.saprophyticus, S.cohni и др.), выделенные из очагов гнойно-воспалительных заболеваний различной локализации [7], из них 15 штаммов с высоким уровнем (>3 г/л) антигемоглобиновой активности [3] и 15 – с низким (<3 г/л).
Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры пробы (сканирующий спектрофотометр «Genesys 5», США), состоящей из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В качестве контрольной использовали пробу, состоящую из 2 мл мясо-пептонного бульона (МПБ) и 0,5 мл взвеси эритроцитов в той же концентрации. Исследования проводили при постоянном температурном режиме 37 °С. Для проведения каждого измерения 0,5 мл исследуемой пробы смешивали с 0,5 мл дистиллированной воды с целью гемолиза эритроцитов. Оптическую плотность (ОП) определяли в диапазоне 450-700 нм. Полученные данные трактовали как изменение гемовой части гемоглобина [9]. Для оценки изменений в белковой части гемоглобина, вышеуказанную часть пробы дополнительно разводили дистиллированной водой в 2 раза и определяли оптическую плотность исследуемого раствора в диапазоне 220-450 нм [9].
Для оценки спектральных параметров метгемоглобина рассчитывали разностные спектры, которые строили относительно модельного спектра, содержащего оксигемоглобин [4]. Для нивелирования отличий спектральных характеристик, обусловленных разной концентрацией гемоглобина в пробах, вычисляли разностные спектры по нормированным спектрам относительно поглощения проходящего света с длиной волны 576 нм [6]. При оценке полученных графиков анализировали точки (диапазоны длин волн), соответствующие частотным интервалам поглощения проходящего света метгемоглобином и различными аминокислотами. Частотные интервалы метгемоглобина составляли для видимой области спектра: 502-505; 538-542; 560-565; 619-620; 629-632 нм и для ультрафиолетовой части спектра – 252; 268-272; 408-415 [4].
Полученные результаты были подвергнуты статистической обработке в компьютерной оболочке Windows с помощью процессора электронных таблиц Microsoft Office Excel 2007 c вычислением средней арифметической (M); средней ошибки (m); критерия значимости (t) Стьюдента. Различия считались значимыми (достоверными) при р<0,05 [5].
Результаты исследования
На первом этапе спектрального анализа гемоглобина под действием супернатантов исследуемых штаммов было установлено, что после 2 часов инкубации проб регистрировалось повышение значений оптической плотности в спектральном диапазоне (230-450 нм), соответствующем белковой части гемоглобина. При этом наибольшие значения ОП (0,130±0,001 ед.) регистрировались под действием штаммов с высоким уровнем АнтиНbА при длине волны 252 нм, что соответствует спектру поглощения ароматических аминокислот. При действии супернатантов штаммов с низким уровнем АнтиНbА, при равных условиях, значения ОП исследуемых проб (0,037±0,001 ед. ОП; р<0,05) было в 3,5 раза меньше. В контрольной пробе показания оптической плотности стремились к 0 (в сравнении с разностными спектрами), что свидетельствовало об отсутствии конформационных перестроек в белковой части гемоглобина.
При оценке спектра ОП контрольной и опытных проб через 6 ч инкубации с эритроцитами особое внимание обращали на диапазоны 246-270 нм, соответствующие полосам поглощения света аминокислотами белковой части гемоглобина и 398-422 нм – характерных для «порфиринового кармана». Показания оптической плотности проб в диапазоне, соответствующем аминокислотам (246-270 нм), под действием штаммов с высоким уровнем АнтиНbА снижались до отрицательных значений (рис. 1). Это может свидетельствовать о том, что гемовая часть в молекуле гемоглобина становится менее «защищенной» белковой структурой гемоглобина. Под действием штаммов с низким уровнем АнтиНbА наблюдали менее выраженное понижение значений оптической плотности проб в аналогичном интервале до -0,137±0,003 ед. ОП, однако в диапазоне 271-350 нм ОП увеличивалась до 0,225±0,002 ед. Такое изменение оптической плотности под действием штаммов с низким уровнем АнтиНbА свидетельствует о конформационных перестройках в белковой части гемового кармана. В контрольной пробе в диапазонах 254-366 нм (область, характерная для задержки проходящего света ароматическими и серосодержащими аминокислотами) значения ОП также оставались близкими к 0, т.е. структурные изменения белковой части гемоглобина не происходили. Под действием штаммов с высоким уровнем АнтиНbА в диапазоне 398-422 нм наблюдали снижение ОП до уровня -0,198±0,002 ед. При увеличении длины волны проходящего света регистрировалось повышение ОП этой же пробы до значения 0,063±0,006 ед. ОП (р<0,05). Такая существенная разница, по-видимому, свидетельствует о том, что наибольшие значения оптической плотности, соответствующие гемовой части гемоглобина, «смещаются» из коротковолновой в длинноволновую часть спектра. Данные изменения, вероятнее всего, связаны с тем, что микроорганизмы, изменяя белковую часть гемоглобина, затрагивают «порфириновый карман», где в гемовой части может происходить окисление железа, реализующееся в увеличении доли метгемоглобина в исследуемых пробах.
Под действием штаммов с низким уровнем АнтиНbА наблюдали аналогичные изменения ОП, которые характеризовались более низкими значениями: от -0,134±0,001 до 0,045±0,001 ед., свидетельствующие о меньшем воздействии на «порфириновый карман» и накоплении метгемоглобина.
При анализе спектральных характеристик опытных проб через 24 ч инкубации супернатантов исследуемых штаммов с эритроцитами наблюдали незначительное волнообразное изменение ОП, что говорило о дальнейших конформационных изменениях в белковой части гемоглобина. В контрольной пробе в диапазонах 230-290 нм наблюдали отрицательные значения оптической плотности.

Рисунок 1 – Изменения спектров белковой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (6 ч инкубации)
Второй этап исследований заключался в проведении спектрального анализа гемоглобина под действием супернатантов исследуемых культур в видимой области спектра (450-700 нм), позволяющего оценить долю образовавшегося метгемоглобина (МetHb). Через 2 ч инкубации происходило более выраженное увеличение оптической плотности опытных проб при длине волны проходящего света 560 нм (спектр поглощения, характерный для метгемоглобина) под действием штаммов с высоким уровнем АнтиНbА, чем с низким (0,024±0,001 против 0,019±0,001 ед. ОП; р<0,05; при пересчете на долю метгемоглобина – 6% против 4%). В контрольной пробе через 2 часа выявлялись отрицательные значения спектральных параметров полос поглощения света (при 502 нм – -0,025±0,001 ед. ОП; при 630 нм – -0,020±0,001 ед. ОП), что свидетельствует о снижении уровня метгемоглобина.
В ходе спектральной оценки образования метгемоглобина (при соответствующей длине волны проходящего света 502 нм) было установлено, что ОП проб после шестичасовой инкубации эритроцитов с супернатантами штаммов с высокой АнтиНbА характеризовались большими значениями, чем после воздействия на эритроциты штаммов с низким уровнем АнтиНbА (0,144±0,003 ед. ОП против – 0,063±0,002 ед. ОП, р<0,05; при пересчете на долю образующего метгемоглобина оказалось 9% против 4%). Спектральная оценка при длине волны 562 нм показала, что влияние штаммов с высоким уровнем АнтиНbА на образование метгемоглобина привело к большему снижению оптической плотности проб (0,032±0,001 ед. ОП; в пересчете на долю метгемоглобина – 8%), чем при воздействии изолятов с низким уровнем АнтиНbА (0,040±0,001 ед. ОП; при пересчете на долю метгемоглобина – 10%). Продолжение измерений при большей длине волны 632 нм выявило, что штаммы с высоким уровнем АнтиНbА, напротив, повышали оптическую плотность проб (0,070±0,004 ед. ОП; 9% МеtHb), по сравнению со штаммами, обладающими низким уровнем АнтиНbА (0,047±0,001 ед. ОП; р<0,05; 5% – МеtHb). В контрольной пробе значения спектральных параметров гемоглобина оказались отрицательными, что свидетельствует о наименьшем образовании метгемоглобина.
После 24 ч инкубации опытных проб наблюдали наиболее выраженные изменения значений спектров, соответствующих метгемоглобину, под действием штаммов с высоким уровнем АнтиНbА, чем с низким уровнем данного свойства (рис. 2). 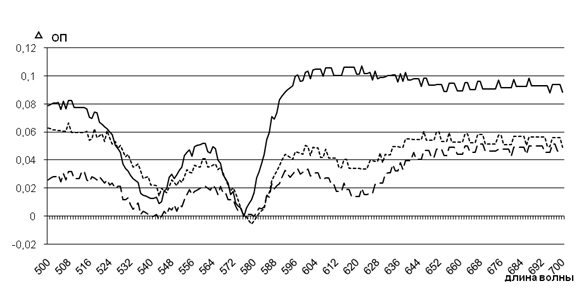
![]() – – – контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
– – – контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
Рисунок 2 – Изменения спектров гемовой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (24 ч инкубации)
При длине волны 619 нм наблюдали максимальные значения оптической плотности спектров проб под действием штаммов с высоким уровнем АнтиНbА, что в 3,1 раза выше, чем спектральные параметры проб под действием штаммов с низким уровнем данного свойства (0,106±0,001 против 0,034±0,001 ед. ОП; р<0,05), что указывает на значимое повышение долей метгемоглобина (в 3,3 раза, 13% против 4% соответственно). Спектральные характеристики контрольной пробы показали незначительное повышение оптической плотности полос поглощения света, что при пересчете на долю метгемоглобина составило 2-2,2%.
Обсуждение полученных результатов
Инфекционные процессы, сопровождающиеся транзиторной или постоянной бактериемией, как правило, клинически характеризуются развитием гипохромной анемии. Однако только в последние годы стало уделяться внимание взаимодействию гемоглобина и бактерий. Как известно, гемоглобин обладает антимикробным действием [2]. С другой стороны, микроорганизмы содержат широкий спектр средств защиты от факторов неспецифической противоинфекционной резистентности, в том числе и антигемоглобиновую активность [2]. Важным моментом во взаимодействии микроорганизмов с эритроцитами является возможность получения гемового железа при внутриклеточном персистировании.
В настоящей работе показано, что продукты жизнедеятельности стафилококков могут вызывать конформационные изменения белковой части гемоглобина, делая для бактерий доступным «порфириновый карман», содержащий собственно гем. Причем стафилококки с высоким уровнем АнтиНbА нарушают белковую структуру гемоглобина в большей степени, чем микроорганизмы с низкими показателями активности. Следующий момент воздействия бактерий на гемоглобин заключается в повышении доли его производного – метгемоглобина, содержащего не двух-, а трехвалентные ионы железа. Неспособность метгемоглобина рыхло и обратимо связывать кислород в конечном итоге может быть одним из факторов развития тканевой гипоксии. При этом штаммы с высоким уровнем АнтиНbА более «успешны», под их действием доля метгемоглобина увеличивается до 13%, тогда как под влиянием стафилококков с низкой АнтиНbА доля метгемоглобина через 6 часов инкубации достигает 10%, а к 24-м часам снижается до 4%. В последнем случае трансформация гемоглобина носит отчасти обратимый характер. В целом полученные результаты раскрывают первые этапы взаимодействия микроорганизмов с эритроцитами человека – нарушение конформационной структуры белковой части гемоглобина, «открытие» порфиринового кармана, переход оксигемоглобина в метгемоглобин. Все это дает возможность бактериям захватывать железо непосредственно из гема и использовать его для собственного бактериального метаболизма. Аналогичные результаты были получены зарубежными авторами при изучении влияния протеазы Prevotella intermedia на образование метгемоглобина [8]. В других работах были показаны изменения в молекуле гемоглобина под действием УФ-света, также приводящие к повышению образования метгемоглобина [1; 6].
Таким образом, спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности показал, что продукты жизнедеятельности бактерий способны нарушать конформационную структуру белковой части гемоглобина, а также влиять на гем, увеличивая долю метгемоглобина.
Авторы выражают благодарность к.б.н. Икрянниковой С.В. и д.м.н., профессору Красикову С.И. (кафедра медицинской и фармацевтической химии ОрГМА) за помощь в проведении исследований.
Рецензенты:
Карташова О.Л., д.б.н., профессор кафедры микробиологии и заразных болезней ФГБОУ ВПО «Оренбургский государственный аграрный университет», г. Оренбург.
Чайникова И.Н., д.м.н., профессор кафедры микробиологии, иммунологии и вирусологии ФГБОУ ВПО «Оренбургская медицинская академия», г. Оренбург.
Библиографическая ссылка
Щуплова Е.А., Фадеев С.Б. СПЕКТРАЛЬНЫЙ АНАЛИЗ ГЕМОГЛОБИНА ПОД ДЕЙСТВИЕМ МИКРООРГАНИЗМОВ С РАЗНЫМ УРОВНЕМ АНТИГЕМОГЛОБИНОВОЙ АКТИВНОСТИ // Современные проблемы науки и образования. – 2013. – № 2.;
URL: https://science-education.ru/ru/article/view?id=8791 (дата обращения: 15.10.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
– перенос кислорода. Гемоглобин присоединяет кислород при высоком порциальном давлении(в легких). В молекуле гемоглобина имеется 4 гема, каждый из которых может присоединить молекулу кислорода. Оксигенация- присоединение кислорода к гемоглобину, т.к. не происходит процесс изменения валентности железа. В тканях, где низкое парциальное давление гемоглобин отдает кислород – дезоксикинация. Соединение гемоглобина и кислорода называется оксигемоглобин. Процесс оксигенации идет ступенчато.
Hb4+O2=Hb4O2
Hb4O2+O2=Hb4O4
Hb4O4+O2= HbO6
Hb4O2+O2= Hb4O8
В ходе оксигенации процесс присоединения кислорода возрастает.
Кооперативный эффект – молекулы кислорода в конце присоединяются в 500 раз быстрее. 1 г гемоглобина присоединяет 1,34 мл O2.
100% насыщение крови гемоглобином – максимальное процентное(объемное) насыщение
20мл на 100мл крови. На самом деле гемоглобин насыщается на 96-98%.
Присоединение кислорода также зависит от pH, от количества CO2, 2,3-дифософглицерат(продукт неполного окисления глюкозы). При накоплении его гемоглобин начинает легче отдавать кислород.
Метгемоглобин, в котором железо становится 3х валентным(при действии сильных окислителей-феррицианид калия, нитраты, бертолетовая соль, фенацитин) Он не может отдавать кислород. Метгемоглобин способен связывать синилистую кислоту и др. связи, поэтому при отравлении этими веществами в организм вводят метгемоглобин.
Карбоксигемоглобин(соединение Hb с CO) угарный газ присоединяется в гемоглобине к железу, но сродство гемоглобина к угарному газу выше в 300 раз, чем к кислороду. Если в воздухе больше 0,1 % угарного газа, то гемоглобин связывается с угарным газом. 60% связано с угарным газом(смерть). Угарный газ содержится в выхлопных газах, в печах, образуется при курении.
Помощь пострадавшим – отравление угарным газом начинается незаметно. Сам человек не может двигаться, необходим его вынос из этого помещения и обеспечение дыхания желательно газовым баллоном с 95% кислорода и 5 % углекислого газа. Гемоглобин может присоединяться углекислый газ – карбгемоглобин. Соединение происходит с белковой частью. Акцептором являются аминные части(NH2) – R-NH2+CO2=RNHCOOH.
Это соединение способно удалять углекислый газ. Соединение гемоглобина с разными газами обладает разными спектрами поглощения. Восстановленный гемоглобин имеет одну широкую полосу желто-зеленой части спектра. У оксигемоглобина образуется 2 полосы в желто-зеленой части спектра. Метгемоглобин имеет 4 полосы – 2 в желто-зеленой, в красной и в синей. Карбоксигемоглобин имеет 2 полосы в желто-зеленой части спектра, но это соединение можно отличить от оксигемоглобина путем добавления восстановителя. Поскольку карбоксигемоглобин соединение прочное, то добавление восстановителя не добавляет полос.
Гемоглобин выполняет важную функцию в поддержании нормального уровня pH. При отдаче кислорода в тканях гемоглобин присоединяет протон. В легких протон водорода отдается для образования угольной кислоты. При действии на гемоглобин сильных кислот или щелочей образуются соединения с кристаллической формой и эти соединения являются основанием для подтверждения крови. Гемины, гемохромогены. В синтезе парфирина(пиррольного кольца) принимают участие глицин и янтарная кислота. Глобин образуется из аминокислот путем синтеза белка. В эритроцитах, которые завершают свой жизненный цикл происходит и распад гемоглобина. При этом гемм отделяется от белковой части. От гемма отеляется железа, а из остатков гемма образуются желчные пигменты(например билирубин, который затем будет захватываться печеночными клетками) Внутри гепатоцитов происходит соединение гемоглобина с глюкуроновой кислотой. Билирубин гюкуронит выводится в желчные капилляры. С желчбю попадает в кишечник, где подвергается окислению, где переходит в урабиллин, который всасывается в кровь. Часть остается в кишечники и выводится с каловыми массами(их окраска – стеркобиллины). Уррабиллин придает окраску моче и снова захватывается печеночными клетками.
О содержании в эритроцитах гемоглобина судят по так называемому цветовому показателю, или фарб-индексу (Fi, от farb — цвет, index — показатель) — относительной величине, характеризующей насыщение в среднем одного эритроцита гемоглобином. Fi — процентное соотношение гемоглобина и эритроцитов, при этом за 100% (или единиц) гемоглобина условно принимают величину, равную 166,7 г/л, а за 100% эритроцитов — 5*10 /л. Если у человека содержание гемоглобина и эритроцитов равно 100%, то цветовой показатель равен 1. В норме Fi колеблется в пределах 0,75—1,0 и очень редко может достигать 1,1. В этом случае эритроциты называются нормохромными. Если Fi менее 0,7, то такие эритроциты недонасыщены гемоглобином и называются гипохромными. При Fi более 1,1 эритроциты именуются гиперхромными. В этом случае» объем эритроцита значительно увеличивается, что позволяет ему содержать большую концентрацию гемоглобина. В результате создается ложное впечатление, будто эритроциты перенасыщены гемоглобином. Гипо- и гиперхромия встречаются лишь при анемиях. Определение цветового показателя важно для клинической практики, так как позволяет провести дифференциальный диагноз при анемиях различной этиологии.
Источник
