Сродство гемоглобина к кислороду и его регуляция
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
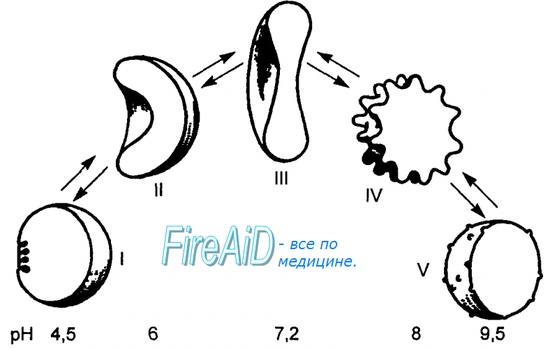
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
2,3-ДФГ
снижает сродство гемоглобина к кислороду
и, таким образом, повышает отдачу
кислорода тканям. Если кровь израсходовала
весь свой запас ДФГ, гемоглобин остается
фактически насыщенным кислородом. При
акклиматизации в условиях высокогорья
содержание ДФГ в эритроцитах резко
увеличивается. ДФГ является аллотерическим
лигандом, так как связывается с
гемоглобином в другом по сравнению с
О2
участком. ДФГ встраивается в полость
тетрамерной молекулы гемоглобина,
полость образована остатками всех 4
протомеров.
В
Т – форме (дезоксигенерированной)
молекулы Hb
имеются дополнительные связи, и поэтому
размер центральной полости больше, чем
в R
– форме (дезоксигемоглобине). Поэтому
ДФГ взаимодействует только с Т – формой
стабилизируя её, путем образования
связи между атомами кислорода ДФГ и
тремя положительно заряженными группами
в каждой из
– цепей.
В
легких при высоком парциальном давлении
кислород взаимодействует с Hb,
изменяется конформация белка, уменьшается
центральная полость и ДФГ вытесняется
из гемоглобина.
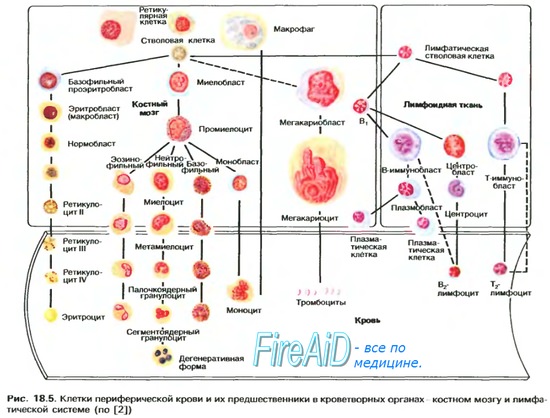
Вопрос 9. Реакции синтеза гема, регуляция синтеза.

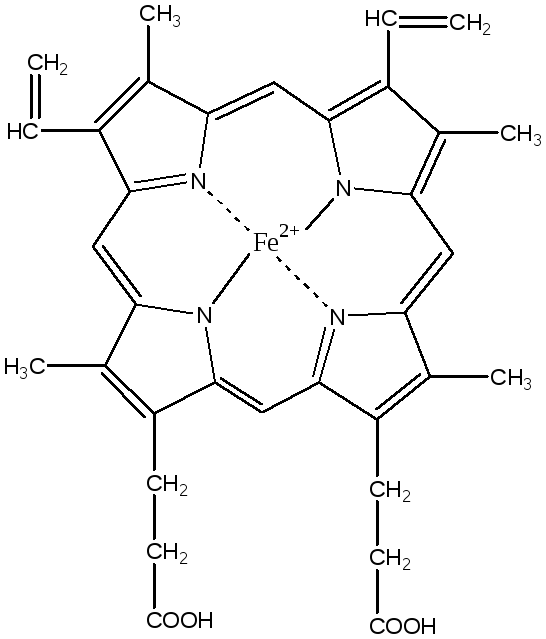
Гем
является простетической группой
гемоглобина, миоглобина, цитохромов,
каталазы и пероксифазы.
Гем
синтезируется во всех клетках, но
наиболее активно синтез идет в печени
и костном мозге, так как в этих тканях
идет синтез гемоглобина и цитохромов.
Гем в эритроцитах начинает синтезироваться
уже на стадии полихроматофильных
эритробластов. Клетки делится, постепенно
накапливают гемоглобин, их цитоплазма
становится оксифильной – это ацирофильные
эритробласты. Синтез гема заканчивается
только в зрелых эритроцитах (нет
митохондрий).
Для
синтеза гема необходимо два исходных
реагента: глицин и сукцинил – КоА. Эти
вещества необходимы для синтеза
– аминолевулиновой кислоты (
– ALA).
Реакция катализируется
пиридоксальфосфатзависимым ферментам
ALA
– синтазой, которая локализуется в
митохондриях.
Далее
процесс перемещается в цитоплазму, так
как следующий фермент синтеза гема –
ALA
– дегидротаза, локализован именно там.
ALA
– дегидротаза – Zn-
содержащий фермент. Этот фермент
катализирует реакцию конденсации двух
молекул ALA
с образованием пиррола – порфобилинагена
(ПБГ).
Остальные
стадии биосинтеза гема включают в себя
соединение 4 молекул ПБГ в единую
структуру, модификацию групп боковых
цепей и образование хелатных комплексов
с двух валентным атомом железа.
Промежуточными тетрапехронами на
стадиях между образованием ПБГ и
формированием гема являются бесцветные
(уро-) и копропорфириногемы. (содержащий
метеновые мостики (-СН=)). Опишем подробнее
стадии биосинтеза гема из ПБГ.
Уропорфириноген
III
превращается в копропорфириноген III
путем декарбоксилирования всех ацетатных
групп (А), вместо которых образуются
метильные группы (М). Реакцию катализирует
уропорфириноген – декарбоксилаза.
Далее копропорфириноген III
(КПГ) поступает в митохондрии, где
превращается в протопорфириноген III
(ППГ), а затем в протопорфирин III.
Митоходриальный фермент
копропорфириногеноксидаза катализирует
декарбоксилирование и окисление двух
пропионовых боковых цепей с образованием
винильной группы во 2,4 положении
(-СН=СН2).
Так образуется ППГ. Затем он окисляется
протопорфириногенооксидазой с
образованием протопорфирина IX.
Завершающей
стадией синтеза гема является включение
в протопорфирин двух валентного железа.
Эта реакция катализируется митохондриальным
ферментом гем – синтезой или ферро –
хелатазой.
Важным
является и тот факт, что в процессе
синтеза гема возрастает гидрофобность
тетрапиррольных соединений в результате
декарбоксилирования замещающих групп.
Так, более полярный уропорфириноген
экскретируется преимущественно с мочой,
а более гидрофобные копропорфириноген
и ППГ оказываются преимущественно в
желчи и удаляются в составе фекалий.
В легких сродство гемоглобина к кислороду очень высокое. На уровне тканей – низкое. В тканях происходит распад веществ с образованием углекислого газа, который проникает из тканей в эритроцит, взаимодействует с водой с образование угольной кислоты, которая распадается на гидрокарбонатный ион протон водорода:
CO2 + H2O H2CO3 H+ + HCO3-
Н+ присоединяется к гемоглобину, образуется дезоксигемоглобин, а кислород отделяется от него и уходит в ткани. таким образом, чем выше количество Н+ , тем меньше сродство гемоглобина к кислороду.
Дезоксигемоглобин переносится к легким. На уровне легких в эритроцитах происходит следующая реакция:
H+ + HCO3- H2CO3 CO2 + H2O
Углекислый газ и вода удаляются через легкие. А на место протона к молекуле гемоглобина присоединяется кислород, и процесс повторяется.
Кроме того, сродство гемоглобина к кислороду регулируется веществом 2,3-дифосфоглицератом, которое образуется в эритроцитах при распаде глюкозы. 2,3-дифосфоглицерат может присоединяться к дезоксигемоглобину на уровне тканей, поэтому в присутствии 2,3-дифосфоглицерата сродство кислорода к гемоглобину снижается, и кислород поступает в ткани.
Белковые цепи гемоглобина α и β кодируются различными генами. При мутациях в этих генах синтезируются аномальные гемоглобины. При этом наблюдаются гемоглобинопатии. Например, аномальным является гемоглобин М, у которого в β-цепи гидрофильная аминокислота глутамат заменена на гидрофобную аминокислоту валин. В результате гемоглобин М нерастворим, образует осадок в виде длинных волокон, эритроцит деформируется и приобретает форму серпа. Такой гемоглобин неспособен переносить кислород. В результате развивается заболевание серповидноклеточная анемия. Кроме того, аминокислота гистидин активного центра гемоглобин может быть на тирозин, в результате атом железа в геме приобретает степень окисления +3. образуется мет-гемоглобин, который неспособен переносить кислород, возникает гипоксия в организме.
Флавопротеины – относятся к хромопротеинам. В качестве небелковой части выступает флавинмононуклеотиод (ФМН) и флавинадениндинуклетотид (ФАД) (см. лекция). Флавопротеины являются ферментами окислительно-восстановительных реакций, обеспечивающих организм энергией.
Липопротеины – в качестве небелковой части содержат липиды: свободные жирные кислоты, триацилглицеролы, фосфолипиды, холестерин. Липопротеины входят в состав клеточных мембран, осуществляют транспорт липидов по крови к тканям.
Липиды соединяются с белковой частью с помощью ионных связей и гидрофобных связей.
Фосфопротеины – в качестве небелковой части содержат фосфат. Фосфат присоединяется к белковой части при помощи сложно-эфирной связи с ОН-группой сеина, треонина, тирозина. К фосфопротеинам относятся : казеин молока, вителлин яйца, ихтулин рыб. Таким эти белки способствуют росту и развитию организма.
Металлопротеины – в качестве небелковой части содержат ионы металлов – железо, медь, кобальт, марганец, молибден, цинк, магний, кальций, калий, натрий. Связь иона металла с белковой частью осуществляется с помощью координационных связей. Металлопротеины являются ферментами. Трансферрин переносит железо в крови, ферритин запасает железо в тканях.
Нуклеопротеины – в качестве небелковой части содержат нуклеиновые кислоты – ДНК, РНК. В результате образуются следующие нуклеопротеины – дезоксирибонулеопротеины (ДНП) и рибонулеопротеины (РНП). ДНП входят в состав хромосом, отвечают за хранение и передачу наследственной информации. РНП входят в состав рибосом, на которых осуществляется синтез белка.
ДНК – состоит из нуклеотидов. Нуклеотид состоитиз азотистого основания, дезоксирибозы и фосфата. Различают пуриновые азотистые основания – аденин и гуанин, пиримидиновые азотистые основания – цитозин, тимин. Нуклеотиды соединяются сложноэфирными связями в первичную структуру ДНК. Вторичная структура ДНК представлена двойной спиралью. Внутри спирали – водородные связи, образованные между комплементарными азотистыми основаниями: аденин комплементарен тимину, гуанин – цитозину. При наружу обращены дезоксирибоза и фосфат отрицательнозаряженный. Третичная структура образуется при связывании спирали ДНК с положительно заряженными белками гистонами в составе хромосом.
При делении клетки происходит удвоение ДНК – репликация, редупликация. При этом двойная спираль ДНК раскручивается, образуются 2 исходные нити ДНК, на каждой из которых по принципу комплементарности строятся дочерние цепи ДНК. В результате образуются две двойные молекулы ДНК. Между нитями – водородные связи, образованные при взаимодействии комплементарных азотистых оснований. Процесс протекает в ядре клетки.
РНК – также состоит из нуклеотидов. Это одноцепочечная молекула. Нуклеотид РНК представлен азотистыми основаниями (аденин, цитозин, урацил, гуанин), рибозой, фосфатом.
Дата добавления: 2016-11-02; просмотров: 1041 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
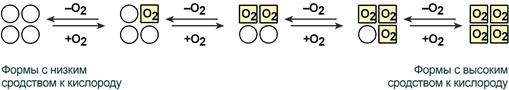
Схема кооперативного взаимодействия субъединиц гемоглобина
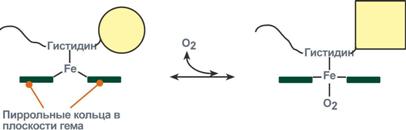
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
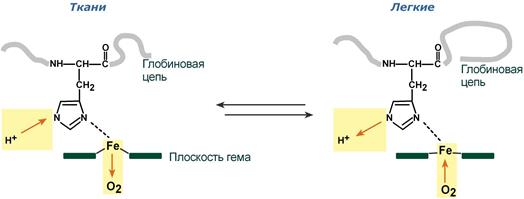
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
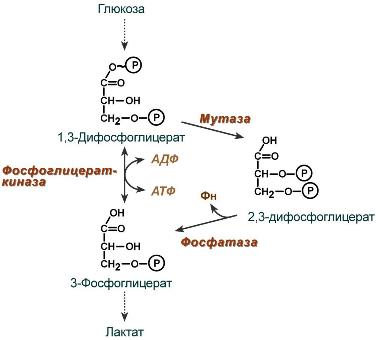
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
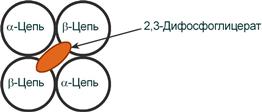
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.