Сродство гемоглобина к кислороду в тканях
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июля 2013;
проверки требуют 29 правок.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1892 году[1] и датским физиологом К. Бором в 1904 году[2].
История открытия[править | править код]
Основу разработки проблемы гипоксии заложил русский учёный-физиолог И. М. Сеченов фундаментальными работами по физиологии дыхания и газообменной функции крови. Большое значение имеют также исследования русского физиолога Б. Ф. Вериго по физиологии газообмена в лёгких и тканях. Опираясь на идеи Сеченова о сложных формах взаимодействия между диоксидом углерода и кислородом в крови (Вериго работал в лабораториях Сеченова, И. Р. Тарханова и И. И. Мечникова), он впервые установил зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в крови.
Биохимический механизм[править | править код]
Эффект Вериго — Бора: влияние pH на кривую насыщения гемоглобина кислородом
В клетках периферических тканей органическое топливо окисляется в митохондриях с использованием кислорода (клеточное дыхание), доставляемого гемоглобином из лёгких; при этом в качестве продуктов образуются углекислый газ, вода и другие соединения. Образование углекислого газа в тканях одновременно приводит и к повышению концентрации ионов H+ (то есть к понижению pH), поскольку при гидратации CO2 образуется H2CO3 — слабая угольная кислота, диссоциирующая на ионы H+ и бикарбонат-ионы:
H2CO3 ⇄ H+ + HCO3-.
Гемоглобин переносит значительную долю (около 20 %) общего количества CO2 и ионов H+, образующихся в тканях и поступающих в лёгкие и почки, обеспечивающих выделение этих продуктов.
За много лет до открытия этого механизма было обнаружено, что на связывание кислорода гемоглобином очень сильное влияние оказывает pH и концентрация CO2: при присоединении CO2 и ионов H+ способность гемоглобина связывать O2 снижается. Действительно, в периферических тканях с относительно низким значением pH и высокой концентрацией CO2 сродство гемоглобина к кислороду падает. И наоборот, в лёгочных капиллярах выделение CO2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином и называют эффектом Вериго — Бора.
Реакция связывания кислорода гемоглобином в виде
Hb + O2 ⇄ HbO2
в действительности отражает неполную картину, поскольку не учитывает дополнительные лиганды H+ и CO2.
Чтобы объяснить влияние концентрации ионов H+ на связывание кислорода, следует записать эту реакцию в иной форме:
HHb+ + O2 ⇄ HbO2 + H+,
где HHb+ — протонированная форма гемоглобина. Из этого уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации ионов H+. Гемоглобин связывает и O2, и ионы H+, но между этими двумя процессами существует обратная зависимость. Если парциальное давление кислорода велико (что наблюдается, например, в лёгких), то гемоглобин связывает его, освобождая при этом ионы H+. При низком парциальном давлении кислорода (что имеет место в тканях) связываться с гемоглобином будут ионы H+.
Эффективность связывания гемоглобином углекислого газа (с образованием карбаминогемоглобина, чаще именуемого карбгемоглобином[3]) находится в обратной зависимости от связывания кислорода. В тканях часть избыточного CO2 связывается с гемоглобином, сродство последнего к O2 снижается, и происходит высвобождение кислорода. В лёгких же связывается избыток O2 воздуха, тем самым сродство гемоглобина к CO2 уменьшается, и CO2 выделяется в альвеолярный воздух, способствуя лёгкому закислению крови за счёт ионов H+, возникающих при диссоциации угольной кислоты (см. выше).
Описанные зависимости делают молекулу гемоглобина великолепно приспособленной к осуществлению совместного переноса эритроцитами кислорода, углекислого газа и ионов H+[4].
См. также[править | править код]
- Эффект Холдейна (открыт Джоном Скоттом Холдейном)
Примечания[править | править код]
- ↑ Verigo B. F. Zur Frage über die Wirkung des Sauerstoff auf die Kohlensäureausscheidung in den Lungen // Archiv für die gesammte Physiologie des Menschen und der Thiere : статья. — 1892. — № 51. — С. 321—361.
- ↑ Chr. Bohr, K. Hasselbalch, and August Krogh. Concerning a Biologically Important Relationship — The Influence of the Carbon Dioxide Content of Blood on its Oxygen Binding // Skand. Arch. Physiol. : статья. — 1904. — № 16. — С. 401—412.
- ↑ Карбгемоглобин // Биологический энциклопедический словарь (рус.).
- ↑ Ленинджер А. Основы биохимии: В 3-х томах. Том 1. — М.: Мир, 1985. — С. 208—210. — 367 с.
Литература[править | править код]
- Вериго эффект // Большой медицинский словарь (рус.). — 2000.
Органические фосфаты, особенно 2,3-дифосфоглицерат (ДФГ), также оказывают влияние на сродство гемоглобина к кислороду. [c.171]
Численно сродство гемоглобина к кислороду принято выражать величиной Р д-парциальное напряжение кислорода, при котором 50% гемоглобина связано с кислородом (pH 7,4 температура 37°С). Нормальная величина Рз около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно, сопровождается повышением Рз . Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду, величина Рз снижена. [c.594]
РЕГУЛЯЦИЯ СРОДСТВА ГЕМОГЛОБИНА К КИСЛОРОДУ [c.364]
Возрастание интенсивности окислительных процессов в тканях, например при усиленной мышечной работе всегда связано с более полным извлечением кислорода из крови. Кроме того, при физической работе резко увеличивается скорость кровотока. Зависимость между степенью насыщения гемоглобина кислородом и Р ,, можно выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации оксигемоглобина, которая имеет 8-образную форму и характеризует сродство гемоглобина к кислороду (рис. 17.6). [c.593]
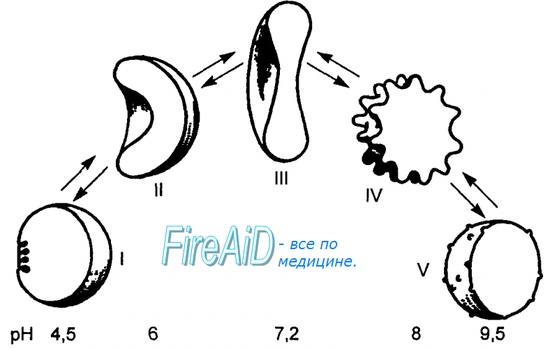
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с pH. Чем ниже pH, тем меньше способность гемоглобина связывать кислород и тем выше Рз . В тканевых капиллярах pH ниже (поступает большое количество СО,), в связи с чем гемоглобин [c.594]
Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления. [c.595]
Сродство гемоглобина к кислороду зависит от величины pH и содержания СОг. [c.171]
Влияние СОг, Н+ и ДФГ на сродство гемоглобина к кислороду и на кооперативность функционирования ассоциированных гемоглобиновых субъединиц описаны в гл. 5 (разд. 5.5.2). [c.406]
TOB промежуточного обмена, зависимых от АТФ. Они также угнетают активность некоторых ферментов, участвующих в гликолизе эритроцитов, и снижают содержание 2,3 – дифосфоглицерата красных кровяных клеток. В результате увеличивается сродство гемоглобина и кислорода, что может уменьшить поступление кислорода к тканям. [c.521]
Способность гемоглобина связывать кислород зависит от ряда факторов. Было обнаружено, в частности, что на связывание гемоглобином кислорода большое влияние оказывает pH среды и содержание СО . В тканях, где значение pH несколько меньшее по сравнению с легкими, а концентрация Oj достаточно высока, сродство гемоглобина к кислороду снижается, кислород отделяется, а Oj и протон водорода присоединяются к гемоглобину. Напротив, в альвеолах легких при освобождении Oj происходит повышение pH и сродство гемоглобина к кислороду увеличивается (рис. 3.18). Этот феномен называется эффектом Бора в честь ученого, впервые открывшего это явление. В реализации данного эффекта кроме гемоглобина и кислорода участвуют СО2 и протон водорода. Дезоксигемоглобин представляет собой прото-нированную форму пигмента. Реакцию оксигенации можно записать следующим образом [c.51]
Окись углерода является одним из самых опасных ядов. Она имеет в 300 раз большее сродство с гемоглобином, чем кислород. Попав через легкие в кровь, она очень легко соединяется с гемоглобином крови, вытесняя кислород. Кровь теряет способность доставлять тканям необ одимый для жизни кислород, вследствие чего наступает кислородное голодание. Кроме того, окись углерода оказывает непосредственное отравляющее действие на центральную нервную систему. [c.729]
Уже давно известно, что 2,3-дифосфоглицерат (рис. 1) присутствует в эритроцитах в довольно высоких концентрациях, однако функция этого соединения оставалась загадкой до тех пор, пока не было обнаружено, что он оказывает сильное влияние на сродство гемоглобина к кислороду. При добавлении 2,3-дифосфоглицерата (ДФГ) к раствору [c.211]
Другим физиологически важным свойством гемоглобина является увеличение его кислотности при насыщении кислородом. Обратный процесс — уменьшение сродства гемоглобина к кислороду при его окислении в среде с физиологическим pH — [c.422]
Например, из данных рис. 156 ясно видно, что в реакции гемоглобина с кислородом принимают участие четыре участка. Их легко идентифицировать как четыре атома железа в этой макромолекуле, так как известно много металлосодержащих комплексных соединений, способных связывать молекулярный кислород. Большинство из них—комплексы Со ” , однако известен также ряд комплексов Ре ” , обладающих этим же свойством. Вместе с тем неизвестен ни один комплекс Ре-” , сродство которого к О2 было бы равно сродству Ре , содержащегося в гемоглобине. [c.617]
Водородные ионы могут вызывать еще один отрицательный эффект, опять-таки сходный с механизмом воздействия некоторых отрицательных модуляторов на ферментативный катализ. Снижение pH может уменьшать и максимальную способность гемоглобина связывать кислород, т. е, ион водорода понижает не только сродство гемоглобина к О2, но и характеристику, аналогичную l max- для ферментов (рис. 115,5). Это влияние pH на кислородную емкость гемоглобина называют эффектом Рута. Сильно выраженный эффект Рута часто сопутствует большому эффекту Бора. [c.364]
В регуляции сродства гемоглобина к кислороду могут также участвовать низкомолскулярные вещества, образующиеся внутри эритроцитов. Например, в эритроцитах млекопитающих сродство НЬ к О2 уменьшается с увеличением концентрации [c.364]
Это наблюдается в подвергнутых электродиализу бессолевых растворах белка [20, 53]. Соединение двуокиси углерода с гемоглобином имеет большое значение в физико-химическом равновесии крови, поскольку в присутствии углекислоты сродство гемоглобина к кислороду снижается — явление, хорошо известное в физиологии. Влияние углекислоты на сродство гемоглобина к кислороду обусловлено тем, что двуокись углерода соединяется с основными аминогруппами или имидазольными группами, расположенными в непосредственной близости к атому железа, к которому присоединяется кислород [52, 54]. [c.88]
Синтезированная недавно модель кобальтзамещенного гемоглобина приведена на схеме 6.1 [245]. Длинная боковая цепь обеспечивает координацию пиридинового кольца с центральным атомом кобальта. Комплекс Со(П) и этого так называемого петлеобразного порфирина обратимо реагирует с молекулярны.м кислородом при низких температурах (от —30 до — G0° ), но боковая цепь лишь в незначительной степени увеличивает сродство кислорода к таким модельным соединениям по сравнению с жслсзопорфириновыми системами. [c.371]
НОМ очень сильное влияние оказывает pH и концентрация СО2 связывание СО2 и ионов Н снижает способность гемоглобина связывать О2. В периферических тканях с относительно низким значением pH и высокой концентрацией СО2 сродство гемоглобина к кислороду падает по мере связывания СО2 и ионов Н . И наоборот, в легочных капиллярах выделение СО2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации СО2 на связывание и освобождение кислорода гемоглобином назьшают эффектом Бора в честь датского физиолога Христиана Бора, впервые открьшшего этот эффект. [c.209]
В тетрамерном гемоглобине сродство гема к Оа контролируется концентрациями О2, СО2, и 2,3-дифосфоглицерата. Что же было достигнуто в результате эволюции мономерного гемоглобина типа миоглобина в сложный гемоглобин млекопитающих Основное преимущество заключается в возросшей физиологической приспособляемости тетрамерного белка, которая достигнута за счет постепенного перевода сродства к кислороду, свойственного центру связывания, под контроль внеии1их влияний [276, 549, 667] (рис. 10.4). [c.257]
Дана зависимость насыщения гемоглобина (НЬ) кислородом при pH 7,2 от концентрации свободного кислорода. Концентрации 0 в капиллярах легких (125 мкМ) н в капиллярах тканей, потребляющих (50 мкМ), зафиксированы в узких пределах. Кривая а в отсутствие дифосфоглицерата (ДФГ) гемоглобин насыщается О в легких, но не может доставлять его к тканям. Кривая б прн физиологическом уровне ДФГ (4.5 мМ. приблизительно 30% Оа. поглощенного легкими, высвобождается в тканях (стрелка 1). Кривые бив поскольку гемоглобин плода (кривая в) имеет более низкое сродство к ДФГ. чем материнский гемоглобин, освобожденный из материнской крови молекулярный кислород может захватываться гемоглобином плода (стрелка [[I). Кривая г высокая концентрация ДФГ (8 мМ) приводит к повышенному снабжению тканей кислородом (стре.жи I и [[). Кривая д при отсутствии кооператнвиостн между субъединицами гемоглобина от легких к тканям транспортировалось бы меньше Оз. При построении гипотетической кривой связывания (5) для комплекса НЬОз принята константа диссоциации 38 мкМ. [c.258]
Физиологический смысл S-образности кривой У(р) для НЬ состоит в падении сродства гемоглобина к кислороду по мере отщепления его молекул. Изменения парциального давления О2 в тканях должны быть невелики. Если бы для гемоглобина была характерна гиперболическая кривая Y(p), подобная кривой Y(р) для миоглобина, то лищь малая доля переносимого О2 отщеплялась бы в тканях. [c.425]
Важной особенностью гемоглобина, которая обусловлена наличием нескольких гем-групп, является форма кривой связывания кислорода не простая гиперболическая кривая насыщения, как для миоглобина, а S-образная. Сродство гемоглобина к кислороду возрастает с давлением. Поэтому при умеренных давлениях гемоглобин эффективно связывает кислород в легких, но отдает его миоглобину при низких давлениях в тканях. При потере кислорода образуется дезоксигемоглобин, субъединицы молекулы слегка смещаются относительно друг друга и поворачиваются так, что два р-гема удаляются друг от друга на расстояние около 6,5 А. Эта конформационная перестройка, несомненно, тесно связана с кооперативным взаимодействием гемов, которое позволяет им более прочно связывать кислород, когда молекула уже частично окислена. Однако детали этого взаимодействия еще не ясны. В концентрированных солевых растворах (например, в 4 М Na l) молекула [c.375]
Рассмотренным выще сезонным изменениям сродства гемоглобина к кислороду на эволюционном уровне соответствует генетическая адаптация эктотермных организмов к различным температурным режимам. Гемоглобины эктотермных видов способны присоединять и отдавать кислород именно при тех условиях температуры и содержания Ог в среде, которые типичны для местообитания данного вида. Это обусловлено сильным давлением отбора в пользу таких величин Р о, которые достаточно низки для того, чтобы кислород мог эффективно связываться у дыхательных поверхностей, но еще достаточно высоки, чтобы он мог легко освобождаться в более глубоких тканях. Эту эволюционную адаптацию иллюстрируют графики на рис. 118. Так же как и в случае эволюционной адаптации ферментов к температуре, где отбор благоприятствует ферментам с подходящими величинами Км. или 5о,5, выработка хорощо адаптированных гемоглобинов, по-видимому, требует изменений в первичной структуре их полипептидных цепей. Попутно следует заметить, что гем оказался одним и тем же во всех исследованных гемоглобинах. Таким образом, гем, который мы могли бы назвать почетным коферментом гемоглобина, аналогичен настоящим коферментам вроде, например, НАД или НАДФ, которые тоже обнаруживают одни и те же химические и функциональные свойства независимо от того, какие изменения происходят в связанной с ними белковой цепи (или цепях). [c.374]
Но теперь снова возникает ряд вопросов. В чем состоит особенность структуры гемоглобина, обеспечивающая эти выгодные для организма изменения сродства гемоглобина к кислороду, находящиеся в обратной зависимости от его сродства к СО2 и ионам Н Как информация о связывании лиганда передается от одной полипептвдной субъединицы гемоглобина к другой Почему гемоглобин обладает такими свойствами, а миоглобин нет [c.210]
ЧИСТОГО гемоглобша сродство гемоглобина к кислороду значительно снижается. Этот эффект обусловлен тем, что ДФГ сам связывается с дезоксигемоглобином. Следовательно, можно написать уравнение еще одной (четвертой по счету) реакции связьшания гемоглобина с лигандом [c.212]
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. После того как здоровый человек поднимется, скажем, на высоту 4000 м над уровнем моря, в течение первых нескольких часов концентрация ДФГ в его эритроцитах будет возрастать при этом число молекул ДФГ, связанных с >гемоглобином, увеличится, а сродство гемоглобина к кислороду снизится. На большой высоте парциальное давление кислорода значительно ниже, чем на уровне моря. Поэтому и в тканях парциальное давление кислорода снижается. Увеличение содержания ДФГ в эритроцитах при восхождении на большую высоту облегчает освобождение кислорода из гемоглобина в тканях. Изменения противоположного характера наблюдаются у людей, акклиматизировавшихся к условиям высокогорья, например у жителей Гималаев или Андов, когда они спускаются в долины. Повьш1ение концентрации [c.212]
При обычном вьзделении гемоглобина из крови он содержит довольно большое количество ДФГ, от которого трудно освободиться полностью. При полном удалении ДФГ из гемоглобина кривая связывания его с кислородом в значительной степени утрачивает свою сигмоидную форму и гемоглобин приобретает намного более высокое сродство к кислороду. После добавления избытка ДФГ к гемоглобину способность последнего к связыванию кислорода понижается (рис. 2). Таким образом, присутствие ДФГ весьма существенно для нормального освобождения кислорода из гемоглобина в тканях. В эритроцитах некоторых птиц содержится не ДФГ, а другое фосфатсодержащее со-единенш-инозитолгексафосфат, который даже еще более эффективно, чем ДФГ, снижает сродство гемоглобина к кислороду. [c.213]
Р тщательно удалить весь 2,3-дифосфоглицерат (ДФГ), кривые их насыщения кислородом сместятся влево (т.е. сродство гемоглобинов к кислороду повысится). Однако у гемоглобина А сродство к кислороду при этом становится выше, чем у гемоглобина Р. Если в препараты гемоглобина вновь добавить ДФГ, то кривые насьпцения кислородом примут прежний вид, показанный на рисунке. Какое влияние оказывает ДФГ на сродство гемоглобина к кислороду Как на основе приведенной вьппе информации можно объяснить различие в сродстве к кислороду у гемоглобинов матери и плода [c.225]
Важным регулятором степени оксигенирования гемоглобина служит 2,3-бис-фосфоглицерат (БФГ). Чем выше концентрация БФГ в клетке, тем ниже сродство гемоглобина к кислороду. В случаях когда доставка кислорода в ткани оказывается хронически недостаточной, как это бывает у людей с пониженным содержанием эритроцитов в крови или у обитателей высокогорья, концентрация БФГ в эритроцитах оказывается выше, чем у здоровых людей, живуцщх на уровне моря. Этот биохимический сдвиг способствует тому, что гемоглобин легче отдает тканям связанный кислород, и тем самым компенсируется снижение количества кислорода, связываемого гемоглобином в легких. [c.769]
Физиологический смысл 5-сбразной формы кривой на рис. 31 состоит в том, чтобы помочь гемоглобину освободиться от кислорода в процессе переноса его в клетки ткани там и тогда, где и когда кислород более необходим, а именно там, где парциальное давление кислорода минимально. Большинство типичных гемоглобйнов обнаруживает и другие необычные вариации Р1/2, которые также выполняют определенную физиологическую функцию. На рис. 32 показано, как меняется lg l/2 в зависимости от pH. Это так называемый эффект Бора. Выше pH 6 (щелочной эффект Бора) повышение рн приводит к росту сродства гемоглобина к кислороду, и, наоборот, присоединение кислорода сопровождается освобождением протона. При физиологическом pH это соответствует 0,7 протона на каждый гем [169]. Щелочный эффект Бора выполняет две физиологические функции. Во-первых, ткани, потребляющие кислород, [c.165]
Второй важный аспект влияния температуры на перенос газов кровью касается сродства гемоглобина к кислороду. Если мы вспомним, что было сказано ранее о температурной зависимости сродства ферментов к субстратам, об аналогии между ферментами и гемоглобином, то не будем удивлены, узнав, что величины Ры) для большинства изученных гемоглобинов при снижении температуры уменьшаются. Направление этого изменения Ръо противоположно тому, которое мы могли бы оценить как выгодное для организма, так как с повышеннем температуры одновременно уменьшаются и количество кислорода у дыхательной поверлнисш, и эффективность связывания его гемоглобином. [c.372]
Сродство гемоглобина к кислороду уменьшается в присутствии солей [162]. Это сродство, однако, возрастает в концентрированных растворах мочевины, в которых молекулы гемоглобина подвергаются дезагрегации [116, 163]. Подкисление растворов т емоглобина углекислотой или другими кислотами уменьшает сродство гемоглобина к кислороду. Это явление представляет собой процесс, обратный описанному выше эффекту Бора, — увеличению кислотности (способности связывать основания) при переходе гемоглобина в оксигемоглобин [116]. Указанные явления объясняют наличием в глобине ионной группы, находящейся рядом с группой, связывающей железо и влияющей на сродство железа к кислороду. [c.249]
Хотя спектр поглощения и сродство гемоглобина к кислороду являются функцией простетической группы, оба эти свойства до определеппой степени зависят и от глобина. Так, например, рас-сюяпие между максимумами поглощения оксигемоглобина и [c.253]
Газовая хроматография в биохимии (1964) — [
c.164
,
c.165
]