Сродство гемоглобина кислороду что это

Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Источник
Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей.
КИСЛОРОДНАЯ ЕМКОСТЬ КРОВИ –максимальное количествокислорода, обратимо связанное кровью; выражается в объемных процентах; зависит от концентрации в кровигемоглобина. Кислородная емкость крови человека ок. 18-20%.
Оксигемометрия— фотометрический метод измерения степени насыщения артериальной крови кислородом, т. е. процентного содержания в ней гемоглобина в форме оксигемоглобина. Оксигемометрия позволяет судить, насколько полно осуществляется оксигенация крови в легких, так как она дает объективный показатель эффективности внешнего дыхания и кровообращения. Оксигемометрию используют для выявления гипоксемической циркуляторной гипоксии (см.). О. производят специальными приборами — оксигемометрами.
Пульсоксиметрия — методика определения количества кислорода, связанного с гемоглобином, в артериальной крови. К каждой молекуле гемоглобина может присоединится до четырех молекул кислорода. Средний процент насыщения молекул гемоглобина является кислородной сатурацией крови. 100% сатурация означает, что ккаждая молекула гемоглобина в исследуемом объеме крови переносит четыре молекулы кислорода.
Вопрос 48.
1885г. Миславский Н.А.
«Д.Ц. – центр жизни.»
Д.Ц. – парное образование расположенное в продолговатом мозге справа и слева от его дорсальной срединной борозды и обеспечивающее автоматическую смену фаз дыхания.
Виды нейронов дыхательного центра
1. H-пейсмекеры – автоматические нейроны.
2. Инспираторные нейроны (И.Н.)
3. Экспираторные нейроны (Э.Н.)
4. Переходные (инспираторно-экспираторные нейроны, И.-Э., Э.-И.)
Нейроны дыхательного центра образуют скопление в виде дыхательных или респираторных функций.
1. Дорсальная респираторная группа.
· Имеет медиальное расположение
· В основном нейроны вдоха (И.Н.)
· Контролирует мотонейроны диафрагмы
· Обеспечивает рефлекс Геринга-Брейера (рефлекс переключения вдоха на выдох)
· Получает сигналы от рецепторов растяжения легких по блуждающим нервам
· Получает сигналы от рецепротов растяжения легких по блуждающим нервам
· Получает сигналы от верхних структур Г.М., а так же от хемо- и баро- рецепторов сосудов.
2. Вентральная респираторная группа VRG
· ИН+ЭК
· Передает сигналы к мотонейронам для наружных и внутренних межреберных мышц
· 3-pre-Botzinger – комплекс (пейсмекеры)
· Botzinger-complex Э.Н.
· Содержит пейсмекерные нейроны
Источник
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
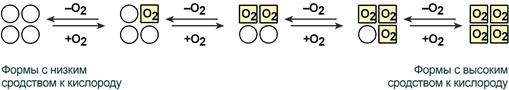
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
факторы.
Под действием перечисленных факторов изменяется степень сродства гемоглобина к
кислороду, что оказывает влияние на скорость взаимодействия между ними, прочность
связи и быстроту диссоциации НbО2 в капиллярах тканей, а это очень важно, так как в
клетки тканей проникает только физически растворенный
Рис. 16-7.
Кривая диссоциации оксигемоглобина: раО2 – рО2 в артериальной крови; SаО2 – насыщение
гемоглобина артериальной крови кислородом; СаО2 – содержание кислорода в
артериальной крови
Рис. 16-8.
Влияние различных факторов на кривую диссоциации оксигемоглобина: А – температуры, Б – рН, В – раСО2
в плазме крови кислород. В зависимости от изменения степени сродства гемоглобина к
кислороду происходят сдвиги кривой диссоциации оксигемоглобина. Если в норме
превращение 50% гемоглобина в НbО2 происходит при раО2, равном 26,6 мм рт.ст., то при
снижении сродства между гемоглобином и кислородом это имеет место при 30-32 мм
рт.ст. В результате кривая смещается вправо. Сдвиг кривой диссоциации НbО2 вправо
происходит при метаболическом и газовом (гиперкапния) ацидозе, при повышении
температуры тела (лихорадка, перегревание, лихорадоподобные состояния), при
увеличении содержания АТФ и 2,3-ДФГ в эритроцитах;
накопление последнего имеет место при гипоксемии, различных видах анемий (особенно
при серповидно-клеточной). При всех указанных состояниях увеличивается быстрота
отщепления кислорода от НbО2 в капиллярах тканей, и вместе с тем замедляется скорость
оксигенации гемоглобина в капиллярах легких, что ведет к снижению содержания
кислорода в артериальной крови.
Сдвиг кривой диссоциации НbО2 влево происходит при увеличении сродства
гемоглобина к кислороду и наблюдается при метаболическом и газовом (гипокапния) алкалозе, при общей гипотермии и в участках местного охлаждения тканей, при
понижении содержания в эритроцитах 2,3-ДФГ (например, при сахарном диабете), при
отравлении окисью углерода и при метгемоглобинемии, при наличии в эритроцитах
больших количеств фетального гемоглобина, что имеет место у недоношенных детей. При
сдвиге влево (вследствие повышения сродства гемоглобина к кислороду) ускоряется
процесс оксигенации гемоглобина в легких, и вместе с тем замедляется процесс
дезоксигенации НbО2 в капиллярах тканей, что ухудшает снабжение клеток кислородом, в том
числе клеток ЦНС. Это может вызвать ощущение тяжести в голове, головную боль и тремор.
Снижение транспорта кислорода к тканям будет наблюдаться при уменьшении
кислородной емкости крови вследствие анемии, гемодилюции, образования карбокси- и
метгемоглобина, не участвующих в транспорте кислорода, а также при понижении
сродства гемоглобина к кислороду. Снижение содержания НbО2 в артериальной крови
происходит при усиленном ее шунтировании в легких, при пневмонии, отеке, эмболии a.
pulmonalis. Доставка кислорода тканям уменьшается при снижении объемной скорости
кровотока в связи с сердечной недостаточностью, гипотонией, снижением объема
циркулирующей крови, расстройством микроциркуляции вследствие уменьшения
количества функционирующих микрососудов из-за нарушения их проходимости или
централизации кровообращения. Доставка кислорода становится недостаточной при
увеличении расстояния между находящейся в капиллярах кровью и клетками тканей в
связи с развитием интерстициального отека и гипертрофией клеток. При всех указанных
нарушениях может развиться гипоксия.
Важным показателем, позволяющим определить количество кислорода, поглощенное
тканями, является индекс утилизации кислорода, который представляет собой
умноженное на 100 отноше-
ние артериовенозной разницы по содержанию кислорода к объему его в артериальной
крови. В норме при прохождении крови через тканевые капилляры используется клетками
в среднем 25% поступающего кислорода. У здорового человека индекс утилизации
кислорода существенно возрастает при физической работе. Повышение этого индекса
происходит также при пониженном содержании кислорода в артериальной крови и при
уменьшении объемной скорости кровотока; индекс будет снижаться при уменьшении
способности тканей утилизировать кислород.
16.2.2. Транспорт углекислого газа и его нарушения
Парциальное давление СО2 (рСО2) в артериальной крови такое же, как в альвеолах, и
соответствует 4,7-6,0 кПа (35-45 мм рт.ст., в среднем 40 мм рт.ст.). В венозной крови рСО2
равно 6,3 кПа (47 мм рт.ст.). Количество транспортируемого СО2 в артериальной крови
равняется 50 об.%, а в венозной – 55 об.%. Примерно 10% этого объема физически
растворено в плазме крови, и именно эта часть углекислоты определяет напряжение газа в
плазме; еще 10-11% объема СО2 транспортируется в виде карбгемоглобина, при этом
восстановленный гемоглобин более активно, чем оксигемоглобин, связывает углекислоту.
Остальной объем СО2 переносится в составе молекул бикарбоната натрия и калия,
которые образуются при участии фермента карбоангидразы эритроцитов. В капиллярах
легких по причине превращения гемоглобина в оксигемоглобин связь СО2 с гемоглобином
становится менее прочной и происходит его превращение в физически растворимую
форму. Вместе с тем образующийся оксигемоглобин, являясь сильной кислотой, отнимает
калий от бикарбонатов. Образовавшаяся при этом Н2СО3 расщепляется под действием
карбоангидразы на Н2О и СО2, и последний диффундирует в альвеолы.
Транспорт СО2 нарушается: 1) при замедлении кровотока; 2) при анемиях, когда
уменьшается связывание его с гемоглобином и включение в бикарбонаты из-за недостатка
карбоангидразы (которая содержится только в эритроцитах).
На парциальное давление СО2 в крови существенное влияние оказывает понижение или
повышение вентиляции альвеол. Уже незначительное изменение парциального давления
СО2 в крови влияет на мозговое кровообращение. При гиперкапнии (вследствие
гиповентиляции) сосуды мозга расширяются, повышается
внутричерепное давление, что сопровождается головной болью и головокружением.
Уменьшение парциального давления СО2 при гипервентиляции альвеол снижает мозговой
кровоток, при этом возникает состояние сонливости, возможны обмороки.
16.2.3. Гипоксия
Гипоксия (от греч. hypo – мало и лат. oxigenium – кислород) – состояние, возникающее
при недостаточном поступлении кислорода в ткани или при нарушении его
использования клетками в процессе биологического окисления.
Гипоксия является важнейшим патогенетическим фактором, играющим ведущую роль в
развитии многих заболеваний. Этиология гипоксии отличается большим разнообразием, вместе с тем ее проявления при различных формах патологии и компенсаторные реакции, возникающие при этом, имеют много общего. На этом основании гипоксию можно
считать типическим патологическим процессом.
Виды гипоксии. В.В. Пашутин предложил различать два вида гипоксии –
физиологическую, связанную с повышенной нагрузкой, и патологическую. Д. Баркрофт
(1925) выделил три вида гипоксии: 1) аноксическую, 2) анемическую и 3) застойную.
В настоящее время используется классификация, предложенная И.Р. Петровым (1949), который разделил все виды гипоксии на: 1) экзогенную, возникающую при понижении
рО2 во вдыхаемом воздухе; она была подразделена, в свою очередь, на гипо- и
нормобарическую; 2) эндогенную, возникающую при различного рода заболеваниях и
патологических состояниях. Эндогенная гипоксия представляет собой обширную группу, и в зависимости от этиологии и патогенеза в ней выделены следующие виды: а)
Источник


