Структура белка гемоглобина поддерживается
Тема 1. Молекулярный уровень.
Химический состав клетки. Вирусы
Вариант 1
Часть 1
Выберите правильный ответ.
А1. 98% массы живых организмов составляют четыре химических элемента, это
Сера, фосфор, азот, хлор
Водород, углерод, кислород, азот
Кремний, железо, кислород, алюминий
Калий, натрий, кислород, углерод
А2. Основная функция углеводов в клетке
Ферментативная
Энергетическая
Регуляторная
Хранение наследственной информации
А3. Жиры, как и углеводы, выполняют функции
Каталитическую и энергетическую
Строительную и каталитическую
Информационную и регуляторную
Строительную и энергетическую
А4. Первичная структура белка поддерживается связями
Водородными
Гидрофобными
Ионными
Пептидными
А5. В результате объединения нескольких полипептидных цепей в сложный комплекс возникает структура
Первичная
Вторичная
Третичная
Четвертичная
А6. Регуляторную функцию выполняют
белки- ферменты
белки-антитела
белки-гормоны
транспортные белки
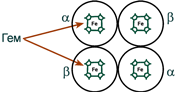
А7. Изображенная на рисунке структура белка гемоглобина поддерживается
водородными связями между –NH и -CO группами
пептидными связями между аминокислотами
связями между радикалами
связями между разными полипептидными цепями
А8. Двойная спираль ДНК поддерживается связями между нуклеотидами. Это связи
ионные
ковалентные
водородные
гидрофобные
А9. Молекулы РНК, в отличие от ДНК, имеют в своем составе
рибозу
дезоксирибозу
аденин
тимин
А10. Среди перечисленных организмов клеточного строения не имеют
инфузория – туфелька
вирус гриппа
кишечная палочка
хламидомонада
Часть 2
В1. Выберите три правильных ответа из шести.
Какие из характеристик относятся к вторичной структуре белка?
Поддерживается ковалентными связями
Поддерживается водородными связями
Представляют собой спираль
Представляют собой глобулу
Очень прочная структура
Непрочная структура
В2. Установите соответствие между группой организмов и их характеристиками (ответ – последовательность цифр)
Характеристика
Организмы
А) могут быть изучены с помощью светового микроскопа
Б) могут быть изучены с помощью электронного микроскопа
В) не имеют собственного аппарата для синтеза белка
Г) синтез белка происходит на рибосомах
Д) тело состоит из одной клетки
Е) неклеточные организмы
Вирусы
Простейшие
В3. Вставьте в текст пропущенные определения из предложенного перечня, используя для этого цифровые обозначения.
Запишите ответ в виде последовательности цифр.
Функции белков в клетке разнообразны. Белки, ускоряющие химические реакции в клетке, называются _________ (А). Ряд белков обеспечивает перенос различных веществ в организме и в клетке. Примером транспортного белка может служить ________(Б). Защитную функцию выполняют белки – _________(В). Некоторые белки выполняют регуляторную функцию, например _________(Г).
Термины
инсулин
гемоглобин
антитела
ферменты
мономеры
липиды
Часть 3
С1. Рассчитайте длину двухцепочечного фрагмента ДНК, включающего 40000 нуклеотидов, если известно, что расстояние между соседними нуклеотидами составляет 34*10 -11м.
Тема 1. Молекулярный уровень.
Химический состав клетки. Вирусы
Вариант 2
Часть 1
Выберите правильный ответ.
А1. Химический элемент, входящий в состав гемоглобина крови, – это
медь
кальций
железо
магний
А2. В качестве запасного углевода гликоген используется в клетках
элодеи
собаки
вируса гриппа
картофеля
А3. Благодаря какому свойству липиды составляют основу плазматической мембраны?
Способность изменять пространственную структуру
Нерастворимость в воде
Способность к самоудвоению
Наличие каталитической активности
А4. Последовательность аминокислот, соединенных в полипептидную цепь, – структура
Первичная
Вторичная
Третичная
Четвертичная
А5. Вторичная структура белка поддерживается связями
водородными
гидрофобными
ионными
пептидными
А6. Двигательная функция белков обеспечивает
перенос различных веществ
прием сигналов из внешней среды
сокращение мышц
ускорение химических реакций
А7. Какой процесс изображен на рисунке?
Размножение вируса
Удвоение ДНК
Синтез иРНК
Денатурация белка
А8. Последовательность нуклеотидов одной цепи ДНК составляет ЦГ ТГАТ. Комплементарная ей цепь
ЦГТГАТ
АТЦАЦГ
ЦГАЦАТ
ГЦАЦТА
А9. В состав РНК не входит азотистое основание
аденин
тимин
урацил
цитозин
А10. Из множества свойств живых организмов для вирусов характерно наличие
обмена веществ
раздражимости
наследственности
клеточного строения
Часть 2
В1. Выберите три правильных ответа из шести.
Липиды выполняют в клетке следующие функции
структурную
информационную
ферментативную
энергетическую
защитную
сигнальную
В2. Установите соответствие между структурами белка и её характеристиками (ответ -последовательность цифр)
Характеристика
Организмы
А) неустойчивая
Б) прочная
В) поддерживается ковалентными связями между остатками аминокислот
Г) поддерживается связями между радикалами
Д) пространственная конфигурация в виде глобулы
Е) аминокислотная последовательность
1) первичная
2) третичная
В3. Вставьте в текст пропущенные определения из предложенного перечня, используя для этого цифровые обозначения.
Запишите ответ в виде последовательности цифр.
Молекулы _________(А) имеют структуру двойной спирали. При образовании двойной спирали __________(Б) располагаются в строго определенном порядке, так что напротив аденина всегда располагается тимин, а напротив гуанина – цитозин. Такие пары называются ________(В). Структура двойной спирали поддерживается _________(Г).
Термины
водородные связи
пептидные связи
остатки фосфорной кислоты
азотистые основания
ДНК
комплементарные
Часть 3
С1. Как объяснить изменения, происходящие с яичным белком во время жарки (или варки), и почему после прекращения воздействия температуры белок не возвращается в исходное состояние?
Тема 1. Молекулярный уровень.
Химический состав клетки. Вирусы
Вариант 3
Часть 1
Выберите правильный ответ.
А1. Химический элемент, необходимый для нормальной работы щитовидной железы, – это
фтор
хлор
бром
йод
А2. Строительную функцию выполняет углевод
крахмал
гликоген
целлюлоза
глюкоза
А3. общим свойством липидов является то, что все они
гидрофильные вещества
гидрофобные вещества
полярные вещества
полимерные вещества
А4. Денатурация белка обратима, если не разрушены связи
пептидные
водородные
гидрофобные
ионные
А5. Третичную структуру белка поддерживают
пептидные связи между аминокислотами
связи между радикалами
связи между разными полипептидными цепями
водородными связями между –NH и -CO группами
А6. Способность белков изменять пространственную структуру под действием внешних факторов лежит в основе функции
строительной
защитной
сигнальной
энергетической
А7. На рисунке изображен полипептид. Пептидная связь обозначена буквой
А 2) Б 3) В 4) Г
А8. Пары нуклеотидов аденин-тимин и гуанин-цитозин являются
комплементарными
ферментативными
транспортными
параллельными
А9. Матрицей для синтеза первичной структуры белка является молекула
т-РНК 3) и-РНК
р-РНК 4) АТФ
А10. Вирусы проявляют свойства живого только
в клетках других организмов
во внешней среде
при взаимодействии с другими вирусами
при благоприятных условиях внешней среды
Часть 2
В1. Выберите три правильных ответа из шести.
В состав нуклеотида молекулы ДНК может входить
рибоза
дезоксирибоза
глюкоза
аденин
урацил
остаток фосфорной кислоты
В2. Установите соответствие между видом углевода и его особенностями (ответ -последовательность цифр)
Особенности
Углевод
А) полисахарид
Б) моносахарид
В) хорошо растворяется в воде
Г) не растворяется в воде
Д) входит в состав клеточных стенок растений
Е) основной источник энергии
1) целлюлоза
2) глюкоза
В3. Вставьте в текст пропущенные определения из предложенного перечня, используя для этого цифровые обозначения.
Запишите ответ в виде последовательности цифр.
В результате соединения аминокислот в цепь формируется ________(А) структура белка, которая поддерживается ______ (Б) связями. Затем эта цепь сворачивается в спираль и получается ________ (В) структура. Она поддерживается непрочными ________ ( Г) связями.
Термины
первичный
вторичный
третичный
гидрофобный
водородный
пептидный
Часть 3
С1. Чем можно объяснить необычайное разнообразие функций молекул белка?
Тема 1. Молекулярный уровень.
Химический состав клетки. Вирусы
Вариант 4.
Часть 1.
Выберите правильный ответ.
А1. Химический элемент, в значительном количестве входящий в состав костной ткани
калий
натрий
кальций
железо
А2. Полисахаридом не является
глюкоза
целлюлоза
крахмал
гликоген
А3. Пример регуляторной функции липидов
инсулин
гемоглобин
половые гормоны
хитин
А4. Пептидная связь по своей природе является
ковалентной
ионной
водородной
донорно-акцепторной
А5. Трехмерная пространственная конфигурация молекулы белка в виде глобулы – это структура
первичная
вторичная
третичная
четвертичная
А6. Ферменты выполняют функции
строительную
энергетическую
двигательную
каталитическую
А7. Какими связями поддерживается структура белка, изображенная на рисунке
пептидными
водородными
ионными
дисульфидными
А8. Мономерами ДНК являются
нуклеотиды
аминокислоты
моносахариды
остатки фосфорной кислоты
А9. Перенос аминокислот к месту синтеза белка осуществляют молекулы
т-РНК 3) р-РНК
и-РНК 4) ДНК
А10. Вирусным заболеванием не является
грипп
СПИД
оспа
туберкулез
Часть 2.
В1. Выберите три правильных ответа из шести.
Молекулы РНК выполняют следующие функции в клетке
переносят от ДНК к рибосомам информацию о первичной структуре белка
доставляют аминокислоты к рибосомам
являются запасным источником энергии
хранят наследственную информацию
входят в состав плазматической мембраны
входят в состав рибосом
В2. Установите соответствие между видом нуклеиновой кислоты и её характеристикой (ответ -последовательность цифр)
Характеристика
Нуклеиновая кислота
А) двойная спираль
Б) одинарная цепь, свернутая в виде клеверного листа
В) обеспечивает хранение и передачу наследственной информации
Г) доставляет аминокислоты к месту синтеза белка
Д) имеет в своем составе рибозу
Е) содержит азотистое основание тимин
тРНК
ДНК
В3. Вставьте в текст пропущенные определения из предложенного перечня, используя для этого цифровые обозначения.
Запишите ответ в виде последовательности цифр.
Неклеточные организмы – это _______ (А). Они имеют очень простое строение: молекула _________( Б) и вокруг нее белковая оболочка – __________ (В). Тем не менее, они считаются живыми организмами, т.к. обладают ___________ (Г).
Термины
нуклеиновая кислота
раздражимость
капсид
вирусы
бактерии
наследственность
Часть 3.
С1. Последовательность нуклеотидов одной цепи фрагмента ДНК составляет ЦЦГТТАГАЦ. Запишите последовательность нуклеотидов комплементарной цепи и рассчитайте общее число водородных связей между нуклеотидами данного фрагмента ДНК.
Тема 1. Молекулярный уровень.
Химический состав клетки. Вирусы
Вариант 5.
Часть 1.
Выберите правильный ответ.
А1. Химический элемент, входящий в состав белков и нуклеиновых кислот, – это
сера
азот
хлор
магний
А2. Мономером крахмала, гликогена, целлюлозы и основным источником энергии в клетке является
рибоза
дезоксирибоза
хитин
глюкоза
А3. Подкожный жир у белого медведя выполняет функцию
защитную
строительную
каталитическую
сигнальную
А4. Восстановление природной структуры белка невозможно, если разрушена структура
первичная
вторичная
третичная
четвертичная
А5. Вторичная структура белка представляет собой
несколько полипептидных цепей
аминокислотную последовательность
полипептидную цепь, закрученную в спираль
спираль, упакованную в клубок
А6. Защитную функцию выполняют
ферменты
антитела
антигены
сократительные белки
А7. На рисунке изображен дипептид. Буквой Б на нем обозначена
карбоксильная группа
аминогруппа
пептидная группа
радикал
А8. Комплементарной является пара нуклеотидов
аденин – гуанин
гуанин – тимин
гуанин – цитозин
цитозин – аденин
А9. Информация о первичной структуре белка доставляется к рибосомам при помощи
тРНК 3) рРНК
иРНК 4) ДНК
А10. Особенностью вирусов является то, что они
могут вызывать заболевания животных и растений
не имеют клеточного строения
не имеют оформленного ядра
осуществляют очень активный транспорт веществ.
Часть 2.
В1. Выберите три правильных ответа из шести.
Среди перечисленных веществ полисахаридами является
инсулин
крахмал
гликоген
целлюлоза
гемоглобин
аденин
В2. Установите соответствие между органическими соединениями и их особенностями (ответ -последовательность цифр)
Особенности
Соединения
А) ускоряют химические реакции
Б) располагаясь в два слоя, составляют основу биологических мембран
В) накапливаются в подкожной клетчатке и обеспечивают терморегуляцию
Г) способны изменять свою пространственную структуру под действием внешних факторов
Д) являются полимерами
Е) при полном расщеплении окисляются до углекислого газа и воды
1) белки
2) липиды
В3. Вставьте в текст пропущенные определения из предложенного перечня, используя для этого цифровые обозначения.
Запишите ответ в виде последовательности цифр.
Углеводы выполняют различные функции в клетках живых организмов. Например, __________ А) входит в состав клеточных стенок растений, а _______ (Б) участвует в образовании наружного покрова членистоногих. В качестве запасного источника энергии растения используют _______ (В),
а животные ________ (Г).
Часть 3.
С1. Какие особенности строения молекулы ДНК обеспечивают выполнение ею функций хранения и передачи наследственной информации?
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина

Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Белки — это строительные материалы и живые нано-машины нашего тела. По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ ) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
Следующий опыт
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Третий опыт
Денатурация белка происходит и под действием растворов солей тяжёлых металлов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата.
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом, роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Скачать этот видеоурок вы можете на странице:
https://videouroki.net/blog/vidieourok-po-biologhii-bielki.html
#videouroki_net #полезное_для_учителей #бесплатные_материалы_учителю #видеоурок #Белки
