Структура белковой молекулы на примере гемоглобина
Общий рейтинг статьи/Оценить статью
[Всего голосов: 3 Общая оценка статьи: 5]
Гемоглобин – один из самых важных показателей крови. Из школьного курса биологии мы знаем о том, что роль гемоглобина заключается в транспорте кислорода и углекислого газа. А еще в гемоглобине содержится железо. Помните, как нам в детстве мамы и бабушки настойчиво рекомендовали кушать “железные” яблочки. И все это в рамках борьбы с дефицитом гемоглобина. Кстати, польза яблок в этом вопросе слегка преувеличена, но об этом чуть позже. Гемоглобин – один из самых хорошо изученных белков. И поэтому нам есть что рассказать о нем. Давайте узнаем, для чего нужен гемоглобин, почему его количество может быть выше или ниже нормы, и как с этим бороться.
Строение гемоглобина
Гемоглобин – это сложный белок. Даже само слово “гемоглобин”, если внимательно присмотреться, сложное. Оно состоит из двух частей – глобина (белковый компонент) и гема (небелковая часть молекулы).
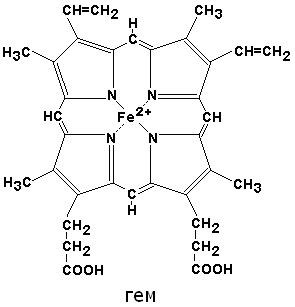
Если рассматривать гемоглобин с точки зрения популярности – то это самая настоящая классика жанра. Откройте любой учебник в разделе “белки”. В 99 случаях из 100, в качестве примера четвертичной структуры белка будет молекула гемоглобина. А рядом картинка такого плана:
В состав гемоглобина входит четыре молекулы гема, каждая из которых буквально обвита белковой цепью. Внутри гема есть один атом железа. Эта структура является пигментом, который окрашивает кровь в привычный нам цвет. Именно за счет гемоглобина наша кровь красная.
Железо в гемоглобине двухвалентное. Не хотелось бы усложнять статью химией, но это важный момент, к которому мы еще вернемся.
Гемоглобина в эритроците довольно много. Около 400 млн молекул в одной клетке. Он занимает практически 95% сухого остатка эритроцита.
Синтез гемоглобина
Синтез гемоглобина происходит в печени, костном мозге, кишечнике и почках. Важную роль в этом процессе играет железо. Часть его организм использует повторно. То есть при распаде гемоглобина большая часть железа остается в организме и идет на построение новых молекул гемоглобина. Немного железа поступает в организм с пищей. Таким образом происходит обновление этого макроэлемента.
Люди интересуются – можно ли насытить организм железом впрок? Нет, даже если вы принимаете препараты с высоким содержанием железа, его излишки покидают организм. При нормальном обмене веществ нам никак не превратиться в железного человека.
Железо откладывается в виде специального белка – ферритина. В составе этого соединения оно трехвалентное. Для того чтобы его превратить в двухвалентную форму, которая как мы помним входит в состав гемоглобина, нужны определенные условия. А именно — наличие таких катализаторов как витамин С и витамины группы В. Без этих веществ и всасывание железа в кишечнике будет весьма затруднительно.
В конце своего жизненного срока (примерно 120 дней), гемоглобин распадается на составляющие. Гем теряет железо, приобретает зеленый оттенок, а затем превращается в желтый билирубин. Билирубин входит в состав желчи, и когда его много, он дает симптомы желтухи. Одним из признаков массового распада гемоглобина является желтушность кожи и склер глаз.
Наверняка, вы обращали внимание на то, как изменяется цвет гематомы (синяка) при ушибе. Сначала она красная, потом синяя. Это признаки воспаления. А потом появляется другая цветовая гамма – от зеленого до коричневого. Это как раз и есть наглядный пример распада гемоглобина и превращение его составляющих в билирубин.
Функции гемоглобина
Пришло время разобраться для чего же нужен гемоглобин в нашем организме. Безусловно, главной задачей гемоглобина является газообмен. Но он занимается не только транспортом жизненно важных газов. Давайте обо всем по порядку.
Итак, функции гемоглобина:
Транспорт кислорода и углекислого газа
Все как нас учили в детстве – гемоглобин насыщается кислородом и по артериям разносит его органам и тканям. А на обратном пути забирает углекислый газ и возвращает его в легкие. Есть, конечно, ньюансы. Забирает гемоглобин почти весь кислород, полученный в легких. А обратно относит максимум 20% углекислого газа. Весь остальной углекислый газ растворяется в плазме крови и достигает легких в несвязанном состоянии. Так что в плане транспорта кислорода роль гемоглобина более существенна.
Поддержание кислотно-щелочного равновесия крови
Для того, чтобы наша кровь, да и весь организм в целом, выполняли свои функции, важно поддерживать постоянство PH. Гемоглобин выводит из клеток кислые соединения, препятствуя их закислению. А в легких, наоборот, предотвращает защелачивание. Таким образом, гемоглобин выполняет функцию буфера.
При сдвиге PH в кислую сторону в первую очередь страдает иммунная система. Нарушается синтез клеток иммунитета, замедляется иммунный ответ. Клинически это проявляется частыми инфекционными болезнями. Хотя, казалось бы, какое отношение имеет низкий уровень гемоглобина к постоянным простудам, например.
Связывание токсических веществ
Целый ряд ядовитых веществ имеет высокое сродство к двухвалентному железу. Угарный газ, синильная кислота, анилин, сероводород, нитробензол и другие соединения прочно связываются с железом гемоглобина. Это несколько снижает токсическую нагрузку на организм.
За такую помощь гемоглобина мы платим достаточно высокую цену. Прочные соединения не дают насытить гемоглобин кислородом и организм испытывает гипоксию. Так что с одной стороны гемоглобин, конечно, ограничивает контакт наших органов и тканей с токсинами. С другой же стороны, он не может выполнять свои “прямые обязанности”, и наше здоровье все равно страдает.
Виды гемоглобина
Можно выделить физиологический (нормальный) и патологический гемоглобин.
В медицинской литературе и документации, в том числе и в анализах крови, гемоглобин принято обозначать латинскими буквами Hb (haemoglobinum).
Для обозначения того или иного вида гемоглобина к буквам Hb добавляют еще одну или несколько латинских букв. Они определяют либо химическое соединение, которое вступило в реакцию с гемоглобином, либо являются заглавной буквой слова, которая раскрывает суть вещества. На самом деле все не так уж сложно. Сейчас вы в этом убедитесь.
Физиологический гемоглобин
HbA (adult -взрослый) – это “зрелый” гемоглобин, который есть у каждого человека, в том числе и маленьких детей. При рождении его около 80%, а затем количество HbA повышается до 95-98%.
HBF (fetus — плод) – фетальный гемоглобин, который вырабатывается с 8 недели эмбрионального развития и до рождения. Отличается от HbA большим сродством к кислороду, что вполне оправдано. Ведь малыш должен забрать из крови матери жизненно необходимый кислород.
HbP или HbE (embrion – эмбрион) – этот вид гемоглобина функционирует недолго. Примерно до 8 недели внутриутробного развития. Его иначе называют примитивным гемоглобином.
В зависимости от того, какие вещества присоединил к себе гемоглобин, различают следующие типы гемоглобина:
HbО2 – соединение с кислородом;
HbСО2 – соединение с углекислым газом;
HbMet – гемоглобин, соединившийся с сильным окислителем, и изменивший валентность железа на трехвалентное. В норме такого гемоглобина не должно быть больше 3%.
Патологический гемоглобин
В настоящее время известно более 300 видов патологического гемоглобина. Он может отличаться от нормального как по строению белковой составляющей, так и по наличию токсинов, которые к нему присоединились. Раньше ученые называли каждый тип гемоглобина по буквам латинского алфавита. Например, HbS — гемоглобин серповидно-клеточной анемии. Но потом поняли, что патологических соединений настолько много, что никаких букв не хватит, и начали называть их по другому принципу. К примеру, HbСО – карбгемоглобин (соединение с угарным газом), и так далее.
Говорить о структуре и функциях гемоглобина можно очень много. Оставим подробности ученым, и перейдем к более прикладным вещам – какой уровень гемоглобина считается нормой и о чем говорят его изменения в большую или меньшую сторону.
Анализ крови на гемоглобин
Несколько слов об анализе крови на гемоглобин. Ничего особо сложного тут нет. Определение уровня гемоглобина входит в общий анализ крови. Капиллярная кровь берется из пальца. Кровь нужно сдавать натощак. Накануне исключить физнагрузку. Взрослым желательно не пить воду. Для маленьких детей можно сделать исключение. Вот, собственно, и все.
Норма гемоглобина у взрослых и детей
Ребенок появляется на свет с высоким уровнем гемоглобина. Затем он постепенно снижается. Норма гемоглобина у детей до года намного выше нормы взрослого. Это связано с активным ростом организма, который требует высоких затрат кислорода.
У взрослых нормой гемоглобина считается:
Для женщин 120 — 140 г/л
Для мужчин 130 – 160 г/л
Обычно возраст человека при оценке не учитывается. Хотя, ВОЗ рекомендует учитывать этот показатель. Ведь норма гемоглобина у женщин репродуктивного возраста несколько отличается от таковой у дам в менопаузе, к примеру.
Вот норма гемоглобина по возрасту, в виде таблицы:
Норма гемоглобина у беременных чуть ниже – 110 г/л. При беременности гемоглобин снижается по вполне объективным причинам. Часть своего железа женщина отдает ребенку.
Нормативы ВОЗ не учитывают некоторые особенности жителей высокогорных районов. Чем выше над уровнем океана, тем меньше в воздухе кислорода. Соответственно срабатывают механизмы компенсации. Организм вырабатывает больше гемоглобина для того, чтобы покрыть дефицит кислорода.
У горцев норма гемоглобина выше на 35-45 г/л. То есть уровень гемоглобина вполне может составлять 200 г/л, что для жителей равнины считается патологией.
Средняя концентрация гемоглобина в эритроците
Средняя концентрация гемоглобина в эритроците обозначается аббревиатурой MCHC (Mean Corpuscular Hemoglobin Concentration). Этот показатель характеризует насыщение эритроцитов гемоглобином. Он стабильный, и у взрослых не зависит от возраста, пола и других параметров.
Средняя концентрации гемоглобина в эритроците в норме составляет 34 г/дл. Это значение может варьировать в пределах двух единиц.
Понижение этого показателя говорит о наличии анемии, а вот повышение бывает крайне редко. Дело в том, что при концентрации 37 г/дл гемоглобин нерастворим в воде, а значит и в плазме крови, и образует кристаллы. Повышение средней концентрации гемоглобина в эритроците говорит о том, что нужно повторно сдать анализ. Скорее всего произошла ошибка.
Итак, мы разобрались с нормой важных параметров гемоглобина. Неплохо было бы узнать с чем связаны отклонения от нормы и какие симптомы этих состояний.
Причины низкого гемоглобина в крови
- Кровопотеря, в том числе и при менструации
- Нарушение всасывания железа в кишечнике
- Инфекционные болезни
- Онкологические заболевания
- Скудный пищевой рацион
- Беременность
- Тяжелый физический труд
- Пожилой возраст
- Задержка жидкости в организме. Получается, что плазмы крови становится больше, а количество эритроцитов остается прежним. На этом фоне уменьшается количество гемоглобина в литре объема крови.
Таким образом, можно заметить, что женщины чаще страдают от низкого уровня гемоглобина. У них на это есть две физиологические причины – месячные и беременность.
Признаки низкого гемоглобина
- Усталость, сонливость, апатия
- Бледность кожи, иногда желтушность
- Судороги
- Холодные руки и ноги
- Ломкость ногтей
- Увеличение селезенки и печени
- Изменение цвета стула
- Нарушение сердечного ритма
- Частые инфекционные болезни
Интересный факт. Признаком низкого гемоглобина является, как ни странно, желание есть мел, вдыхать выхлопные газы, керосин и прочие жидкости со специфическим запахом. Причина этого явления до конца не ясна. Но для таких людей даже придумали специальный пищевой мел.
Причины повышения гемоглобина в крови
- Стресс
- Повышение температуры
- Обезвоживание организма
- Сердечная недостаточность
- Заболевания крови
- Дефицит кислорода
- Курение
Принято считать, что низкий уровень гемоглобина несет в себе угрозу для здоровья. Но и в повышенном гемоглобине хорошего мало. При уровне гемоглобина на 20 г/л выше нормы резко возрастает риск тромбозов, инфаркта, инсульта, нарушения работы почек и поджелудочной железы.
Симптомы высокого гемоглобина
- Сонливость, вялость
- Нарушение зрения
- Онемение конечностей
- Снижение массы тела
- Потеря аппетита
- Кровь в кале
- Зуд кожи
Как повысить гемоглобин
Как быстро повысить гемоглобин в крови? У каждого свое понимание слова “быстро”. Кто-то представляет себе недельное лечение, а кто-то хочет принять такую таблетку, которая моментально бы насытила кровь гемоглобином. К сожалению, не все так просто. Стандартное лечение предполагает 2-3 месяца минимум. Все зависит от того, насколько выражен дефицит.
Считается, что если через 2 недели лечения показатели гемоглобина будут выше предыдущих на 2%, то это достаточно неплохой результат. То есть если у вас изначально гемоглобин был 100 г/л, а через 2 недели стал 102 г/л – это хорошо. А это еще далеко не норма.
Переливание крови при низком гемоглобине – вот единственный способ быстро исправить ситуацию. Но эта процедура не так уж проста и безопасна, и проводится только при остром дефиците.
Для постепенного повышения уровня гемоглобина применяют препараты железа. Их можно вводить внутривенно, а можно принимать в виде таблеток. И дозировку, и путь введения определит врач. Кстати, не спешите принимать препараты железа самостоятельно. Во-первых, надо определить причину снижения гемоглобина. А для этого пройти обследование и сдать по крайней мере анализ на ферритин. Может быть и не в железе дело. Вы будете насыщать организм железом, а причина кроется в нарушении синтеза гемоглобина.
Несколько слов о железе. Суточная потребность в этом макроэлементе составляет 1-2 мг. С одной оговоркой – железо будет выводится из организма естественным путем – через мочу, пот, эпителий кожи и волосы. При обильных месячных, потери железа составляют 2-4 мг в сутки. В данном случае очень желательно хотя бы неделю в месяц принимать препараты железа, удвоив дозировку.
Что же касается продуктов для повышения гемоглобина в крови, то тут у вас широкий выбор – есть и растительная и животная пища, содержащая железо.
Растительные продукты для повышения гемоглобина
- Фрукты и ягоды – яблоки, клюква, рябина, земляника, клубника, киви, черная смородина, гранат, черешня, голубика, абрикосы, черника, красный виноград. Из них можно делать соки. Неплохо повышает гемоглобин вино из красного винограда. Там содержится железо, плюс ко всему алкоголь стимулирует кроветворение.
- Овощи – свекла, морковь, перец, брокколи, кукуруза, бобовые. Можно делать миксы – соки из яблок, свеклы, моркови и лимона. Лимон нужен в качестве источника аскорбиновой кислоты, которая, как мы помним, ускоряет всасывание железа.
- Орехи – грецкие, кедровые, арахис.
- Сухофрукты – изюм, курага, инжир, чернослив.
- Отвары трав – зверобой, клевер, шиповник, листья ежевики.
- Мед
Животные продукты для повышения гемоглобина
- Красное мясо (особенно говядина и телятина), говяжья печень, курица и кролик.
- Гематоген. Мы не зря включили эту сладкую ириску в список животных продуктов для повышения гемоглобина. В его состав входит животный белок альбумин, который содержит хорошо усваиваемое железо и витамины. Эта пищевая добавка стала достаточно популярной и очень нравится детям.
Если вы хотите эффективнее насытить организм железом, то не принимайте эти продукты совместно с молоком и молочными продуктами. Кальций замедляет всасывание железа в кишечнике. Кофе и чай тоже лучше заменить на шиповник.
И, разумеется, не забываем о полезных витаминах – С, В12 и фолиевой кислоте.
Как чудесно, скажете вы – столько продуктов! И многие из них мы принимаем в пищу чуть ли не каждый день. Почему же наш гемоглобин продолжает упрямо снижаться? Все это объясняется биодоступностью железа. Ведь между тем сколько мы съели, и сколько осталось в нашем организме – серьезная разница.
Какой смысл в железе в тех же яблоках, если всасывается всего 6%? Кроме того, некоторые сорта яблок содержат очень мало железа, что при такой низкой биодоступности равносильно приему водопроводной воды. Там вообще вся таблица Менделеева, и соли железа в том же числе.
Биодоступность железа в мясе около 20%. Уже неплохо. Кроме того, это железо гемовое, двухвалентное. То есть для того, чтобы занять свое место в гемоглобине ему не надо трансформироваться из трехвалентного. Кстати, нам еще с детства рекомендовали говяжью печень как “топовый” продукт по содержанию железа. Это не совсем так. В обычном красном мясе его намного больше.
В общем, для того чтобы повысить гемоглобин в крови нам нужны препараты железа и правильные продукты. Предпочтение лучше отдать мясу.
Как понизить гемоглобин?
Для понижения гемоглобина рекомендуют ограничить употребление продуктов, содержащих железо. Целесообразность этого совета остается под вопросом. Мы уже говорили о том, что при нормальном обмене веществ, организм не заберет больше железа, чем ему нужно. В принципе, можно красное мясо заменить белым, да и вообще заменить овощами. Вопрос только в том, а поможет ли это снизить высокий гемоглобин?
Единственное, в чем есть рациональное зерно, так это в рекомендации исключения спиртных напитков из рациона. Стимулировать кроветворение при и так высоком гемоглобине совершенно не нужно.
Чаще всего причиной высокого гемоглобина является обезвоживание. Что нужно делать? – конечно же насыщать организм жидкостью. Говоря простым языком – больше пить. Хотя, в некоторых ситуациях назначают специальные препараты – антиагреганты.
Конечно, в первую очередь, надо разобраться с причиной высокого уровня эритроцитов. Эта проблема не возникает спонтанно, и является следствием какого-либо заболевания.
Следите за уровнем гемоглобина и будьте здоровы!
Ответы на вопросы о гемоглобине читайте здесь
Источник
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
5. Строение и функции хромопротеинов (на примере миоглобина и гемоглобина). Аллостерические свойства гемоглобина. Кооперативный эффект. Роль СО2, водородных ионов и 2,3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду.
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.
| Раздел 3.1 | Понятие о простых и сложных белках. Классификация сложных белков. | |||||||||||||||||||||
3.1.1. Запомните, что белки можно разделить на простые и сложные. Простые белки – белки, которые состоят только из аминокислотных остатков. Сложные белки (холопротеины) – белки, которые состоят из аминокислотных остатков и компонентов небелковой природы. Белковая часть сложного белка получила название апопротеин, небелковая часть сложного белка – простетическая группа. 3.1.2. Сложные белки классифицируют в зависимости от химического строения их простетических групп. Выучите названия классов сложных белков, их простетических групп и примеры представителей различных классов сложных белков (таблица 3.1) .
В этом разделе мы более подробно коснёмся строения и свойств хромопротеинов и нуклеопротеинов. Характеристика белков – представителей других классов будет рассмотрена позднее. | ||||||||||||||||||||||
| Раздел 3.2 | Особенности строения и биологическая роль липопротеинов, нуклеопротеинов, фосфопротеинов, металлопротеинов. |
3.2.1. Липопротеины – сложные белки, содержащие в качестве простетической группы липиды и их производные. Представителями служат хиломикроны и другие фракции липопротеинов крови. Липопротеины являются транспортными формами липидов в крови. Более подробно этот класс сложных белков рассматривается в разделе «Обмен липидов». 3.2.2. Нуклеопротеины – сложные белки, содержащие в качестве простетической группы нуклеиновые кислоты. Нуклеопротеинами являются вирусы, рибосомы, хроматин клеточного ядра. Существуют две разновидности нуклеопротеинов: 1) рибонуклеопротеины, в состав которых входит рибонуклеиновая кислота (РНК); 2) дезоксирибонуклеопротеины, в состав которых входит дезоксирибонуклеиновая кислота (ДНК). Строение и свойства нуклеиновых кислот будут рассматриваться позднее. Особенность белковой части нуклеопротеинов заключается в том, что в её состав входит много положительно заряженных аминокислотных остатков. Так, в состав дезоксирибонуклеопротеинов входят белки гистоны, богатые лизином и аргинином. Между белковыми и небелковыми компонентами нуклеопротеинов образуются ионные связи (так как нуклеиновые кислоты заряжены отрицательно). 3.2.3. Фосфопротеины содержат в своём составе остатки фосфорной кислоты, соединённые с остатками гидроксиаминокислот (серин, треонин) при помощи сложноэфирных связей. К этой группе сложных белков относятся казеиноген молока, яичные белки овальбумин и вителлин. Многие внутриклеточные белки являются фосфопротеинами. Присоединение фосфатной группы к белку часто вызывает изменение его функции. Фосфорилирование и обратный процесс – дефосфорилирование – распространенный механизм регуляции биологической активности белков. Например, фосфорилирование гистонов снижает их способность связываться с ДНК и участвовать в регуляции матричных синтезов с участием ДНК. 3.2.4. Металлопротеины. Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеинами. Ионы металлов соединены координационными связями с функциональными группами белка и участвуют в поддержании его пространственной структуры. Металлопротеины часто являются ферментами. Трансферрин – водорастворимый железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит 2 иона Fe3+; этот белок служит переносчиком железа в организме. Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови. Церулоплазмин – белок α2-глобулиновой фракции сыворотки крови, его молекула содержит 6 – 8 ионов меди. Обладает каталитической активностью, катализирует реакцию окисления Fe2+ в Fe3+. Это делает возможным связывание железа с трансферрином и его последующий транспорт в крови. | |
| Раздел 3.3 | Строение и функции гликопротеинов. Иммуноглобулины. |
3.3.1. Гликопротеины – содержат в качестве простетической группы углеводы и их производные. Они присоединяются либо N-гликозидной связью к амидогруппе остатка аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина или треонина. Углеводная часть имеет нерегулярное строение. Гликопротеины выполняют в организме следующие функции: структурную (коллаген, эластин), защитную (антитела, интерфероны), рецепторную, гормональную (гормоны гипофиза), ферментативную, транспортную. 3.3.2. Иммуноглобулины (антитела) – группа белков, вырабатываемых организмом в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются В-лимфоцитами или плазматическими клетками. В организме может вырабатываться порядка 107 разновидностей иммуноглобулинов, каждый из которых может распознавать определённый антиген. Все иммуноглобулины подразделяют на пять классов: IgA, IgG, IgM, IgD, IgE. Основную структурную единицу иммуноглобулинов, или мономер, образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями, из них: а) две идентичные тяжёлые цепи (молекулярная масса 53000 – 75000 Да), обозначаемые буквами Н; б) две идентичные лёгкие цепи (молекулярная масса около 23000 Да), обозначаемые буквами L. Иммуноглобулины G, D и Е по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA могут быть как мономерами, так и состоять из двух и более структурных единиц. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. | |
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
3.3.3. Функции иммуноглобулинов. IgG составляют около 75% общего количества иммуноглобулинов плазмы крови. IgG эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, а также облегчают их дальнейшее уничтожение, способны преодолевать плацентарный барьер, что обеспечивает иммунитет новорождённых в течение первых недель жизни.
IgA содержатся главным образом в секретах слизистых оболочек дыхательных и выделительных путей, желудочно-кишечного тракта, т.е. обеспечивают защиту поверхностей, сообщающихся с внешней средой.
IgM синтезируются на ранних стадиях иммунного ответа, вступают в реакцию агглютинации с антигенами, активируют систему комплемента.
IgD связаны с мембраной лимфоцитов, функционируют в качестве рецепторов для антигенов.
IgE участвуют в развитии аллергических реакций, в защите от паразитарных инвазий.
| Раздел 3.4 | Миоглобин и гемоглобин: сходство и различия структуры и функции. |
| 3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина – витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
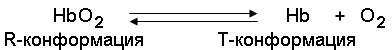
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX – органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин – хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) – хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы – полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
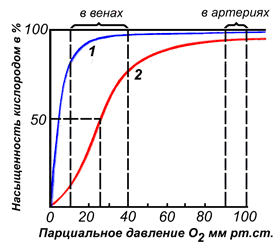
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. | |
| Раздел 3.5 | Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
3.5.1. Следует различать производные гемоглобина и его молекулярные формы. К производным гемоглобина относятся продукты взаимодействия гемоглобина (дезоксигемоглобина) с различными лигандами. Это взаимодействие, как правило, носит обратимый характер. Производные гемоглобина, представляющие наибольший интерес для медицины, перечислены в таблице 3.2. Запомните, что метгемоглобин (MetHb), в отличие от гемоглобина, теряет способность связывать и транспортировать кислород. Следовательно, попадание в организм больших количеств веществ, вызывающих образование метгемоглобина (нитриты, нитраты, анилин, нитробензол, некоторые лекарства), может привести к гипоксии (кислородному голоданию) тканей и смерти. В то же время метгемоглобин может легко связывать ионы CN—, нейтрализуя их токсическое действие. В результате образуется цианметгемоглобин. 3.5.2. Молекулярные формы гемоглобина отличаются друг от друга строением полипептидных цепей. Примером такой разновидности гемоглобина, существующей в физиологических условиях, является фетальный гемоглобин (HbF), присутствующий в крови в эмбриональной стадии развития человека. В отличие от HbA, его молекула содержит 2 α- и 2 γ-цепи (то есть β-цепи заменены на γ-цепи). Такой гемоглобин обладает более высоким сродством к кислороду. Именно это позволяет эмбриону получать кислород из крови матери через плаценту. Вскоре после рождения HbF в крови ребёнка замещается на HbA. В качестве примера аномального или патологического гемоглобина можно привести уже упоминавшийся (см. 2.4.) гемоглобин S, обнаруженный у больных серповидно-клеточной анемией. Как вам уже известно, он отличается от гемоглобина А заменой в β-цепях глутамата на валин. Эта аминокислотная замена вызывает снижение растворимости HbS в воде и уменьшение его сродства к O2. | |
| Критерий | Дезоксигемоглобин | Оксигемоглобин | Карбгемоглобин | Карбоксигемоглобин | Метгемоглобин | Цианметгемоглобин |
|---|---|---|---|---|---|---|
| Лиганд | – | O2 | СО2 | СО | ОН— |