Стволовые клетки при анемий
Трансплантация стволовых клеток крови при апластической анемии
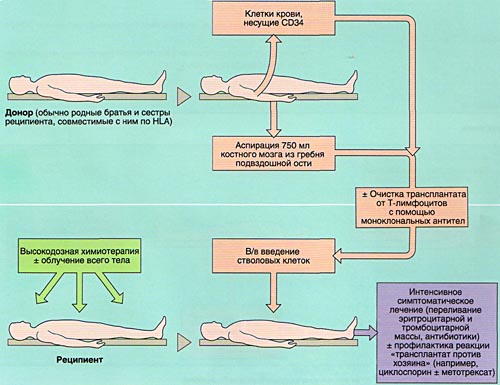
Клинические попытки трансплантации костного мозга при заболеваниях крови начались в 1970-х годах. После разрушения костного мозга путем химиотерапии и облучения больным вводят либо собственные заранее запасенные клетки костного мозга (аутпотрансплантация), либо костномозговые клетки доноров (аллотрансплантация).
Поскольку идентичных по антигенам HLA сибсов можно подобрать лишь в 25 % случаев, приходится использовать кроветворные стволовые клетки и из других источников: костного мозга несовместимых доноров (родственников и чужих людей), крови вены пуповины и периферической крови (ауто-и аллогенная трансплантация, родственная и неродственная). Эта процедура получила название трансплантации кроветворных стволовых клеток (ТКСК), и ее не следует путать с сомнительным методом трансплантации стволовых клеток эмбрионов.
Трансплантация стволовых клеток крови — метод выбора при приобретенных и наследственных незлокачественных (апластической анемии и анемии Фанкони) и злокачественных (хроническом миелолейкозе) заболеваниях крови, а также при других злокачественных процессах, не поддающихся обычной терапии. ТКСК — это еще и генная терапия, так как предусматривает замену отсутствующего или дефектного гена в клетках больного нормальным геном. Обследование детей, которым предстоит такая процедура, равно как и последующее наблюдение за ними, требует участия педиатра.

Апластическая анемия, заболевание неясной этиологии, характеризуется панцитопенией и гипоплазией костного мозга. Дети с тяжелой формой апластической анемии (число тромбоцитов менее 20000/мкл, нейтрофилов < 500/мкл и ретикулоцитов < 1 %) часто погибают от инфекций или кровотечений еще в первое полугодие жизни. Дисфункция костного мозга может быть результатом наследственных синдромов (например, анемии Фанкони или пароксизмальной ночной гемоглобинурии), аутоиммунных заболеваний или нарушения продукции цитокинов.
Иногда она развивается при отравлении химическими веществами (например, бензином или хлорамфениколом) и при гепатите «не А, не В, не С». Переливаний крови следует по возможности избегать, так как сенсибилизация к ее компонентам увеличивает риск отторжения трансплантата при последующей ТКСК, которая для больных, имеющих HLA-идентичных родственников, является наиболее эффективным методом лечения. Согласно Международному регистру, 2-летняя выживаемость после такой трансплантации составляет 69 %.
По данным исследовательской группы из Сиэтла (США), после ТКСК от HLA-идентичных сибсов 15-летняя выживаемость больных до 6-летнего возраста (п = 12) достигает 100%, а больных в возрасте 6-19 лет (n = 63) — 78%.
Частота отторжений трансплантата у больных с апластической анемией выше, чем в других случаях, но может быть значительно снижена, если перед трансплантацией использовать не только цикло-фосфамид, но и антилимфоцитарный иммуноглобулин. Такой подготовительный режим позволил повысить 3-летнюю выживаемость больных до 92%/ При неродственной трансплантации, включающей дополнительно облучение и/или химиотерапию, 5-летняя выживаемость составляет 69%.
Однако иммуносупрессивная терапия чревата увеличением частоты рака, особенно у больных с анемией Фанкони.
– Также рекомендуем “Трансплантация стволовых клеток при остром лейкозе”
Оглавление темы “Применение стволовых клеток”:
- Трансплантация стволовых клеток крови при апластической анемии
- Трансплантация стволовых клеток при остром лейкозе
- Трансплантация стволовых клеток при миелопролиферативных заболеваниях – миелолейкозе
- Трансплантация стволовых клеток при лимфоме и лимфогранулематозе (болезни Ходжкина)
- Трансплантация стволовых клеток при нейробластоме и опухолях мозга
- Трансплантация стволовых клеток при солидных опухолях – саркоме Юинга
- Трансплантация стволовых клеток при иммунодефиците и анемии Фанкони
- Трансплантация стволовых клеток при болезнях накопления и талассемии
- Трансплантация стволовых клеток при серповидноклеточной анемии и синдроме Даймонда-Блекфена
- Подбор донора для трансплантации стволовых клеток. Отторжение трансплантата
Трансплантация стволовых клеток при серповидноклеточной анемии и синдроме Даймонда-Блекфена
При надлежащем уходе более 90% таких детей доживают до 30-40 лет, а 60% детей доживают до 50 лет. У 5-20% гомозигот по HbS часто возникают вазоокклюзионные кризы и поражения легких, почек и ЦНС. Для лечения используют препараты, препятствующие образованию серповидных эритроцитов, генную терапию, и стимуляцию гидроксимочевиной синтеза HbF. Однако единственным радикальным методом лечения является ТКСК.
В США трансплантации красных стволовых клеток (ТКСК) от HLA-идентичных сибсов проводили 50 больным в возрасте 3-15 лет; у 2 доноров имелось аналогичное заболевание. Показания к трансплантации включали инсульты в анамнезе, повторные острые синдромы грудной клетки или вазоокклюзионные кризы. За период наблюдения (в среднем 38 мес.) в живых оставалось 47 (94%) больных; у 5 (10%) наблюдались отторжение трансплантата или рецидив серповидноклеточнои анемии. Общая безрецидивная выживаемость (БРВ) составила 84%.
В Бельгии и Франции родственную трансплантацию красных стволовых клеток (ТКСК) от HLA-идентичных доноров проводили 45 гомозиготам по HbS (SS-вариант болезни).
За период наблюдения (1-75 мес) в живых оставалось 95 % больных; безрецидивная выживаемость (БРВ) составила 86 %. Среди 38 больных, у которых трансплантация была успешной, вазоокклюзивные кризы отсутствовали, а у некоторых восстановилась функция селезенки. Таким образом, хотя ТКСК излечивает больных-гомозигот по HbS, подобрать подходящих кандидатов на этот метод лечения довольно трудно.
Больные с SS-вариантом заболевания могут жить много лет, но требуют частой госпитализации по поводу болевых вазоокклюзионных кризов и инсультов. В некоторых случаях (например, при мутации, характерной для гаплотипа Центральноафриканской Республики) можно заранее предвидеть развитие тяжелых осложнений. Показаниями к ТКСК в молодом возрасте служат повторные вазоокклюзивные кризы, признаки повреждения различных органов, инсульты и наличие HLA-идентичных родственников.
Синдром Даймонда-Блекфена, или врожденная красноклеточная аплазия, характеризуется нормохромной макроцитарной анемией при нормальном содержании кроветворных клеток в костном мозге. В тех случаях, когда обычные методы лечения не помогают, можно использовать ТКСК от HLA-идентичных сибсов. Из 40 больных с анемией Даймонда-Блекфена в течение 2 лет после ТКСК оставался в живых 31 человек; БРВ составила 72 %. Врожденная сидеробластная анемия обусловлена дефектом митохондрий в эритробластах.
У одного ребенка, в возрасте 34 мес. перенесшего трансплантацию красных стволовых клеток (ТКСК) от HLA-идентичного родственника, через 3 года наблюдалось некоторое увеличение печени, но он не нуждался в переливаниях крови, а уровень железа и ферритина в сыворотке оставался нормальным.
Имеются сообщения об успешной аллотрансплантации кроветворных стволовых клеток и при синдроме Швахмана-Даймонда — аутосомно-рецессивном заболевании, характеризующимся дефицитом панкреатических ферментов, метафизарным дизостозом и нарушением кроветворной функции костного мозга, включая трансформацию в острый лейкоз.
– Также рекомендуем “Подбор донора для трансплантации стволовых клеток. Отторжение трансплантата”
Оглавление темы “Применение стволовых клеток”:
- Трансплантация стволовых клеток крови при апластической анемии
- Трансплантация стволовых клеток при остром лейкозе
- Трансплантация стволовых клеток при миелопролиферативных заболеваниях – миелолейкозе
- Трансплантация стволовых клеток при лимфоме и лимфогранулематозе (болезни Ходжкина)
- Трансплантация стволовых клеток при нейробластоме и опухолях мозга
- Трансплантация стволовых клеток при солидных опухолях – саркоме Юинга
- Трансплантация стволовых клеток при иммунодефиците и анемии Фанкони
- Трансплантация стволовых клеток при болезнях накопления и талассемии
- Трансплантация стволовых клеток при серповидноклеточной анемии и синдроме Даймонда-Блекфена
- Подбор донора для трансплантации стволовых клеток. Отторжение трансплантата
Общие принципы

Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) – метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
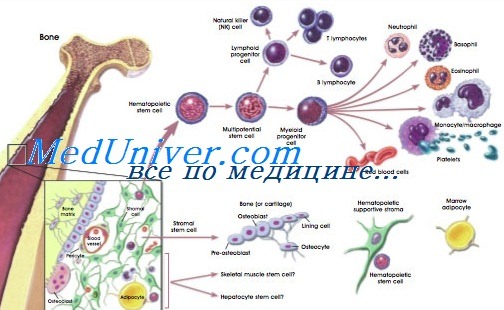
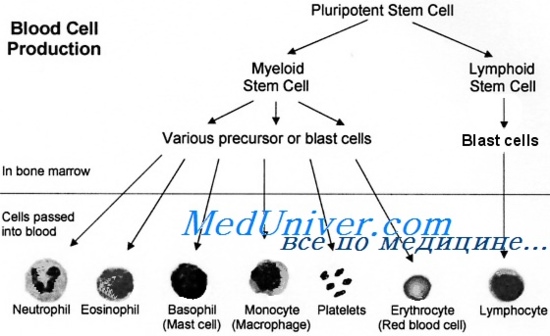
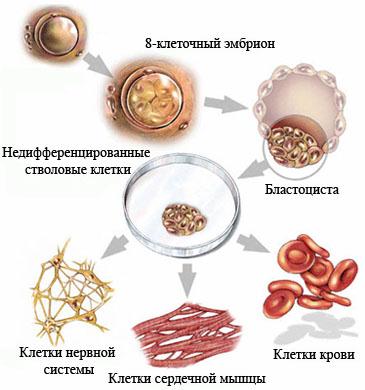
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
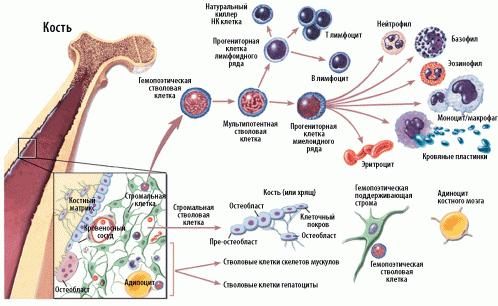
Схема кроветворения и дифференцировки стволовых клеток
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d”Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Выделяют два основных вида ТКМ:
- 1)аллогенную (АллоТКМ) – при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
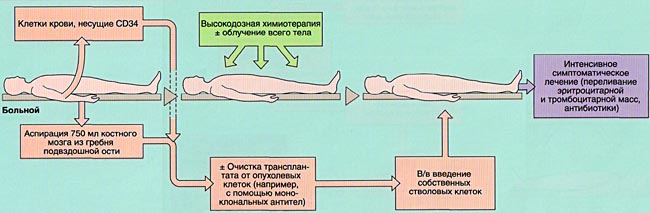
- 2)аутологичную (АутоТКМ) – когда реципиент получает предварительно заготовленный собственный костный мозг;
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Аллогенная трансплантация костного мозга:
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
Аутологичная трансплантация костного мозга:
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
В связи с ограниченным количеством родственных гистосовместимых доноров, которые имеются лишь у 20- 25% больных, в последние годы нашла применение АлТКМ от неродственных HLA-идентичных доноров. Для этих целей созданы международные регистры, позволяющие подобрать потенциального донора костного мозга и оптимизировать прогноз у пациентов, для которых АллоТКМ предпочтительнее (острые лейкозы, хронический миелолейкоз) или является методом выбора (апластическая анемия, гемоглобинопатии, иммунодефициты, нарушения метаболизма). Общее число зарегистрированных доноров в мире превышает 5 миллионов человек, в том числе в России – около 10 тысяч.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
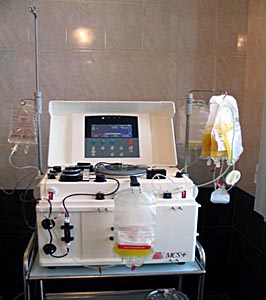
Сепаратор клеток крови
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
При любой методике ТКМ/ТСКК можно выделить следующие этапы:
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника – моложе 55 лет, неродственная АллоТКМ – моложе 50 лет.
Проведение трансплантации противопоказано при:
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости – также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5×106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ – не менее 2х106/кг (у больных апластической анемией – не менее 3х106/кг), при неродственной АлТКМ – не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего – диметилсульфоксида).
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.

Инфузия костного мозга пациенту
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования – обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости – порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Профилактика инфекционных осложнений начинается в среднем за 2 недели до трансплантации и включает:
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>При аллогенных тарнсплантациях проводиться профилактика и лечение реакции «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА» (РТПХ). Острая РТПХ развивается в первые 100 дней после трансплантации, хроническая – в более поздние сроки. Для профилактики и лечения РТПХ в большинстве случаев используются иммунодепрессанты – циклоспорин А, метотрексат, преднизолон, моноклональные антитела.
ЛЕЧЕНИЕ ПОЗДНИХ ОСЛОЖНЕНИЙ
В течение года и далее после трансплантации (преимущественно аллогенной) могут возникать различные поздние осложнения (поражение кожи и слизистых, печени, почек, легких, глаз, костей и мышц, эндокринные нарушения, сексуальные расстройства, аутоиммунные заболевания), лечение которых в большинстве случаев проводится по общим принципам и не имеет существенных особенностей. Особого внимания заслуживают злокачественные новообразования, развивающиеся после трансплантации.
После химиотерапии и достижения очередной ремиссии при удовлетворительном состоянии пациента может быть проведена вторая ТКМ или ТСКК.
