Тактика при железодефицитной анемии
Анемия определяется как системная гипоксия, связанная со снижением содержания в организме кислородоносителя. Анемия устанавливается при концентрации гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин [4]. По данным ВОЗ, анемией страдают 2 млрд жителей Земли, 80–90% этих состояний связано с дефицитом железа (железодефицитные синдромы), а более половины является железодефицитной анемией (ЖДА) [2, 8]. ЖДА – это
абсолютный дефицит железа, приводящий к развитию сидеропенического синдрома и анемии (самая распространенная анемия в мире).
Регуляция обмена железа
Ежедневно организму для нормальной жизнедеятельности требуется 20–25 мг железа. С пищей человек получает 1–2 мг, остальное поступает из отслуживших свой 120-дневный срок циркулирующих эритроцитов. Именно поэтому ведущей причиной развития ЖДА является хроническая кровопотеря – недостаток эндогенного железа, содержащегося в собственном гемоглобине. В среднем запасы железа в организме составляют 3000 мг, из которых 2500 мг находятся в крови и до 500 мг – в печени, которая является основным его депо. В течение 1 года здоровый человек получает около 400–800 мг железа извне и столько же теряет.
Всасывание железа происходит в двенадцатиперстной кишке (ДПК) и верхних отделах тощей кишки, 70–80% железа усваивается в 2-валентной форме (гемовое железо из мяса, печени и рыбы). При поступлении в кишечник 3-валентного железа из растительной пищи с помощью медь-зависимой ферроредуктазы на апикальной мембране энтероцитов оно восстанавливается до 2–валентного. Двухвалентное железо через марганец-зависимые белки-транспортеры (ДМТ-белки – транспортеры 2-валентных металлов) поступает в энтероцит, а затем через белок ферропортин (универсальный транспортер железа из всех клеток организма в кровь) на базальной мембране выводится в систему циркуляции. Далее с помощью медь-зависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до 3-валентного состояния, чтобы связаться с транспортным белком – трансферрином (рис. 1). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [11].
Универсальным регулятором метаболизма железа является hepcidin (в отечественной литературе встречается 2 варианта перевода: гепцидин (такое название связано с тем, что этот белок вырабатывается в основном печенью и обладает бактерицидными свойствами) и гепсидин) [3, 26]. Он обладает свойством подавлять активность белка ферропортина, что ограничивает поступление железа из клеток организма в кровь. Увеличение количества железа в организме, так же как и любое воспалительное заболевание, инфекция или опухоль, ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи – к восстановлению захвата железа из пищи и кишечника [13]. Помимо железорегуляторной функции гепцидин обладает выраженным бактерицидным действием, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [3]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. Железо, которое остается внутри клеток, депонируется в виде ферритина (1 молекула ферритина содержит до нескольких тысяч молекул железа), количество которого в крови прямо пропорционально содержанию железа в депо. Следствием такого влияния гепцидина является снижение уровня сывороточного железа. Несмотря на гиперферритинемию, происходит развитие железодефицитного эритропоэза (гипохромной микроцитарной анемии). Такой вид анемии называется анемией хронической болезни (АХБ), относится так же, как и ЖДА, к железодефицитным синдромам и занимает 2-е место по частоте в мире.
Клиническая картина и диагностические критерии ЖДА
Дефицит железа приводит к нарушению синтеза гемоглобина в эритрокариоцитах костного мозга, уменьшению содержания миоглобина в мышцах, активности цитохромов и каталаз в митохондриях клеток, миелопероксидазы в нейтрофилах [13].
В настоящее время выделяют несколько стадий дефицита железа [12]:
1. Предрасположенность – высокий риск развития дефицита железа (вегетарианство, подростковый возраст (в сочетании с нарушением менструального цикла у девочек), частые роды, наличие хронических болезней ЖКТ, заболевания женской репродуктивной системы, связанные с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако определяется повышение абсорбции 3-валентного железа в ЖКТ, которое может превышать 50% (в норме – 10–15%).
3. Латентный дефицит железа характеризуется развитием сидеропенического синдрома и уменьшением запасов железа в организме по данным лабораторных исследований.
4. ЖДА.
Клинические проявления ЖДА связаны как с симптомами системной гипоксии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности), так и с развитием сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета.
Наиболее характерными лабораторными признаками ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8 (по старому исчислению), среднее содержание гемоглобина в эритроците менее 28 пг. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита – менее 80 фл [13].
Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных, их применение не всегда оправданно. Так, минимальные нормальные значения показателя ферритина сыворотки (ФС) как единственного маркера, отражающего запасы железа в организме и используемого для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [12], варьируют от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени.
В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [10]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [13]. Изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, т. к. они рассчитываются исходя из содержания трансферрина и сывороточного железа. Последний показатель не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [6].
Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20% [13]. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [6].
Наиболее частыми причинами развития ЖДА являются хроническая кровопотеря и повышение потребности в железе (подростковый возраст, беременность, лактация). Рассматривая хроническую кровопотерю как причину ЖДА, надо понимать, что речь идет о длительном процессе, когда в течение 1 года теряется более 2,5 л крови (более 1300 мг железа), что превышает запасы металла в депо и годовую возможность его абсорбции. Помимо этих причин патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в т. ч. обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [6].
Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [12].
Этиология и патогенез ЖДА при патологии ЖКТ
Дефицит железа сопровождает большое количество заболеваний гастроэнтерологического профиля [23].
Причинами развития кровотечения из верхних отделов кишечника наиболее часто являются язва желудка и ДПК, эрозивный гастрит, эрозивный эзофагит, реже – варикозное расширение вен пищевода, синдром Маллори – Вэйса, грыжа пищеводного отверстия диафрагмы, дивертикулез ДПК, опухоли желудка и тонкого кишечника, ангиодисплазия [1, 7, 9]. Нарушение всасывания часто обусловлено целиакией, отсутствием части кишечника после хирургического вмешательства.
Согласно литературным данным, на долю кровотечения из нижних отделов ЖКТ (дистальнее связки Трейтца) приходится не более 20% всех острых кровотечений, не менее 50% (что более важно для развития ЖДА) – хронических и большинство скрытых (наиболее сложных для топический диагностики) [8]. Среди основных причин данной патологии выделяют заболевания прямой кишки (геморрой, трещины), колиты (язвенный колит, болезнь Крона, инфекционные, ишемические), дивертикулярную болезнь толстой кишки, полипы, рак толстой кишки, эктазии сосудов толстой кишки [8, 14, 15].
ЖДА – хорошо известная проблема среди пациентов, страдающих воспалительными заболеваниями кишечника (ВЗК). ВЗК – общий термин, которым обозначают группу хронических болезней, характеризующихся деструктивным неспецифическим иммунным воспалением стенки кишки. К ВЗК относят язвенный колит и болезнь Крона. Выраженная общая слабость, типично сопровождающая ЖДА, является частым симптомом самих ВЗК и значительно снижает качество жизни таких больных наряду с рецидивирующими болями в животе или хронической диареей. Согласно литературным данным, анемия развивается в 75–80% ВЗК, при этом дефицит железа остается ее самой частой причиной у данной группы пациентов [21, 25]. Развитие дефицита железа при ВЗК вызвано рядом причин, среди которых фигурируют недостаточное всасывание железа и хроническая кровопотеря, которые ведут к дисбалансу поступления и потребления железа на нужды организма. При этом нельзя не отметить роль хронического воспаления и повышение концентрации провоспалительных цитокинов, особенно гепцидина, в развитии анемии при ВЗК [21, 23]. Такие состояния часто в литературе описываются как ЖДА + АХБ [12].
Принципы терапии ЖДА
Основные принципы терапии ЖДА:
- До начала лечения обязательно необходимо выявить и устранить причину развития ЖДА.
- Для лечения надо использовать только лекарственные железосодержащие препараты.
- Независимо от тяжести анемии лечение начинается с пероральных препаратов (с учетом противопоказаний: острых язв желудка и ДПК, эрозивного гастрита), невозможности использования или неэффективного приема пероральных препаратов в анамнезе).
- Лечебная доза пероральных препаратов железа составляет 100–200 мг элементарного железа в сутки (максимально 300 мг), разделенные на 2 приема.
- Использование парентеральных средств возможно лишь при доказанном абсолютном дефиците железа, лечение должно проводиться только в стационаре, используется только расчетная доза.
- В/м введение препаратов железа в настоящее время не используется.
- Сроки лечения при использовании пероральных препаратов железа зависят от тяжести анемии, составляют от 1 мес. при латентном дефиците железа до 3–4 мес. при использовании 2-валентного железа или 4–6 мес. при использовании 3-валентного железа.
- Эффективность лечения определяется по приросту гемоглобина через 1 мес. после начала лечения (не менее 10 г/л/мес.).
- Основанием для прекращения терапии является нормализация не уровня гемоглобина, а содержания железа в депо (ФС более 30–50 мкг/л).
Алгоритм лечения и оценка эффективности ЖДА представлены на рисунке 2.
Особенности лечения ЖДА при заболеваниях ЖКТ
Как уже говорилось, обязательные условия успешности терапии анемии, вызванной хронической кровопотерей (наиболее частая причина ЖДА у пациентов гастроэнтерологического профиля), – выявление источника кровопотери и его устранение.
Трудности и зачастую споры среди специалистов-гастроэнтерологов вызывает вопрос терапии железодефицитных состояний, сопровождающих ВЗК (болезнь Крона, язвенный колит).
Традиционно для лечения ЖДА используются пероральные препараты железа. Однако также известно, что при ВЗК всасывание таких препаратов может быть снижено, что влияет на эффективность терапии, и их использование может приводить к обострению ВЗК. Помимо этого, терапия пероральными препаратами железа у больных с ВЗК связана с частым развитием таких побочных эффектов, как тошнота, абдоминальная боль, диспепсия, что снижает приверженность пациентов к лечению [19, 21].
Согласно результатам опубликованного в 2014 г. исследования, посвященного сравнению эффективности терапии ЖДА у разных групп больных, при лечении питьевым раствором глюконата 2-валентного железа, меди и марганца пациентов с патологией ЖКТ и ЖДА, наблюдались хороший прирост уровня гемоглобина, но медленное и недостаточное восполнение запасов железа в депо. В этой группе побочные эффекты ферротерапии в виде диспепсических расстройств встречались чаще всего (в 20% случаев) [5].
Работы на животных моделях с применением пероральной ферротерапии продемонстрировали связь механизма обострения ВЗК с развитием оксидативного стресса, появлением свободных радикалов в клетках слизистой оболочки кишечника, что приводит к ее повреждению [17, 31]. Согласно результатам подобных исследований на больных, у пациентов с болезнью Крона и язвенным колитом демонстрируются снижение уровней плазменных антиоксидантов (таких как цистеин и глутатион) и повышение титров маркеров активности ВЗК при приеме пероральных препаратов железа [16, 18, 30].
Все это явилось причиной увеличения роли использования препаратов железа для в/в введения в терапии ЖДА у больных ВЗК [19, 23, 27]. Среди таких препаратов железа наиболее широкое применение в настоящее время нашли железа (III) гидроксид сахарозный комплекс (ЖСК, 100 мг железа в 5 мл), железа карбоксимальтозат (ЖКМ, 50 мг железа в 1 мл) и железа (III) гидроксид декстран (50 мг железа в 1 мл). Как правило, одномоментно вводят 100–200 мг, но, используя ЖКМ, однократную дозу можно увеличить до 1000 мг [13, 28].
Стоит отметить, что применение декстранов сопряжено с высоким риском анафилактических реакций. ЖСК и ЖКМ практически лишены такого риска [23, 29]. Тем не менее препараты железа для в/в введения должны применяться под контролем врача в условиях стационара, дозировки должны быть строго рассчитаны [13].
В 2012 г. проведен метаанализ публикаций, где сравнивали режимы с использованием в/в и пероральных форм железа в терапии взрослых больных ЖДА с ВЗК. Проанализировано 757 публикаций, при этом отмечено: более значительный прирост уровня гемоглобина отмечен в группе, получавшей внутривенные формы препаратов железа, индекс активности ВЗК и уровень качества жизни были сопоставимы в 2-х группах, а в группе пероральных препаратов железа отмечалось больше побочных эффектов [30].
В 2011 г. проведено рандомизированное контролируемое открытое мультицентровое исследование по применению препаратов железа для в/в введения в терапии ЖДА у больных ВЗК, где проводилось сравнение эффективности и безопасности применения ЖКМ в фиксированной дозе с индивидуально подобранными дозировками ЖСК. В исследование было включено 485 пациентов с ЖДА легкой и средней степени тяжести, проходивших лечение в 88 клиниках 14 стран мира. Больные получали либо ЖКМ (максимально 3 инъекции по 1000 или 500 мг железа), либо ЖСК в дозах, рассчитанных по формуле Ganzoni (максимально 11 инъекций по 200 мг железа). Согласно полученным результатам, большее число пациентов, получавших ЖКМ, достигло терапевтического эффекта, у этих больных была выше приверженность лечению, при этом оба режима хорошо переносились [28].
Однако зачастую анемия при ВЗК остается резистентной к терапии препаратами железа. Это может быть вызвано доминированием роли хронического воспаления, влиянием провоспалительных цитокинов на эритропоэз и гепцидина на перераспределение железа в организме больного [23]. Показано, что у пациентов с болезнью Крона и язвенным колитом, сопровождающихся анемией, уровень сывороточного эритропоэтина неадекватно низок степени анемии [22, 24], что является важнейшим признаком АХБ [11]. Это может быть обусловлено прямым ингибирующим действием провоспалительных цитокинов на выработку эритропоэтина почками [20].
Согласно C. Gasche et al., у большинства пациентов с анемией при ВЗК успешность терапии может быть достигнута путем использования комбинации ЖСК с препаратами эритропоэтина [23].
Заключение
ЖДА представляет собой важную, социально значимую проблему. Сочетание ЖДА с патологическими состояниями других систем организма, особенно часто – ЖКТ, вызывает определенные трудности при диагностике и лечении. Разработка современных рекомендаций с учетом этиологии и патогенеза дефицита железа у указанной группы больных позволит значительно повысить качество и эффективность оказания медицинской помощи при ЖДА.
Дата публикации 18 июля 2020Обновлено 18 июля 2020
Определение болезни. Причины заболевания
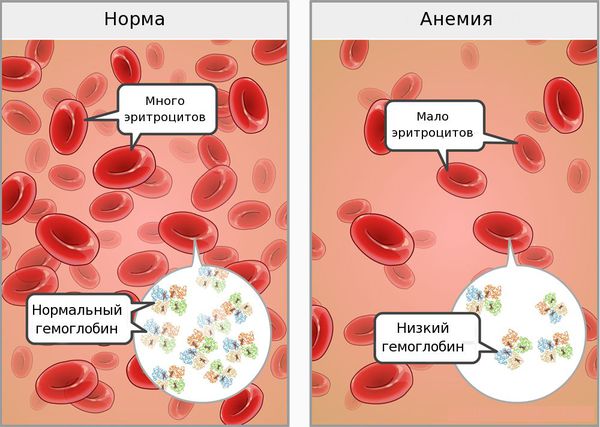
Железодефицитная анемия (ЖДА) — состояние, при котором недостаток железа в организме приводит к снижению количества эритроцитов. При анемии возникают нарушения со стороны кожи и слизистых оболочек, быстрая утомляемость, головокружения и обмороки. Дефицит железа связан с нарушением его поступления, усвоения или повышенными потерями крови [1].
По данным Всемирной организации здравоохранения, в мире более двух миллиардов людей страдают ЖДА, в основном это женщины и дети [5]. Из всех анемий ЖДА составляют 80 % [2]. Эта проблема актуальна и для России, с ней сталкиваются врачи почти всех специальностей.
Основные причины развития ЖДА:
- Несбалансированное питание с нехваткой железа и преобладанием мучных и молочных продуктов (дефицит красного мяса и белка в пище, голодание, недоедание, однообразная пища, вегетарианство, искусственное вскармливание у детей, нервная анорексия) [1].
- Повышенная потребность в железе (беременность, лактация, период интенсивного роста и полового созревания, тяжёлая физическая работа, интенсивные занятия спортом, паразитарные инвазии кишечника) [1].
- Повышенные хронические потери железа (наружные или внутренние):
- частые кровотечения из дёсен;
- носовые кровотечения;
- эрозивный эзофагит;
- желудочные кровопотери — эрозии и язвы желудка, грыжи пищеводного отверстия диафрагмы, опухоли желудка;
- кишечные кровопотери — эрозии и язвы двенадцатиперстной кишки, язвенный колит, опухоли кишечника, полипы и дивертикулы кишечника (выпячивание кишечной стенки), геморроидальные кровотечения;
- маточные кровопотери — обильные и/или длительные менструации, аномальные маточные кровотечения, миома матки, эндометриоз, рак матки;
- почечные кровопотери — гематурическая форма хронического гломерулонефрита, рак мочевого пузыря, почек и мочевыводящих путей;
- геморрагические диатезы — коагулопатии (нарушение свёртываемости крови), тромбоцитопении (снижение количества тромбоцитов), тромбоцитопатии (дефект тромбоцитов), васкулиты (воспаление кровеносных сосудов) и коллагенозы (поражение соединительной ткани);
- донорство при регулярной сдаче крови пять и более раз в год [2][8].
- Нарушение ионизации железа в желудке — атрофический гастрит, гиповитаминоз С, резекция желудка (операция по удалению значительной части желудка).
- Нарушение всасывания железа в кишечнике — дуоденит (воспаление двенадцатиперстной кишки), хронические энтериты (воспаление тонкого кишечника), целиакия, резекция кишечника [2][8].
- Нарушение транспорта железа вследствие уменьшения количества трансферрина — белка, связывающегося с железом для переноса его в молекулу гемоглобина (при циррозах, инфекционных заболеваниях, уремии, туберкулёзе).
- Недостаточный исходный уровень железа в организме у детей, рождённых от матерей с низким уровнем гемоглобина крови.
Группы риска по ЖДА:
- дети (недоношенные, дети от 6 месяцев до 3 лет, подростки старше 12 лет);
- менструирующие женщины;
- женщины в период беременности и лактации;
- доноры;
- люди старше 60 лет.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы железодефицитной анемии
Недостаток железа в организме проявляется двумя синдромами — сидеропеническим и анемическим [2][8].
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
- сухость, дряблость, шелушение и трещины на коже;
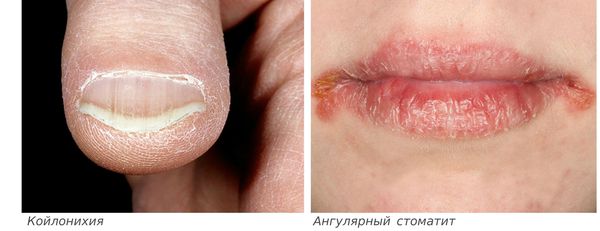
- ломкость и слоистость ногтей, их поперечная исчерченность, койлонихия (ногти становятся плоскими, иногда принимают вогнутую “ложкообразную” форму);
- ангулярный стоматит (изъязвления и трещины в уголках рта);
- ломкость и выпадение волос (волосы теряют блеск, истончаются, секутся, редеют и рано седеют);
- извращение вкуса и пристрастие к непищевым продуктам — к мелу, извести, глине, углю, краскам, земле и т. д.; причина этого симптома неизвестна, но он часто встречается при ЖДА;
- изменение обоняния и тяга к токсическим веществами — к бензину, керосину, мазуту, ацетону, лакам, краскам, гуталину, выхлопным газам, т. е. токсикомания; данный симптом необъясним, но тоже достаточно специфичен для ЖДА и полностью проходит на фоне приёма препаратов железа;
- дистрофические процессы в желудочно-кишечном тракте — глоссит (болезненность и жжение языка), гингивит, кариес, склонность к пародонтозу, атрофический гастрит и энтерит, сидеропеническая дисфагия или синдром Пламмера — Винсона (затруднённое глотание сухой и твёрдой пищи и даже слюны) [8];
- недостаточность мышечных сфинктеров (недержание мочи при кашле, смехе, непреодолимые позывы к мочеиспусканию, возможно ночное недержание мочи).
При осмотре обращает на себя внимание бледность кожных покровов, часто с зеленоватым оттенком (“хлороз”) и симптом голубых склер — дистрофические изменения роговицы глаза, через которые просвечивают сосудистые сплетения, создающие “синеву” [2][8].
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием “мушек” перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 °С), которое исчезает после лечения железосодержащими препаратами.
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
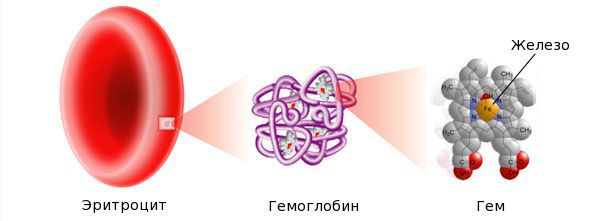
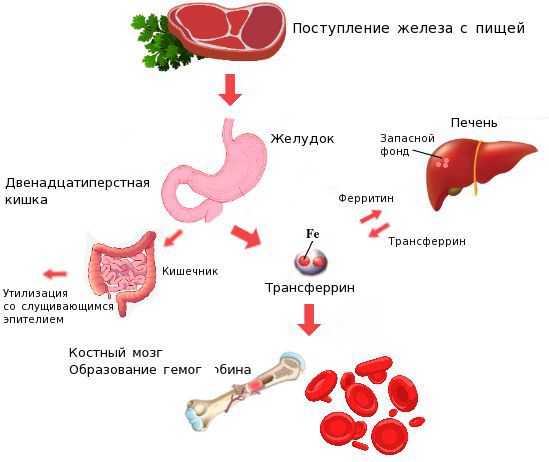
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При недостатке железо поступает в кровоток и соединяется, как уже упоминалось, с трансферрином. Далее через систему воротной вены железо направляется в печень, где запасается в составе белка ферритина. Другая часть железа в составе трансферрина транспортируется к клеткам красного костного мозга и используется для образования гемоглобина, а также участвует в тканевых окислительно-восстановительных реакциях [5][9].
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Если нарушается включение железа в трансферрин, то оно не доходит до органов депо и клеток красного костного мозга. При этом нарушается образование гемоглобина, а также белков, содержащих железо (миоглобин, железосодержащие тканевые ферменты), что также ведёт к развитию анемии [9].
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
- снижение железа в депо (снижение ферритина);
- нормальный уровень сывороточного железа;
- нормальный уровень гемоглобина и эритроцитов;
- отсутствие тканевых проявлений (нет сидеропенического синдрома) [4][6].
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
- снижением железа в депо (снижение ферритина);
- снижением уровня сывороточного железа;
- нормальным уровнем гемоглобина и эритроцитов;
- повышением общей железосвязывающей способности сыворотки (ОЖСС);
- отсутствием гемосидерина (пигмента, состоящего из оксида железа, он образуется при распаде гемоглобина) в макрофагах костного мозга;
- наличием тканевых проявлений (сидеропенический синдром) [4][6].
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
- снижение железа в депо (снижение ферритина);
- снижение уровня сывороточного железа;
- снижение уровня гемоглобина и эритроцитов;
- повышение общей железосвязывающей способности сыворотки (ОЖСС);
- отсутствие гемосидерина в макрофагах костного мозга;
- наличие тканевых проявлений (сидеропенический синдром);
- повышение растворимых трансферриновых рецепторов (рТФР);
- снижение коэффициента насыщения трансферрина железом (НТЖ);
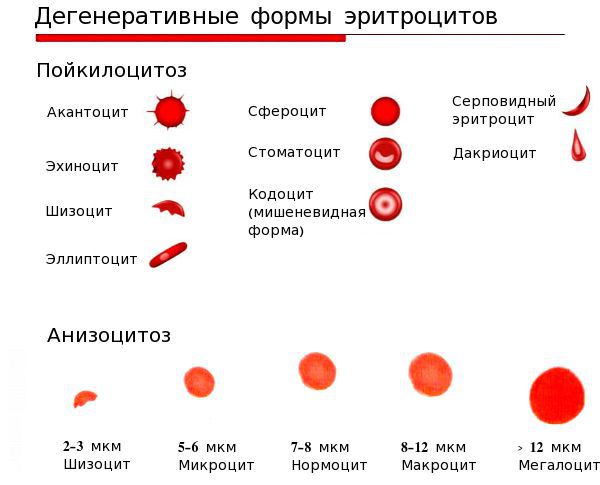
- анизоцитоз — изменение размеров эритроцитов;
- пойкилоцитоз — изменение формы эритроцитов [4][6].
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
- I — лёгкая степень: Hb от 90 до 120 г/л;
- II — средняя степень: Hb от 70 до 89 г/л;
- III — тяжёлая степень: Hb менее 70 г/л.
Осложнения железодефицитной анемии
Осложнения возникают при анемии, нелеченной более 5 лет. Тяжёлая ЖДА может привести к развитию миокардиодистрофии — поражению мышечного слоя сердца, снижению его сократительной функции и развитию сердечной недостаточности.
При ЖДА возникают сбои в работе иммунной системы, а это приводит к частым бактериальным и вирусным инфекциям (ОРВИ, гриппу, обострениям тонзиллита, бронхита, гайморита) [2][8].
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Также при длительном и тяжёлом течении ЖДА нарушаются функции печени и происходят/> изменения со стороны репродуктивной сферы (нарушается менструальный цикл) [2][8].
Нередко встречаются проблемы и со стороны нервной системы — повышенная раздражительность, нервозность, плаксивость, снижение памяти, внимания, мышления и др./> С длительным дефицитом железа связывают развитие болезней Паркинсона и Альцгеймера, так как железо участвует в процессах миелинизации нервных волокон центральной нервной системы [6]. Конечно, сама по себе ЖДА не может привести к развитию этих заболеваний, но в пожилом возрасте в совокупности с хроническим воспалением в ЖКТ, повышенным уровнем холестерина в крови и сахарным диабетом анемия ускоряет развитие болезней Альцгеймера и Паркинсона.
Редким и тяжёлым осложнением ЖДА является гипоксическая кома. Ей предшествует резкое побледнение кожных покровов и видимых слизистых, судороги, а затем потеря сознания. Гипоксия из-за недостатка железа осложняет течение уже имеющихся сердечно-лёгочных заболеваний, таких как ишемическая болезнь сердца, бронхиальная астма, хроническая ишемия головного мозга и способствует развитию неотложных состояний — острому или повторному инфаркту миокарда и острому нарушению мозгового кровообращения (инсульту).
Диагностика железодефицитной анемии
Минимальный объём исследований:
- клинический анализ крови с лейкоцитарной формулой;
- биохимический анализ крови (ферритин, сывороточное железо, общая железосвязывающая способность сыворотки, коэффициент насыщения трансферрина железом, растворимые трансферриновые рецепторы).
Клинический анализ крови с лейкоцитарной формулой показывает снижение уровня гемоглобина и эритроцитов, цветового показателя крови, среднего объём эритроцита (MCV), среднего содержания гемоглобина в эритроците (МСН), средней концентрации гемоглобина в эритроците (MCHC), повышение степени анизоцитоза эритроцитов (RDW), иногда может быть увеличена скорость оседания эритроцитов (СОЭ) [1].
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.

При лечение больных с ЖДА необходимо учитывать характер основного заболевания и наличие сопутствующей патологии, возраст больных (дети, старики), степень выраженности анемического синдрома и дефицита железа, переносимость препаратов железа и т. д [3].
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
В течение двух часов до или после приёма препаратов железа не рекомендуется употреблять кофе и кофеин-содержащие напитки (какао, шоколад, чай), крупы (рожь, ячмень, овес, пшеница), орехи, бобовые, молоко, яйца и молочные продукты, жирные и мучные продукты, а также некоторые лекарственные препараты и витамины, содержащие кальций, магний, цинк, селен, йод, хром. Это поможет избежать ухудшения усвоения железа. Все препараты железа назначаются врачом индивидуально. Курс лечения составляет не менее 1,5-2 месяцев, возможно, и дольше. Кроме восстановления уровня железа в крови, нужно создать его запас в организме, то есть повысить уровень ферритина. Об успехе лечения говорит нормализация уровня гемоглобина через 1-2 месяца [9][10].
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это д
