Точечные мутации в гемоглобине
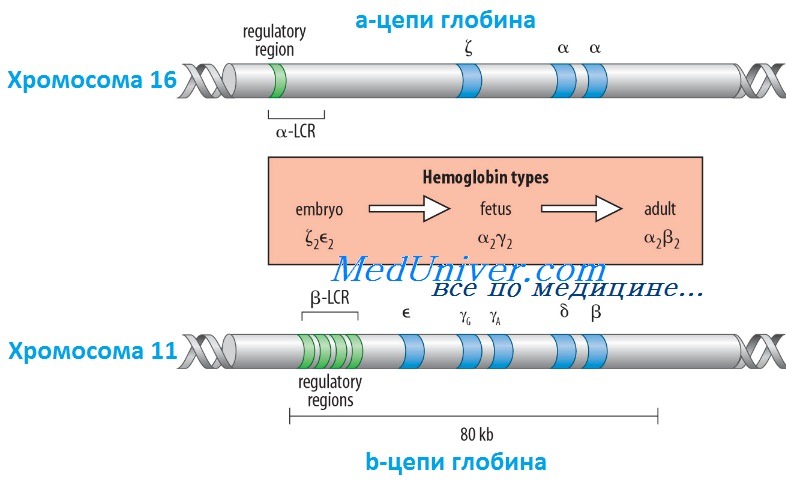
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Аномальный белок, переносящий кислород ко всем органам тела и различным тканям, образуется в результате генетической аномалии.
- Аномальные гемоглобины C, E и D (Hb-C, Hb-D, Hb-E)
- Гемоглобинопатия
- Гемолитическая болезнь, вызванная неустойчивым гемоглобином
- Стоматоцитоз
- Виды гемолитических анемий
Гемоглобин C, E и D — это аномальные типы гемоглобина, вызванные генными мутациями. Они характеризуются аномально сформированными эритроцитами и хронической анемией, приводящей к ускоренному разрушению эритроцитов.
Аномальные гемоглобины C, E и D (Hb-C, Hb-E, Hb-D)
Гемоглобин С в основном регистрируется у афроамериканцев и другого темнокожего населения земли. Экземпляр гена, вызывающего заболевание, присутствует у примерно 2-3% темнокожих людей по всему миру. Однако для развития заболевания ребенок должен унаследовать копию гена и от отца, и от матери. Общие симптомы немногочисленны. Первый из них — это анемия. Она может иметь разную степень тяжести. У детей наблюдаются боли в животе и суставах, увеличение селезенки, желтуха, при серьезных формах заболевания с сопутствующими инфекциями может также возникать серповидноклеточная анемия.
Гемоглобин Е свойствен жителям Юго-Восточной Азии. Эта болезнь, как и другие случаи аномального гемоглобина, вызывает анемию, симптомы которой схожи с серповидноклеточной анемией, но протекают намного мягче.
Для эффективной диагностики и обнаружения подобных генетических аномалий гемоглобина требуется анализ с электрофорезом. Кровь в процессе воздействия на нее электрического тока при наличии различных типов гемоглобина разделяется, поэтому становится возможным детальный анализ. Лечение может быть не обязательным, если состояние человека до диагностики было стабильным. При плохом самочувствии больному могут назначить переливание крови и прием лекарственных препаратов, а также витаминов (фолиевой кислоты, витамина Е).
Гемоглобин D вызывает гомозиготное заболевание, выражающееся в форме мягкой гемолитической анемии и легкой или умеренной спленомегалии. Гетерозиготная форма гемоглобина D клинически не проявляется, однако наследование дефектного гена от обоих родителей приводит к серьезным заболеваниям, в том числе серповидноклеточной анемии, хронической гемолитической анемии. Основной гомозиготной болезнью гемоглобина D является бета-талассемия. Также были выявлены случаи связи между бета-талассемией и возникновением гематологических злокачественных опухолей.
Электрофоретическая подвижность гемоглобина D придает ему сходство с гемоглобином S, но степень их подвижности различается. Возможно обнаружение этого вида гемоглобина еще в утробе. Географическая распространенность такова, что чаще всего от этого заболевания страдает население Индии, Ирана и Пакистана. Обнаружены также спорадические случаи заболевания среди жителей Европы и Африки.
Гемоглобин D проявляется в четырех формах болезни: бета-талассемия, болезнь гемоглобина SD, гомозиготная форма, гетерозиготная форма.
Гемоглобинопатия
Гемоглобинопатия является своего рода генетическим дефектом, который приводит к созданию некорректной структуры одной из цепей глобина молекулы гемоглобина. Гемоглобинопатия наследуется от одного из родителей, однако в большинстве случаев человек только является носителем заболевания, но оно не проявляется.
Общие признаки гемоглобинопатии похожи на симптомы серповидноклеточной анемии, а именно: болевые ощущения, язвы на поверхности голеней, артрит, отеки ног и рук, некроз, повреждения глаз, нарушения функции легких и сердца.
Гемоглобинопатия означает, что в глобине, входящем в состав белков, имеют место структурные аномалии. При талассемии, напротив, количество нормальных белков глобина сокращено, а не видоизменено. Два этих состояния могут сочетаться, в результате чего гемоглобинопатия может быть связана с талассемией. Некоторые случаи гемоглобинопатии сопровождаются талассемией, однако не все. Некоторые отклонения в нормальном составе гемоглобина влияют на нормальное развитие эмбриона в утробе, кроме того, ребенок, который является носителем мутантного гена, может передавать его следующим поколениям.
Гемолитическая болезнь, вызванная неустойчивым гемоглобином
Некоторые мутации гемоглобина способствуют уменьшению растворимости молекулы в эритроците. Изменения в первичной последовательности глобина в этих нестабильных белках могут изменить третичную или четвертичную структуру молекулы, в результате чего полипептид глобина становится нестабильным и осаждается внутриклеточно. Такой внутриэритроцитарный осадок обнаруживается при помощи суправитального окрашивания, в итоге становятся заметными темные округлые участки, называемые тельцами Гейнца. Пораженные эритроциты имеют более короткую продолжительность жизни, приводя к появлению гемолитического синдрома различной степени тяжести. Он называется также синдром гемолитический анемии с врожденными тельцами Гейнца.
Клиническая картина имеет слабое или умеренное проявление. Как правило, у больных наблюдается нормоцитарная анемия, спленомегалия. Диагноз устанавливается на основании обнаружения телец Гейнца в эритроцитах, нестабильности гемоглобина в красном гемолизате клеток, а также наличии пигментурии (миоглобинурии). Последнее состояние означает, что в моче обнаруживается белок, высвобождающийся в результате распада мышц.
Нестабильный (неустойчивый) гемоглобин является редким мутационным состоянием, и обычно передается в пределах одной семьи или территориального участка (например, в одном селе или регионе). Дети с неустойчивым бета-глобином могут не проявлять признаков болезни при рождении, однако после первого года жизни может проявиться спленомегалия, несфероцитарная гемолитическая анемия и камни в желчном пузыре.
Стоматоцитоз
Стоматоцитоз — это состояние эритроцитов, при котором на средней (центральной) части эритроцита появляется бледный участок в форме рта. Эти клетки становятся причиной приобретенной гемолитической анемии, но также могут быть показателем врожденной гемолитической анемии.
Существует две формы стоматоцитоза: наследственная, приобретенная (от обезвоживания в результате алкоголя).
Врожденная форма стоматоцитоза начинает проявляться очень рано — практически с первых дней жизни. Для врожденной формы характерна высокая хрупкость эритроцитов и причины её, естественно, генетического характера, в то время как приобретенная форма стоматоцитоза вызывается в основном чрезмерным приемом алкоголя. Стоматоцитоз периферической крови и гемолиз исчезают в течение 2-х недель алкогольной абстиненции.
При стоматоцитозе изменяется проницаемость клеточных мембран для одновалентных катионов, у пациента развивается гемолитическая анемия.
Прочие симптомы: появление камней в желчном пузыре, гепатоспленомегалия, спленомегалия. На электрофорезе крови видно, что мембранный белок стоматин отсутствует или присутствует только в малых количествах.
Лечение стоматоцитоза
Лечение заключается в переливании крови, при необходимости удаляются камни в желчном пузыре, устраняется перенасыщение железом. Несмотря на увеличение селезенки, спленэктомия противопоказана больным стоматоцитозом, поскольку она может вызвать венозные тромбоэмболические осложнения.
При правильном управлении заболеванием прогноз благоприятен.
Виды гемолитических анемий
К уточненным видам гемолитических анемий относятся такие заболевания:
- наследственный сфероцитоз (или овалоцитоз);
- дефицит глюкозо-6-фосфат дегидрогеназы (G6PD или примахиновая анемия);
- дефицит пируваткиназы;
- дефицит альдолазы;
- серповидноклеточная анемия;
- врожденная дизэритропоэтическая анемия;
- талассемии различных типов (альфа, бета и т.д.).
По типам причин возникновения гемолитические анемии разделяются на:
- Результат дефекта эритроцитной мембраны.
- Нарушение ферментной активности эритроцитов.
- Нарушения в процессе синтеза или структуре гемоглобина.
- Возникшие под действием антител.
- Результат соматической мутации.
- Механическое нарушение целостности эритроцитной оболочки.
- Химическое повреждение оболочки красной кровяной клетки.
- Недостаток витаминов.
- Паразитарные поражения (например, малярийный плазмодий).
Источники статьи:
https://www.merckmanuals.com
https://ispub.com
https://web2.airmail.net
https://en.wikipedia.org
https://www.uptodate.com
https://www.merckmanuals.com
По материалам:
Merck & Co., Inc., Kenilworth, NJ, USA
Dr. Devenkumar Vasantray Desai
Ed Uthman, MD; Diplomate, American Board of Pathology
Wikimedia Foundation, Inc
© 2015 UpToDate, Inc.
© 2015 Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., Kenilworth, NJ., USA
Смотрите также:
У нас также читают:
- Плоскостопие
- Гайморит в вопросах и ответах, лечение травами гайморита
- Кожные болезни (угри, прыщи, нарывы, фурункулы, экзема, себорея), лечение травами
- Противозачаточные препараты, контрацепция, гормоны, оргазм
Аномальные виды гемоглобинов
Аномальные гемоглобины возникают в результате мутации генов, кодирующих a и b цепи. Известно несколько сотен мутантных гемоглобинов человека (в большинстве случаев функционально активных).
Таблица №1 замена аминокислот в a и b пептидных цепях гемоглобина
| тип гемоглобина | нормальный остаток и его положение в цепи | замена |
| С | глу 6 в b – цепи | лиз |
| Дb | лей 28 в b – цепи | глу |
| Е | глу 26 в b – цепи | лиз |
| G | глу 43 в b – цепи | ала |
| GpH | асл 68 в a – цепи | лиз |
| J | лиз 16 в a- цепи | асл |
| М | вал 67 в b – цепи | глу |
| О | глу 116 в a – цепи | лиз |
| S | глу 6 в b – цепи | вал |
Болезни гемоглобинов называют гемоглобинозами, их насчитывают более 200.
Гемоглобинозы делятся на гемоглобинопатии и таласемии.
Гемоглобинопатии, возникают в результате точечных мутаций в структурных генах, кодирующих полипептидные цепи гемоглобина. Поэтому в крови появляется аномальный гемоглобин.
Серповидноклеточная анемия – классический пример наследственной гемоглобинопатии. В норме в b-субъединицах гемоглобина в шестом положении находится гидрофильная глутаминовая кислота. В гемоглобине S глутаминовая кислота заменена на гидрофобный валин. Такая замена приводит к появлению на поверхности b-субъединицы гидрофобного («липкого») участка, который соединяется с гидрофобным карманом другой молекулы гемоглобина S. Происходит полимеризация гемоглобина S и его осаждение в виде длинных волокон. Длинная волокнистая структура нарушает нормальную форму эритроцитов, превращая её из двояковогнутого диска в серповидную, которая имеет тенденцию блокировать капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. Если поражены обе гомологичные хромосомы, заболевание может оказаться смертельным. Заболевание широко распространено в географических зонах, где наиболее часто встречается злокачественная форма малярии. Высокий показатель заболеваемости можно объяснить положительной селекцией генома носителей аномальных генов. Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия.
Существенное ухудшение состояния больных наблюдается в условиях высокогорья при низких давлениях кислорода. Это связано с тем, что полимеризоваться способна только дезоксиформа S гемоглобина. Так как в молекуле оксиформы S-гемоглобина нет гидрофобного кармана («липкого участка»), и она не способна к полимеризации.
Талассемия – генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. При данном заболевании отсутствуют дефекты в структурных генах, кодирующих a, b, g,d -цепи.
Причиной талассемий являются мутации генов-операторов, контролирующих транскрипцию структурных генов a, b, g,d -цепей гемоглобина.
В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров.
В зависимости от того, формирование какой глобиновой цепи нарушается, выделяют a, b, g, e – талассемии.
Талассемии делятся так же на гомозиготные и гетерозиготные.
Гомозиготная b-талассемия – формирование b-цепи полностью подавляется. Симптомы заболевания появляются приблизительно через полгода после рождения, когда происходит полное переключение синтеза g-цепи гемоглобина F на b-цепь. У ребенка прогрессирует анемия. Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты (из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос приплюснут), при рентгенологическом исследовании черепа наблюдается феномен «игл ежа» («hair – standing –on –end»). В попытке восполнить эритроциты, утраченные в результате не эффективного эритропоэза и увеличении гемолиза, ткани черепа, чрезмерно разрастаясь и гипертрофируясь, порождают такое изменение медуллярной пластинки.
α-талассемия – недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Для всех этих заболеваний характерны некоторые общие закономерности:
1). нарушаются пропорции в составе гемоглобина крови. Например, при b- талассемии в крови появляется 15% гемоглобина А2, 15 – 60% гемоглобина F;
2). эритроциты приобретают не нормальную форму (мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии.
