Транспорт углекислого газа гемоглобином

Переносчиком кислорода от легких к тканям и углекислого газа от тканей к легким является кровь. В свободном (растворенном) состоянии переносится лишь небольшое количество этих газов. Основное количество кислорода и углекислого газа переносится в связанном состоянии.
Транспорт кислорода. Кислород, растворяющийся в плазме крови капилляров малого круга кровообращения, диффундирует в эритроциты, сразу связывается с гемоглобином, образуя оксигемоглобин. Скорость связывания кислорода велика: время полунасыщения гемоглобина кислородом около 3 мс. Один грамм гемоглобина связывает 1,34 мл кислорода, в 100 мл крови 16 г гемоглобина и, следовательно, 19,0 мл кислорода. Эта величина называется кислородной емкостью крови (КЕК).
Превращение гемоглобина в оксигемоглобин определяется напряжением растворенного кислорода. Графически эта зависимость выражается кривой диссоциации оксигемоглобина (рис. 6.3).
На рисунке видно, что даже при небольшом парциальном давлении кислорода (40 мм рт. ст.) с ним связывается 75—80% гемоглобина. [1]
При давлении 80—90 мм рт. ст. гемоглобин почти полностью насыщается кислородом.
Рис. 6.3. Кривая диссоциации оксигемоглобина
Кривая диссоциации имеет 5-образную форму и состоит из двух частей — крутой и отлогой. Отлогая часть кривой, соответствующая высоким (более 60 мм рт. ст.) напряжениям кислорода, свидетельствует о том, что в этих условиях содержание оксигемоглобина лишь слабо зависит от напряжения кислорода и его парциального давления во вдыхаемом и альвеолярном воздухе. Верхняя отлогая часть кривой диссоциации отражает способность гемоглобина связывать большие количества кислорода, несмотря на умеренное снижение его парциального давления во вдыхаемом воздухе. В этих условиях ткани достаточно снабжаются кислородом (точка насыщения).
Крутая часть кривой диссоциации соответствует напряжению кислорода, обычному для тканей организма (35 мм рт. ст. и ниже). В тканях, поглощающих много кислорода (работающие мышцы, печень, почки), оксигемоглобин диссоциирует в большей степени, иногда почти полностью. В тканях, в которых интенсивность окислительных процессов мала, большая часть оксигемоглобина не диссоциирует.
Свойство гемоглобина — легко насыщаться кислородом даже при небольших давлениях и легко его отдавать — очень важно. Благодаря легкой отдаче гемоглобином кислорода при снижении его парциального давления обеспечивается бесперебойное снабжение тканей кислородом, в которых вследствие постоянного потребления кислорода его парциальное давление равно нулю.
Распад оксигемоглобина на гемоглобин и кислород увеличивается с повышением температуры тела (рис. 6.4[2]).
Рис. 6.4. Кривые насыщения гемоглобина кислородом при разных условиях:
А — в зависимости от реакции среды (pH); Б — от температуры; В — от содержания солей; Г — от содержания углекислого газа. По оси абцисс — парциальное давление кислорода (в мм рт. ст.), по оси ординат — степень насыщения (в %)
Диссоциация оксигемоглобина зависит от реакции среды плазмы крови. С увеличением кислотности крови возрастает диссоциация оксигемоглобина (рис. 6.4, А).
Связывание гемоглобина с кислородом в воде осуществляется быстро, но полного его насыщения не достигается, как и не происходит полной отдачи кислорода при снижении его парциального давления. Более полное насыщение гемоглобина кислородом и полная его отдача при понижении напряжения кислорода происходят в растворах солей и в плазме крови (см. рис. 6.4, В).
Особое значение в связывании гемоглобина с кислородом имеет содержание углекислого газа в крови: чем больше его содержание в крови, тем меньше связывается гемоглобина с кислородом и тем быстрее происходит диссоциация оксигемоглобина. На рис. 6.4, Г показаны кривые диссоциации оксигемоглобина при разном содержании углекислого газа в крови. Особенно резко понижается способность гемоглобина соединяться с кислородом при давлении углекислого газа, равном 46 мм рт. ст., т.е. при величине, соответствующей напряжению углекислого газа в венозной крови. Влияние углекислого газа на диссоциацию оксигемоглобина очень важно для переноса газов в легких и тканях.
В тканях содержится большое количество углекислого газа и других кислых продуктов распада, образующихся в результате обмена веществ. Переходя в артериальную кровь тканевых капилляров, они способствуют более быстрому распаду оксигемоглобина и отдаче кислорода тканям.
В легких же по мере выделения углекислого газа из венозной крови в альвеолярный воздух с уменьшением содержания углекислого газа в крови увеличивается способность гемоглобина соединяться с кислородом. Тем самым обеспечивается превращение венозной крови в артериальную.
Транспорт углекислого газа. Известны три формы транспорта двуокиси углерода:
- • физически растворенный газ — 5—10%, или 2,5 мл/100 мл крови;
- • химически связанный в бикарбонатах: в плазме NaHC03, в эритроцитах КНС03 — 80-90%, т.е. 51 мл/100 мл крови;
- • химически связанный в карбаминовых соединениях гемоглобина — 5—15%, или 4,5 мл/100 мл крови.
Углекислый газ непрерывно образуется в клетках и диффундирует в кровь тканевых капилляров. В эритроцитах он соединяется с водой и образует угольную кислоту. Этот процесс катализируется (ускоряется в 20 000 раз) ферментом карбоангидразой. Карбоангидраза содержится в эритроцитах, в плазме крови ее нет. Поэтому гидратация углекислого газа происходит практически только в эритроцитах. В зависимости от напряжения углекислого газа карбоангидраза катализируется с образованием угольной кислоты, так и расщеплением ее на углекислый газ и воду (в капиллярах легких).
Часть молекул углекислого газа соединяется в эритроцитах с гемоглобином, образуя карбогемоглобин.
Благодаря указанным процессам связывания напряжение углекислого газа в эритроцитах оказывается невысоким. Поэтому все новые количества углекислого газа диффундируют внутрь эритроцитов. Концентрация ионов НС03-, образующихся при диссоциации солей угольной кислоты, в эритроцитах возрастает. Мембрана эритроцитов обладает высокой проницаемостью для анионов. Поэтому часть ионов НС03- переходит в плазму крови. Взамен ионов НС03- в эритроциты из плазмы входят ионы С1_, отрицательные заряды которых уравновешиваются ионами К+. В плазме крови увеличивается количество бикарбоната натрия (NaHC03-).
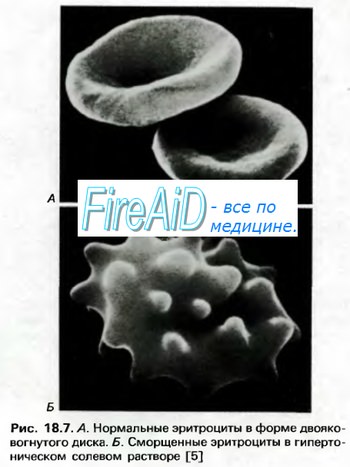
Накопление ионов внутри эритроцитов сопровождается повышением в них осмотического давления. Поэтому объем эритроцитов в капиллярах большого круга кровообращения несколько увеличивается.
Для связывания большей части углекислого газа исключительно большое значение имеют свойства гемоглобина как кислоты. Окси- гемоглобин имеет константу диссоциации в 70 раз большую, чем дезоксигемоглобин. Оксигемоглобин — более сильная кислота, чем угольная, а дезоксигемоглобин — более слабая. Поэтому в артериальной крови оксигемоглобин, вытеснивший ионы К+ из бикарбонатов, переносится в виде соли КНЬ02. В тканевых капиллярах КНЬ02 отдает кислород и превращается в КНЬ. Из него угольная кислота как более сильная вытесняет ионы К+:
Таким образом, превращение оксигемоглобина в гемоглобин сопровождается увеличением способности крови связывать углекислый газ. Это явление носит название эффекта Холдейна. Гемоглобин служит источником катионов (К+), необходимых для связывания угольной кислоты в форме бикарбонатов.
Итак, в эритроцитах тканевых капилляров образуется дополнительное количество бикарбоната калия, а также карбогемоглобин, а в плазме крови увеличивается количество бикарбоната натрия. В таком виде углекислый газ переносится к легким.
В капиллярах малого круга кровообращения напряжение углекислого газа снижается. От карбогемоглобина отщепляется С02. Одновременно происходит образование оксигемоглобина, увеличивается его диссоциация. Оксигемоглобин вытесняет калий из бикарбонатов. Угольная кислота в эритроцитах (в присутствии карбоангидразы) быстро разлагается на воду и углекислый газ. Ионы НС03“ входят в эритроциты, а ионы СГ входят в плазму крови, где уменьшается количество бикарбоната натрия. Углекислый газ диффундирует в альвеолярный воздух. Схематически все эти процессы представлены на рис. 6.5[2].
Рис. 6.5. Процессы, происходящие в эритроците при поглощении или отдаче кровью кислорода и углекислого газа
Транспорт кислорода и углекислого газа кровью, формы анемии
Транспорт О2 с помощью гемоглобина
Красный пигмент гемоглобин (Нb) состоит из белковой части (глобина) и собственно пигмента (гема). Молекулы составляют четыре белковые субъединицы, каждая из которых присоединяет гем-группу с двухвалентным атомом железа, находящимся в ее центре. В легких каждый атом железа присоединяет одну молекулу кислорода. Кислород переносится в ткани, где он отделяется. Присоединение О2 называется оксигенацией (насыщением кислородом), а его отсоединение – дезоксигенацией.
Транспорт СО2

Около 10% углекислого газа (СО2), конечного продукта окислительного метаболизма в клетках тканей, переносится кровью физически растворенным п 90% — в химически связанной форме. Большая часть углекислого газа сначала диффундирует из клеток тканей в плазму, а оттуда в эритроциты. Там молекулы СО2 химически связываются и превращаются с помощью ферментов в намного более растворимые бикарбонат-ионы (НСО3-), которые переносятся в плазме крови. Образование СO2 из НСО3- значительно ускоряется с помощью фермента карбоангидразы, присутствующего в эритроцитах.
Большая часть (около 50-60%) образованных бикарбонат-ионов поступает из эритроцитов обратно в плазму в обмен на хлорид-ионы. Они переносятся в легкие и выделяются в процессе выдоха после превращения в СO2. Оба процесса — образование НСО3- и освобождение СO2, соответственно связаны с оксигенацией и дезоксигенацией гемоглобина. Дезоксигемоглобин — заметно более сильное основание, чем оксигемоглобин, и может присоединить больше ионов Н+ (буферная функция гемоглобина), таким образом способствуя образованию НСО3- в капиллярах тканей. В капиллярах легких НСО3- опять проходит из плазмы крови в эритроциты, соединяется с Н+-ионами и превращается опять в СO2. Этот процесс подтверждается тем фактом, что окисленная кровь выделяет больше протонов Н+. Намного меньшая доля СО2 (около 5-10%) связана непосредственно с гемоглобином и переносится как карбаминогемоглобин.
Гемоглобин и угарный газ
Оксид углерода (угарный газ, СО) является бесцветным газом без запаха, который образуется во время неполного сгорания и, как кислород, может обратимо связываться с гемоглобином. Однако сродство угарного газа к гемоглобину заметно больше, чем у кислорода. Таким образом, даже когда содержание СО во вдыхаемом воздухе составляет 0,3%, 80% гемоглобина связывается с угарным газом (НbСО). Так как угарный газ в 200-300 раз медленней, чем кислород, освобождается от связи с гемоглобином, его токсическое действие определяется тем, что гемоглобин больше не может переносить кислород. У тяжелых курильщиков, например, 5-10% гемоглобина присутствует как НbСО, в то время как при его содержании в 20% появляются симптомы острого отравления (головная боль, головокружение, тошнота), а 65% могут быть смертельным.
Содержание гемоглобина в крови (Нb)
Часто для оценки гемопоэза или для распознавания различных форм анемии определяют среднее содержание гемоглобина в эритроците (СГЭ). Оно вычисляется по формуле:
СГЭ = (содержание гемоглобина (г/100 мл крови) / количество эритроцитов (10ˉ6г/мкл))*10
Значение среднего содержания гемоглобина в эритроците лежит между 38 и 36 пикограммами (пг) (1 пг = 10ˉ¹² г). Эритроциты с нормальным СГЭ называются нормохромными (ортохромными). Если СГЭ низкое (например, из-за постоянной потери крови или дефицита железа), эритроциты называются гипохромными; если СГЭ высокое (например, при пернициозной анемии благодаря дефициту витамина В12), они называются гиперхромными.
Формы анемии
Анемия определяется как дефицит (снижение количества) эритроцитов или сниженное содержание гемоглобина в крови. Диагноз анемии обычно ставится по содержанию гемоглобина, нижняя граница нормы достигает 140 г/л у мужчин и 120 г/л у женщин. Почти при всех формах анемии надежным симптомом заболевания является бледный цвет кожи и слизистых оболочек. Часто во время физических нагрузок заметно увеличивается сердечный ритм (увеличивая скорость кровообращения), а уменьшение кислорода в тканях приводит к одышке. Кроме того, встречается головокружение и легкая утомляемость.
Кроме железодефицитной анемии и хронической потери крови, например, из-за кровоточащих язв или опухолей в желудочно-кишечном тракте (гипохромные анемии), анемия может возникать при дефиците витамина В12. фолиевой кислоты или эритропоэтина. Витамин В12 и фолиевая кислота участвуют в синтезе ДНК в незрелых клетках костного мозга и, таким образом, заметно влияют на деление и созревание эритроцитов (эритропоэз). При их нехватке образуется меньше эритроцитов, но они заметно увеличены из-за повышенного содержания гемоглобина (макроциты (мегалоциты), предшественники: мегалобласты), поэтому содержание гемоглобина в крови практически не изменяется (гиперхромная, мегалобластическая, макроцитарная анемия).
Дефицит витамина В12 нередко возникает из-за нарушения всасывания витамина в кишечнике, реже — вследствие недостаточного приема с пищей. Эта так называемая пернициозная анемия наиболее часто является результатом хронического воспаления в слизистой кишечника с уменьшением образования желудочного сока.
Витамин В12 всасывается в кишечнике только в связанном виде с фактором, находящимся в желудочном соке «внутренним фактором (Кастла)», который защищает его от разрушения пищеварительным соком в желудке. Так как печень может запасать большое количество витамина В12, то перед тем, как ухудшение всасывания в кишечнике повлияет на образование эритроцитов, может пройти 2-5 лет. Как и в случае дефицита витамина В12, дефицит фолиевой кислоты, другого витамина группы В, приводит к нарушению эритропоэза в костном мозге.
Есть две другие причины анемии. Одна из них — разрушение костного мозга (аплазия костного мозга) радиоактивным излучением (например, после аварии на атомной электростанции) или в результате токсичных реакций на лекарства (например, цитостатики) (апластическая анемия). Другая причина — это уменьшение продолжительности жизни эритроцитов в результате их разрушения или увеличенного распада (гемолитическая анемия). При сильной форме гемолитической анемии (например, следующей за неудачным переливанием крови), кроме бледности может наблюдаться изменение цвета кожи и слизистых оболочек на желтоватый. Эта желтуха (гемолитическая желтуха) вызвана увеличивающимся разрушением гемоглобина до билирубина (желтого желчного пигмента) в печени. Последнее приводит к увеличению уровня билирубина в плазме и его отложению в тканях.
Примером анемии, возникающей в результате наследственного нарушения синтеза гемоглобина, клинически проявляющейся как гемолитическая, служит серповидноклеточная анемия. При этой болезни, которая практически встречается только у представителей негроидных популяций, имеется молекулярное нарушение, приводящее к замене нормального гемоглобина на другую форму гемоглобина (HbS). В HbS аминокислота валин заменена на глутаминовую кислоту. Эритроцит, содержащий такой неправильный гемоглобин, в дезоксигенированном состоянии принимает форму серпа. Серповидные эритроциты более жесткие и плохо проходят через капилляры.
Наследственное нарушение у гомозигот (доля HbS в суммарном гемоглобине 70-99%) приводит к закупорке небольших сосудов и, таким образом, к постоянному повреждению органов. Пораженные этой болезнью люди обычно достигают зрелости только при интенсивном лечении (например, частичной замене крови, приеме анальгетиков, избегании гипоксии (кислородного голодания) и иногда — пересадке костного мозга). В некоторых регионах тропической Африки с высоким процентом малярии 40% популяции являются гетерозиготными носителями данного гена (когда содержание HbS менее 50%), у них таких симптомов не обнаруживается. Измененный ген обусловливает устойчивость к малярийной инфекции (селективное преимущество).
Регуляция образования эритроцитов
Образование эритроцитов регулируется гормоном почек эритропоэтином. Организм обладает простой, но очень эффективной системой регуляции для поддержания содержания кислорода и вместе с тем количества эритроцитов относительно постоянным. Если содержание кислорода в крови падает ниже определенного уровня, например, после большой потери крови или во время пребывания на больших высотах, постоянно стимулируется образование эритропоэтина. В результате усиливается образование эритроцитов в костном мозге, что увеличивает способность крови к переносу кислорода. Когда дефицит кислорода преодолевается увеличением числа эритроцитов, образование эритропоэтина опять уменьшается. Пациенты, нуждающиеся в диализе (искусственном очищении крови от продуктов обмена веществ), с нарушением функционирования почек (например, с хронической почечной недостаточностью) часто испытывают явный дефицит эритропоэтина и поэтому почти всегда страдают от сопутствующей анемии.
Невероятные курсы массажа! СПб.
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
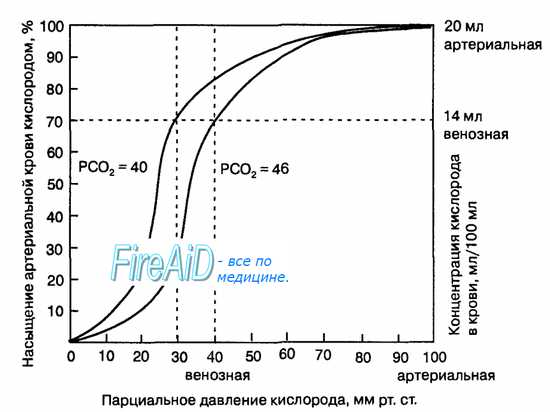
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
– Также рекомендуем “Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.”
