У каких рыб нет гемоглобина
В 1928 году биолог по имени Дитлеф Рустед (Ditlef Rustad) поймал необычную рыбу на берегу Bouvet Island в Антарктике. У «белой рыбы-крокодила», как ее описал Рустед, были большие глаза, объемный рот, полный зубов и прозрачные плавники, похожие на длинные перья. Рыба была очень бледной, в некоторых местах ее тело было таким же белым, как снег, в то время, как другие части тела были практически прозрачными. Ещё норвежские китобои в XIX веке рассказывали, что в далёкой Антарктике, у острова Южная Георгия в юго-западной части Атлантического океана, водятся странные рыбы с бесцветной кровью, которых они и окрестили «бескровными» и «ледяными». И теперь эти рассказы, считавшиеся учеными вымыслом, оказались правдой.
Когда Рустед провел изучение рыбины, он понял, что ее кровь практически бесцветна — нигде не было ни капли красного. Ее жабры тоже были странными: окрашенные в белый цвет, они по консистенции напоминали йогурт, если можно привести такое сравнение. У той же трески жабры красные, как и у большинства других рыб. Все благодаря большому количеству кровеносных сосудов, которыми пронизан этот орган. У белокровных рыб сеть сосудов вообще гуще, чем у обычных рыб, в особенности, в жабрах.
Отсутствие эритроцитов в крови? Как это возможно?
В жабрах, как известно, кровь насыщается кислородом, после чего кислород разносится по всему телу. Поэтому какого бы цвета рыба бы ни была, ее жабры должны быть красными, или хотя бы темными — а не полностью белыми, как у странной рыбы из Антарктики.
Чуть позже Джоан Рууд (Johan Ruud) и другие исследователи объяснили, почему все обстоит именно таким образом. Дело в том, что эта рыба, которая получила название «ледяная рыба» (Champsocephalus gunnari), оказалась представителем рыб семейства Channichthyidae, практически все представители которого лишены гемоглобина и красных кровяных телец. Именно гемоглобину и эритроцитам мы обязаны тем, что наш организм получает кислород, захватывая его из атмосферного воздуха.
Изначально ученые решили, что отсутствие гемоглобина — это адаптация к сверхнизким температурам и богатой кислородом переохлажденной воде в этом регионе. И действительно, кислорода в воде региона обитания рыбы очень много — он усваивается чуть ли не сам по себе. Зачем, спрашивается, рыбе эти кровяные тельца, когда кислород и так без проблем поступает в жабры? И специалисты пришли к выводу, что это все эволюционные изменения, позволившие рыбе приспособиться к экстремальным температурам.
Но оказалось, что все немного не так. Некоторое время спустя ученые выяснили, что утеря гемоглобина — вовсе не адаптационное приспособление. Это, скорее, генетическая мутация с не слишком положительными для вида или даже всего семейства изменениями. Поскольку кровь рыбы без гемоглобина способна переносить лишь 10% того кислорода, который обычно транспортируется эритроцитами крови тропических рыб, то «ледяной» рыбе пришлось полностью перекроить свое тело для того, чтобы выжить.
Этому виду удалось выжить несмотря ни на что благодаря ряду обстоятельств. Ледяная рыба живет в Южном Ледовитом океане, омывающем Антарктику. Течения блокируют регион от попадания сюда более теплой воды. По этой причине вода здесь всегда холодная. Ее температура составляет от 1,5 градусов Цельсия летом до — 1,8 градусов Цельсия зимой (как известно, морская и океаническая вода замерзают при температурах, значительно ниже нуля).
И рыбам пришлось выработать специальный белок-незамерзайку, который предохраняет животных от формирования ледяных кристаллов в их крови во время падения температуры воды ниже нуля. 16 видов рыб в Антарктике относятся к семейству Channichthyidae, которое, в свою очередь, является частью Notothenioidei. Причем среди всех прочих нототениевых, только у этой рыбы нет гемоглобина в крови. Кстати, ледяная рыба и нототениевые преобладают в Южном ледовитом океане — они составляют 35% от всех видов рыб и формируют 90% биомассы в регионе.
Генетики провели анализ ДНК ледяной рыбы с ДНК представителей видов рыб с красной кровью. Это исследование проводилось Уильямом Детрихом (William Detrich) из Северо-Восточного Университета. Детрих с коллегами обнаружили гены, которые и привели к специфическим мутациям. Фактически, один из генов, который отвечает за «сборку» молекулы гемоглобина, был утерян ледяными рыбами.
Наряду с гемоглобином, белокровки в ходе эволюции утеряли и миоглобин, который переносит кислород в мышцах скелета.
Как уже говорилось выше, до недавнего времени утеря гемоглобина и эритроцитов ледяной рыбой считалось адаптацией к холодной воде. Поскольку ни одно позвоночное в мире больше не теряло гемоглобин и красные кровяные тельца, ученые пришли к выводу, что утеря эритроцитов была ответом на изменяющуюся окружающую среду. Когда температура падает (имеется в виду долгосрочный процесс), преимущество получают животные с «жидкой кровью», которой легче циркулировать по сосудам. А поскольку эритроциты — достаточно крупные клетки, они в некотором смысле мешают этому процессу. У большинства видов рыб, которые живут в условиях холодного климата, в крови гораздо меньше красных кровяных телец, чем у их сородичей, живущих в теплых водах. Плюс ко всему, некоторые виды рыб могут снижать уровень эритроцитов в крови во время зимы для того, чтобы беречь энергию. Все это действительно так.
Но Кристин О’Брайен из Аляскинского университета в Фэрбенксе с коллегами решили проверить предположение об адаптационных изменениях ледяных рыб. В результатах исследования ученые указали, что у ледяной рыбы более крупное сердце и кровеносные сосуды, чем у других нототеноидных рыб. Несмотря на то, что кровь циркулирует по сосудам ледяной рыбы более активно, поскольку она лишена красных кровяных телец, рыбе приходится прокачивать огромные объемы крови, чтобы доставить достаточное количество кислорода ко всем тканям и органам.
В результате ледяная рыба, по подсчетам ученых, тратит в два раза больше энергии на процесс кровообращения, чем ее родственники. На работу сердца в состоянии покоя у обычной арктической рыбы уходит около 5% энергии, которое тратится всем организмом. У ледяной же рыбы этот показатель возрастает вплоть до 22%. Некоторые органы прозрачной рыбы пронизаны более густой сетью кровеносных сосудов, чем у других рыб. В частности, это касается глаз ледяной рыбы.
Как видим, это вряд ли можно назвать выгодным адаптационным приобретением, направленным на экономию энергии. Ее уходит, наоборот, больше, чем у видов рыб с красной кровью. Вот увеличение сердца и расширение сети кровеносных сосудов да, уже является следствием эволюционного процесса, позволившего этой странной рыбе выжить. Экономия энергии выполняется благодаря наличию других механизмов. Например, почечных телец у рыбы нет. Удаление ядовитых веществ у ледяной рыбы выполняют особые секреторные клетки почечных канальцев.
Кроме того, у ледяных рыб более высокий объем митохондрий при их аналогичном другим родственным видам рыб количестве. В митохондриальных мембранах белокровок более высокое соотношение липидов к белкам. Вероятно, это связано со специфическим белком регулятором биогенеза митохондрий PGC-1α*. PGC-1α является транскрипционным коактиватором и центральным звеном образования митохондрий в клетках. Недавно открыто, что PGC-1α регулирует состав и функции отдельных митохондрий и их окислительный метаболизм. Повышение окислительного метаболизма связано с повышенной работой PGC-1α, что сопровождается увеличением активных форм кислорода (АФК) в митохондриях. Но этот белок является и мощным регулятором удаления АФК, потому что высокий уровень PGC-1α запускает экспрессию многочисленных ферментов-антиоксидантов.
Большую часть времени белокровкам приходится проводить неподвижно. Кислород из воды эти рыбы могут усваивать и через кожу.
Лед в крови — и никаких проблем
Около 25 миллионов лет назад Южный ледовитый океан стал охлаждаться. Кстати, Южный ледовитый океан — условное название вод трёх океанов (Тихого, Атлантического и Индийского), окружающих Антарктиду и нередко выделяемых как «пятый океан», не имеющий, однако, чётко очерченной островами и континентами северной границы.
Так вот, при охлаждении вод океана в этом регионе погибло большое количество видов животных, которые не смогли приспособиться и выработать специальные белки-антифриз или же приспособиться к похолоданию каким-либо иным способом. Те виды, кто смог это сделать, выжили.
У той же ледяной рыбы в крови образуются кристаллы льда — это смертельно для многих других видов животных, но только не для этого вида. Дело в том, что специальный белок не дает уже появившимся льдинкам стать центром кристаллизации, что привело бы к полному замерзанию рыбы. Кровь и межклеточная жидкость остаются жидкими. Именно эта особенность позволяет ледяной рыбе хорошо себя чувствовать у Южного полюса.
Белок-антифриз носит название AFGP (antifreeze glycoprotein). Вероятно, он произошел от панкератической трипсиногеноподобной протеазы. Белок способен связываться с микроскопически малыми кристаллами льда, предотвращая их рост.
Белокровки (так еще называют ледяную рыбу) полностью замерзают лишь при — 6 градусах Цельсия.
Человек создает белокровкам проблемы
Глобальное потепление климата Земли приводит к тому, что воды Южного ледовитого океана становятся более теплыми и кислыми. Пищи для белых рыб (как правило, это детрит, появляющийся в воде во время таяния паковых льдов) становится меньше. Белокровки более чувствительны к изменениям климата, чем их родственники с красной кровью. Ихтиологи считают, что этот вид рыб может существовать только в холодной воде в полярных регионах и только при определенном диапазоне температур. В любых других регионах особенности ледяной рыбы приведут к ее быстрой гибели.
Если потепление продолжится — а это, скорее всего, так, то белокровкам придется либо снова приспосабливаться, вновь «изобретая» эритроциты, либо полностью вымереть, не оставив после себя ничего. Конечно, хотелось бы надеяться, что эта необычная и странная рыба сможет выжить даже в условиях снова меняющегося климата.
Источник
В декабре 1927 года норвежский зоолог Дитлев Рустад в 1750 километрах от побережья Антарктиды обнаружил очень странную рыбу с прозрачным телом и молочно-белыми жабрами. Когда Рустад вскрыл рыбу, он обнаружил, что ее кровь была бесцветной, как стекло. Так в его дневнике появилась запись «бесцветная кровь»…
Зачем нужен гемоглобин?
Практически всем видам позвоночных животных для транспорта кислорода к тканям необходима специальная система доставки, поскольку молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворяется всего лишь 3,2 мл О2. Содержащийся в эритроцитах позвоночных белок гемоглобин (Hb, рис. 1) способен связать в 70 раз больше — 220 мл О2/л. Содержание Hb в крови человека варьирует в пределах 120–180 г/л, что вдвое выше, чем концентрация белков плазмы (50–80 г/л). Поэтому гемоглобин вносит наибольший вклад в поддержание рН-буферной емкости крови. По своей структуре гемоглобин взрослого человека (HbA) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами около 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию.
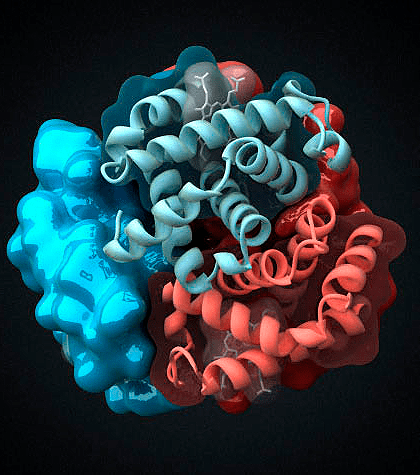
Рисунок 1. Молекула гемоглобина. Гемоглобин является одним из наиболее хорошо изученных белков. Он был открыт немецким физиологом Отто Функе в 1851 году, а структуру этого белка описал австрийский молекулярный биолог Макс Перутц в 1959 году, за что тремя годами позднее получил Нобелевскую премию по химии [1].
Visual Science
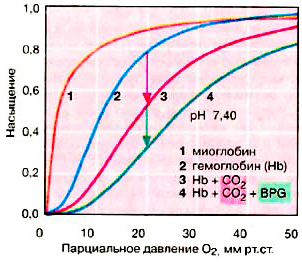
Рисунок 2. Насыщение гемоглобина и миоглобина кислородом
Каждая субъединица гемоглобина несет группу гема с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется. Окисление Fe2+ до Fe3+ в геме носит случайный характер. Окисленная форма гемоглобина — метгемоглобин — не способна переносить O2. Доля метгемоглобина поддерживается ферментами на низком уровне и составляет 1–2% [2]. Центры связывания O2 на каждой из четырёх субъединиц действуют кооперативно: когда молекула O2 связывается с одним из них, у других возрастает сродство к кислороду (данное явление называют положительной кооперативностью) [3]. Вследствие этого кривая насыщения гемоглобина кислородом имеет ярко выраженный сигмоидальный характер (рис. 2, кривая 2).
Другой мышечный белок — миоглобин, являющийся эволюционным предшественником гемоглобина, — является мономером и содержит единственный центр связывания O2, из-за чего его кривая насыщения кислородом несигмоидальна (рис. 2, кривая 1). Сродство к кислороду у миоглобина примерно в 13 раз выше, чем у гемоглобина (50%-насыщение миоглобина O2 достигается уже при парциальном давлении кислорода в 1–2 мм рт. ст., в то время как для гемоглобина эта цифра равна 26 мм рт. ст.) [4]. Из-за этого гемоглобин способен эффективно отдавать кислород в тканях и является более эффективным переносчиком, чем миоглобин. Но из этого не следует, что миоглобин малоэффективный и плохо устроенный белок, поскольку он выполняет принципиально иную биологическую функцию — запасание кислорода и обеспечение им митохондрий. Данные адаптивные различия между миоглобином и гемоглобином появились в результате миллионов лет эволюции…
Прозрачные рыбы
В 1927 году экспедицией норвежских китобоев близ острова Буве во время очередной промысловой охоты была поднята на сушу невиданная рыба, практически бесцветная и, самое интересное, с прозрачной («стеклянной») кровью. Это был первый обнаруженный вид позвоночных, не содержащих белка гемоглобина. За счет поразительного сходства головы рыбы с головой крокодила, рыбу назвали крокодиловая белокровка (Chaenocephalus aceratus). Белокровки (Channichthyidae; рис. 3) или ледяные рыбы обитают в холодных водах возле Антарктиды и южного побережья Южной Америки. Температура воды в этих краях опускается аж до −1,9 °C (температура замерзания морской воды ниже, чем пресной), причем является довольно постоянной.
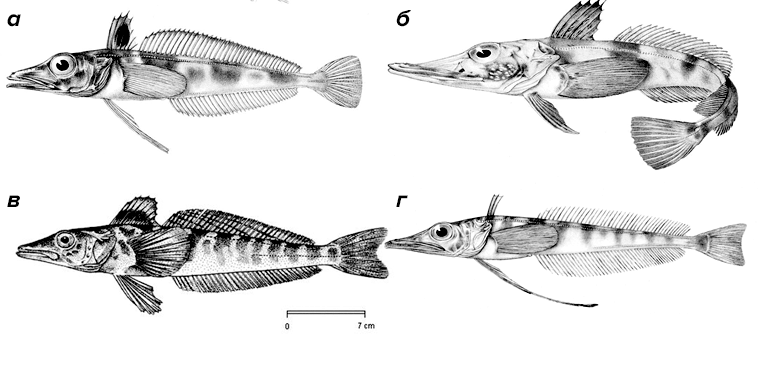
Рисунок 3. Некоторые представители белокровок. а — Chaenodraco wilsoni. б — Chaenocephalus aceratus. в — Champsocephalus gunnari. г — Cryodraco atkinsoni. Белокровки (Channichthyidae) — семейство из отряда Окунеобразные (Perciformes), в котором описано 16 видов. Данные рыбы питаются крилем, рачками и другими рыбами. Недавние исследования показали, что рацион этих рыб различается в зависимости от возраста. В целом, в рационе преобладает антарктический криль (Euphausia superba) и равноногие рачки (Themisto gaudichaudii). В рационе молодых особей преобладает Т. gaudichaudii и эвфаузииды (Thyanoessa sp.), а доля антарктического криля меньше. Ледяные рыбы достигают общей длины 25–75 см. Они являются пелагиальными представителями антарктических вод, обитают на глубине от 200 до 700 метров. Некоторые подвиды C. aceratus обнаруживаются в районе 1–2 тыс. метров. Белокровки — доминирующий вид в Антарктиде, полностью лишенный плавательного пузыря, в связи с чем многие виды этих рыб являются донными.
Очень немногие рыбы могут выжить в суровых условиях Антарктики. Ледяная рыба выживает за счет специального антифриза, присутствующего в крови и предотвращающего образование кристаллов льда в организме. Этот антифриз (AFGP, antifreeze glycoprotein) представляет собой гликопротеин, предположительно произошедший от панкреатической трипсиногеноподобной протеазы [9]. AFGP способен связываться с микроскопическими кристалликами льда и предотвращать их рост [10].
Ледяные рыбы имеют очень низкий уровень метаболизма и проводят большую часть времени практически неподвижно. Белокровки обитают в богатой кислородом воде и поглощают его непосредственно через кожу [11], потому что при пониженных температурах кровь, содержащая гемоглобин, становится очень вязкой, и выживание с такой кровью было бы весьма проблематично.
Отсутствие гемоглобина компенсируется модификацией сердечнососудистой системы. Все представители ледяных рыб имеют большее сердце, чем у других рыб такого же размера, а это увеличивает ударный объем, в несколько раз повышает общее количество циркулирующей крови и поднимает скорость кровотока. При низком артериальном давлении это достигается за счет снижения системного сопротивления потоку. Сочетание высокой пропускной способности сердечнососудистой системы, высокого содержания кислорода и относительно низких скоростей метаболизма ледяной рыбы позволяет обеспечить достаточное количество кислорода в тканях [12].
Гемоглобиновая потеря
Белокровки пережили потерю генов гемоглобина достаточно давно. Как показывает молекулярный анализ, почти у всех ледяных рыб одна мутация привела к потере гена, кодирующего β-цепь и часть α-цепи гемоглобина. Потеря способности к синтезу гемоглобина вызвала развитие компенсаторных изменений: увеличился объем сердца и общий объем крови (приблизительно в 3.5 раза по сравнению с костистыми рыбами аналогичного размера) [13–15]. Ученые, проанализировав ДНК представителей нототениевых рыб, пришли к выводу, что только у одного вида белокровок (Neopagetopsis iona) присутствуют гены гемоглобина, но они не являются функциональными [16].
Наряду с гемоглобином, у белокровок отсутствует и миоглобин, переносящий кислород в скелетных мышцах. При этом у десяти видов миоглобин сохранился только в сердечной мышце (в частности, в желудочке) [17], а у шести видов миоглобин был утрачен и там, причем механизм утраты гена у каждого вида индивидуален [18]. Общим механизмом подобной утраты является дупликация коротких (5–25-нуклеотидных) фрагментов, приводящая к сдвигу рамки считывания, преждевременной терминации транскрипции, появлению ложного сигнала полиаденилирования или нарушению связывания РНК-полимеразы с промоторной областью ДНК [19], [20].
Утрата гемоглобина первоначально должна была стать адаптацией к холоду: известно, что растворимость кислорода в холодной воде выше [21], а значит, потребность в гемоглобине, напротив, меньше. Отсутствие эритроцитов также снижает вязкость крови, что особенно критично в условиях экстремально низкой температуры. В процессе эволюции у белокровок произошли довольно радикальные изменения, компенсирующие утрату гемоглобина, включая вдвое большие энергозатраты по перекачке крови по сравнению с другими рыбами [22].
Ледяные рыбы произошли от малоподвижного донного предка. В холодных, хорошо перемешиваемых, богатых кислородом антарктических водах рыбы с низкой скоростью метаболизма могут выжить даже без гемоглобина. В середине третичного периода экологический кризис в Южном океане, вызванный похолоданием [23], привел к появлению обширных пустующих экологических ниш. Отсутствие конкуренции позволило мутантам, не имеющим гемоглобина, оставить после себя потомство, которое заселило пустые места обитания. У детенышей развились механизмы компенсации мутаций. В относительно изолированных фьордах образовались места обитания, которые колонизировали несколько особей, что привело к возникновению шести видов рыб, изолированных друг от друга и независимо потерявших гены глобинов [22].
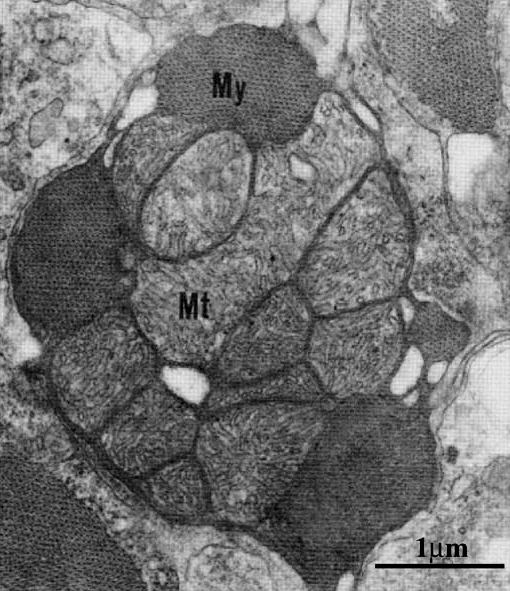
Гистологически показано, что особенностью ледяных рыб является высокий объем митохондрий при сходном их количестве и высокое отношение липид/белок в митохондриальных мембранах в сравнении с близкородственными видами семейства нототениевых рыб (рис. 4). Интересно, что у белокровок, у которых отсутствует миоглобин в скелетной мускулатуре, но присутствует в сердечной, объем митохондрий в скелетных мышцах существенно выше, чем в миокарде. О молекулярных механизмах этого феномена известно довольно мало. Предположительно, это явление связанно с одним из ключевых белков-регуляторов биогенеза митохондрий PGC-1α [23].

Рисунок 4. Поперечный разрез миоцитов желудочков сердца (C. aceratus). Большие митохондрии (Mt) по периферии окружены миофибриллами (My).
Регулятором биогенеза мембран митохондрий у белокровок является оксид азота-II (NO) (рис. 5). По сравнению с другими рыбами, у белокровок наблюдается повышенное содержание этого сигнального агента в крови. В ответ на потерю гемоглобина и миоглобина в мышцах ледяных рыб увеличивается биосинтез фосфолипидов, причем, независимо от синтеза митохондриальных белков и репликации митохондриальной ДНК, это приводит к увеличению размера митохондрий. Молекула NO стимулирует образование PGC-1α, который регулирует репликацию митохондриальной ДНК. Но ничего не известно о том, как биосинтез митохондриальных фосфолипидов интегрирован в этот процесс у ледяных рыб; возможно, это индуцируется высоким уровнем NO (темная стрелка на рисунке) [18].
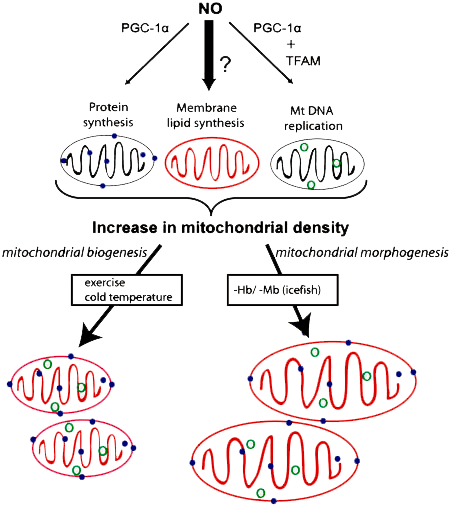
Рисунок 5. Процесс биогенеза митохондрий у ледяных рыб. Образование митохондрий включает в себя синтез митохондриальных белков (синие точки), фосфолипидов и репликацию митохондриального генома (зеленые кружки). В ответ на стимулы, такие как понижение температуры (или повышение физической нагрузки у млекопитающих) эти три компонента митохондриального биогенеза согласованно активируется, что приводит к увеличению плотности митохондрий.
Заключение
Безусловно, гемоглобин — жизненно важный белок, на котором основано дыхание большинства организмов. Эволюция гемоглобина происходила миллионы лет, но в специфических условиях Антарктики (холодная вода, обогащенная кислородом) адаптивные преимущества могут достигаться за счет эволюционной утраты гемоглобина (дезадаптация). Ледяные рыбы являются одной из ярких иллюстраций того, как гены, которые считаются абсолютно необходимыми для жизни позвоночных, в определенных условиях могут редуцироваться, обеспечивая выживание вида. Причудливы пути эволюции.
- Макс Перутц. «Наука и техника»;
- Кольман Я., Рём К.-Г., Вирт Ю. Наглядная биохимия. М.: «Мир», 2000. — 469 с.;
- Ленинджер А. Основы биохимии. М.: «Мир», 1985. — 369 с.;
- Проссер Л. Сравнительная физиология животных. М.: «Мир», 1977. — 574 с.;
- Tate R.C. Fishes. London: Printed by order of the trustees of the British Museum, 1914;
- Tate R.C. Antarctic fishes of the Scottish National Antarctic expedition. Edinburg: Robert Grant & Son, Williams & Norgate, 1913;
- Champsocephalus gunnari. Encyclopedia of life;
- Википедия: Белокровные рыбы;
- Chi-Hing C. Cheng, Liangbiao Chen. (1999). Evolution of an antifreeze glycoprotein. Nature. 401, 443-444;
- J. A. Raymond, A. L. DeVries. (1977). Adsorption inhibition as a mechanism of freezing resistance in polar fishes.. Proceedings of the National Academy of Sciences. 74, 2589-2593;
- C.-H Christina Cheng, H William Detrich. (2007). Molecular ecophysiology of Antarctic notothenioid fishes. Philosophical Transactions of the Royal Society B: Biological Sciences. 362, 2215-2232;
- Karl-Hermann Kock. (2005). Antarctic icefishes (Channichthyidae): a unique family of fishes. A review, Part I. Polar Biol. 28, 862-895;
- Yuqiong Zhao, Manoja Ratnayake-Lecamwasam, Sandra K. Parker, Ennio Cocca, Laura Camardella, et. al.. (1998). The Major Adult α-Globin Gene of Antarctic Teleosts and Its Remnants in the Hemoglobinless Icefishes. J. Biol. Chem.. 273, 14745-14752;
- Guido di Prisco, Ennio Cocca, Sandra K Parker, H.William Detrich. (2002). Tracking the evolutionary loss of hemoglobin expression by the white-blooded Antarctic icefishes. Gene. 295, 185-191;
- Guido di Prisco, Joseph T. Eastman, Daniela Giordano, Elio Parisi, Cinzia Verde. (2007). Biogeography and adaptation of Notothenioid fish: Hemoglobin function and globin–gene evolution. Gene. 398, 143-155;
- T. J. Near. (2006). A Genomic Fossil Reveals Key Steps in Hemoglobin Loss by the Antarctic Icefishes. Molecular Biology and Evolution. 23, 2008-2016;
- B. D. Sidell, M. E. Vayda, D. J. Small, T. J. Moylan, R. L. Londraville, et. al.. (1997). Variable expression of myoglobin among the hemoglobinless Antarctic icefishes. Proceedings of the National Academy of Sciences. 94, 3420-3424;
- K. M. O’Brien, I. A. Mueller. (2010). The Unique Mitochondrial Form and Function of Antarctic Channichthyid Icefishes. Integrative and Comparative Biology. 50, 993-1008;
- D. J. Small. (2003). The myoglobin gene of the Antarctic icefish, Chaenocephalus aceratus, contains a duplicated TATAAAA sequence that interferes with transcription. Journal of Experimental Biology. 206, 131-139;
- B. D. Sidell. (2006). When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes. Journal of Experimental Biology. 209, 1791-1802;
- L. Bargelloni, S. Marcato, T. Patarnello. (1998). Antarctic fish hemoglobins: Evidence for adaptive evolution at subzero temperature. Proceedings of the National Academy of Sciences. 95, 8670-8675;
- Daniela Giordano, Ignacio Boron, Stefania Abbruzzetti, Wendy Van Leuven, Francesco P. Nicoletti, et. al.. (2012). Biophysical Characterisation of Neuroglobin of the Icefish, a Natural Knockout for Hemoglobin and Myoglobin. Comparison with Human Neuroglobin. PLoS ONE. 7, e44508;
- M. R. Urschel, K. M. O’Brien. (2008). High mitochondrial densities in the hearts of Antarctic icefishes are maintained by an increase in mitochondrial size rather than mitochondrial biogenesis. Journal of Experimental Biology. 211, 2638-2646;
- F. Garofalo, D. Pellegrino, D. Amelio, B. Tota. (2009). The Antarctic hemoglobinless icefish, fifty five years later: A unique cardiocirculatory interplay of disaptation and phenotypic plasticity. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 154, 10-28;
- S. Austin, J. St-Pierre. (2012). PGC1 and mitochondrial metabolism – emerging concepts and relevance in ageing and neurodegenerative disorders. Journal of Cell Science. 125, 4963-4971.
Источник
