У кого гемоглобин является обычным дыхательным пигментом
Дыхательные пигменты (лат. pigmentum краска) — окрашенные органические вещества различного химического строения, способные в зависимости от условий связывать или освобождать молекулярный кислород. В организме человека и животных Дыхательные пигменты осуществляют транспорт кислорода от органов дыхания к тканям и принимают участие в процессах биологического окисления и в окислительно-восстановительных процессах. Главными из Дыхательных пигментов являются дыхательные белки и дыхательные ферменты (см.).
Использование растворенного в воде кислорода одноклеточными или низшими многоклеточными животными организмами, обитающими в водной среде, осуществляется в результате его диффузии через клеточные мембраны. У более сложно организованных животных обеспечение организма кислородом происходит с помощью специальных дыхательных белков, переносящих кислород от органов дыхания к тканям. К таким белкам относятся гемоглобин (см.), эритрокруорин, хлорокруорин, гемэритрин, гемоцианин, геликорубин. Миоглобин (см.) не способен переносить кислород, но участвует в его депонировании.
Дыхательные пигменты представляют собой сложные белки — хромопротеиды (см.), молекулы которых состоят из простого белка и небелковой окрашенной простетической группы.
У многих Д. п. простетической группой является железопорфириновый комплекс — гем. У позвоночных гемсодержащими дыхательными пигментами являются гемоглобин, находящийся в эритроцитах и осуществляющий связывание, транспорт и высвобождение кислорода в тканях, и миоглобин, с помощью к-рого в мышцах резервируется кислород в количествах, достаточных для осуществления механической работы, производимой мышцами. Во внутриклеточном депонировании кислорода, кроме миоглобина, по-видимому, принимают участие находящиеся в клетках каротиноиды (см.), причем роль этих пигментов повышается в условиях гипоксии и при старении организма.
Более многочисленными и разнообразными являются Д. п. беспозвоночных животных. Высокомолекулярные гемоглобиноподобные вещества (мол. вес 400 000—6 700 000), растворенные в гемолимфе кольчатых червей (полихет и олигохет) и моллюсков, получили название эритрокруоринов. Они представляют собой гемсодержащие белки, в состав которых входит от 30 до 400 групп гема. Каждый гем способен связывать одну молекулу кислорода. Молекула эритрокруорина состоит из 12 субъединиц.
Много общего с эритрокруорином имеет хлорокруорин — зеленый пигмент многощетинковых кольчатых червей (Spirographis и родственных им видов). Он содержится в растворенном состоянии в плазме крови.
Хлорокруорин — гемсодержащий белок, гем к-рого отличается от гема гемоглобина наличием формильной группы при втором углеродном атоме протопорфиринового кольца; он носит название спирографиспорфирина или спирографисгемина. Мол. вес хлорокруорина колеблется от 2 750 000 до 3 500 000, содержание железа в нем находится в пределах 0,45—1,2%, молекула состоит из 12 субъединиц и содержит 190 групп хлорокруорогема. Хлорокруорин обладает высоким сродством к кислороду и незначительным — к окиси углерода; кислородная емкость крови кольчатых червей составляет 10%.
Гемэритрин — коричнево-красный Д. п. с мол. весом 66 000, находится внутри клеток, циркулирующих в полостной жидкости некоторых видов беспозвоночных (морские кольчатые черви, гл. обр. Sipunculidae, и др.). Гемэритрин отличается от других дыхательных белков тем, что не содержит гема. Молекула гемэритрина состоит из 8 субъединиц, в каждой из которых находится по 2 атома железа, которые, по всей вероятности, соединяются с атомами серы, входящей в состав белка. Содержание железа колеблется от 0,8 до 1,01%, кислородная емкость составляет ок. 1,6%. Свойство гемэритрина обратимо соединяться с кислородом (каждые 2 атома железа связывают одну молекулу кислорода) обусловлено особым расположением полипептидных цепей в его молекуле.
К Дыхательным пигментам относят также гемсодержащий красный пигмент виноградной улитки — геликорубин, способный к обратимому окислению — восстановлению.
Дыхательные пигменты, содержащие в своей молекуле медь, называются гемоцианинами. Они содержатся в плазме крови многих моллюсков и членистоногих, придавая ей голубую окраску. Гемоцианины представляют собой высокомолекулярные белки (мол. вес колеблется от 500 000 до 10 000 000), содержание меди в них составляет 0,17—0,18% (моллюски) и 0,24—0,26% (членистоногие). Молекулы гемоцианинов имеют одинаковую форму и состоят из 3—6 субъединиц, содержащих значительное количество атомов меди (у гемоцианина омара их 20), которые располагаются парами. Гемоцианины отличаются один от другого по своей растворимости, цвету (от пурпурно-синего до зеленого) и форме кристаллов. Они способны обратимо соединяться с кислородом, причем одна молекула кислорода связывается с двумя атомами одновалентной меди, которые при этом окисляются. Кислородная емкость крови таких моллюсков и членистоногих пропорциональна содержанию в ней меди и количественно меньше, чем кислородная емкость крови позвоночных животных. В крови, ткани печени и других тканях животных обнаружены медьсодержащие белки, не участвующие в переносе кислорода. К таким белкам, являющимся Д. п., относятся гемокупреин и гепатокупреин. Они представляют собой синие пигменты идентичной структуры, в результате чего эти Д. п. получили общее название цитокупреины. Цитокупреин — это белок с мол. весом 32 000; молекула цитокупреина состоит из двух субъединиц, каждая из которых содержит один атом меди и один атом цинка в двухвалентном состоянии. Установлено, что фермент супероксиддисмутаза, катализирующий реакцию дисмутации супероксидных радикалов H2O-, накапливающихся в тканях в ходе окислительных процессов, представляет собой цитокупреин.
Поскольку супероксидные радикалы и некоторые продукты их превращения чрезвычайно токсичны, супероксид-дисмутаза является жизненно необходимым ферментом.
Другой медьсодержащий белок — церулоплазмин (см. Кровь) — играет главную роль в резервировании и транспорте меди у позвоночных животных и человека. Церулоплазмин является не только нетоксическим резервом меди в организме, но и способен также ускорять окисление двухвалентных ионов железа в трехвалентные, т. е. обладает ферроксидазными свойствами, участвует в синтезе гемоглобина и трансферрина (железосвязывающего белка плазмы крови; нормальное содержание его у человека — 250 мг%, при поражении паренхимы печени эта цифра уменьшается).
Церулоплазмин является медьсодержащим альфа-1-глобулином сыворотки крови человека с мол. весом 151 000; на его долю приходится до 0,5% от общего количества белка в плазме крови человека и 90% всей меди плазмы крови. У здорового человека общее содержание меди в плазме крови составляет 70— 140 мкг%. Гиперкупремия и гиперцерулоплазминемия наблюдаются в остром периоде инфекций, протекающих с лихорадкой и распадом клеточных элементов, при заболеваниях печени — гепатитах, циррозах и механических желтухах, при карциноме, лейкемии, анемиях. Гиперцерулоплазминемия отмечается также при беременности.
В сыворотке крови количественное определение церулоплазмина проводят в клин, лабораториях по Равину. Метод основан на том. что церулоплазмин является единственным компонентом сыворотки крови, обладающим оксидазными свойствами, поэтому он катализирует окисление некоторых аминов, в т. ч. парафенилендиаминдигидрохлорида, в результате окисления к-рого образуется вещество сине-фиолетового цвета. Оптическая плотность (см. Колориметрия) р-ра измеряется при 530 нм, и концентрация церулоплазмина, пропорциональная степени окисления используемого субстрата, вычисляется по калибровочной кривой. Зная количество меди в плазме крови, можно также рассчитать содержание церулоплазмина по формуле:
церулоплазмин(мг%) = Cu(мкг%)• 100/0,32
т. к. теоретически содержание меди в церулоплазмине составляет 0,32%.
К Дыхательным пигментам относится также обширная группа флавоновых пигментов, окрашенных в желтый или желто-коричневый цвет и содержащих в своей молекуле ядро флавона (см. Флавоны). Эти пигменты содержатся в основном в растениях. Для животных и человека особое значение имеют производные флавона, близкие по своему хим. строению и биол, активности и являющиеся компонентами капилляроукрепляющего витамина Р. К таким Д. п. относятся гесперидин, рутин, катехин, эпикатехин и их галловые эфиры. Витамин P в животных клетках участвует в окислительно-восстановительных процессах вместе с аскорбиновой к-той, а также является ингибитором ряда ферментов, особенно гиалуронидазы (см.). Рутин способен в определенных условиях стимулировать процессы тканевого дыхания и окислительного фосфорилирования в митохондриях и, по-видимому, участвует в биосинтезе убихинона. Возможно, что катехин, рутин и гесперидин обладают адреналиноподобным действием.
Библиография: Верболович П. А. и Утешев А. Б. Железо в животном организме, Алма-Ата, 1967, библиогр.; Карнаухов В. Н. Функции каротиноидов в клетках животных, М., 1973, библиогр.; Молекулы и клетки, пер. с англ., под ред. Г. М. Франка, в. 4, с. 136, М., 1969; Fridoyieh I. Superoxide dismutases, Ann. Rev. Biochem., v. 44, p. 147, 1975, bibliogr.; Кlotz J.M., Langerman N. R. a. Dаrnall D. W. Quaternary structure of proteins, ibid., v. 39, p. 25, 1970, bibliogr.; MalmstromB. G. a. Neilands J. B. Metalloproteins, ibid., v. 33, p. 331, 1964, bibliogr.; Mellema J. E.a. KlugA. Quaternary structure of gastropod haemocyanin, Nature (Lond.), v. 239, p. 146, 1972.
П. А. Верболович.
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
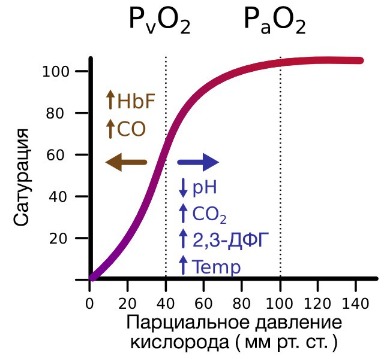
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
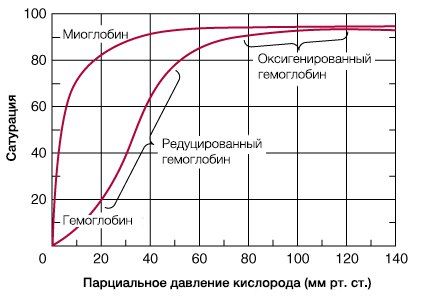
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.

В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
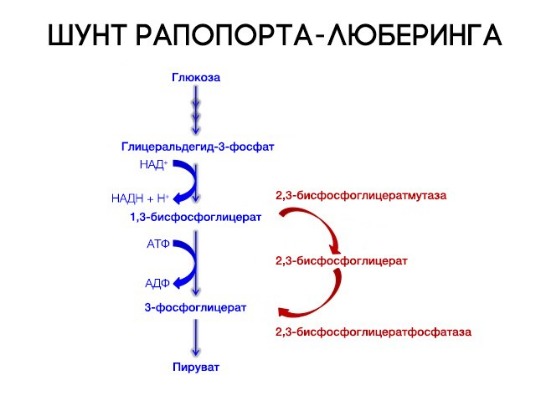
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
