Уровень гемоглобина у крысы
И.К. Проскурина, А.В. Титовский
Фракционный состав гемоглобина крысы при экспериментальной дегидратации
Молекулярная гетерогенность гемоглобина тестирована у целого ряда высших и низших форм, относящихся к различным систематическим группам. В крови собаки, лошади, кошки содержатся два вида фракций, соотношение которых от эмбриональной к постна-тальной жизни различно [1, 2]. Гемоглобин взрослых крыс состоит из шести фракций, которые различаются по количественном}’ соотношению [Э]. У крысы молекулярные формы гемоглобина состоят из двух вариантов а-цепи и нескольких (до трех) вариантов Ь-цепи, различие между которыми не идентифицировано. Считают, что разнообразие форм гемоглобина дает определенные преимущества организму в процессе его приспособления к условиям среды [4]. В литературе отсутствуют данные о фрак-‘ ционном составе гемоглобина крысы в старых, зрелых и молодых эритроцитах в норме и при обезвоживании организма.
Материал и методы исследования
Работа выполнена на крысах-самцах весом 240-270 г. Эксперимент проводился в одном помещении с постоянной температурой (18° — 20°С) и влажностью. За две недели до начала эксперимента животных размещали по 5 — 7 в клетку. Режим контрольной группы оставался без изменений, а режим животных, подвергнутых экспериментальному обезвоживанию, был изменен (животные содержались в клетке по 1-2 особям для исключения агрессивного поведения). За основу была взята модель дегидратации, подробно описанная А.Н. Тихомировым [5]. Согласно этой модели крыс содержали на безводной диете (сухой овес с полным исключением воды из рациона) в течение 3, 6 и 10 суток, по окончании которых прово-
Ярославский педагогический вестник. 1999. № 3 (21)
дили исследования.
Кровь брали из нижней трети правой дор-зальной вены хвоста шприцем. В качестве антикоагулянта использовали гепарин 5000 единиц. Полученную кровь центрифугировали при 3000 об/мин в течение 10 минут, удаляли плазму и лейкоцитарную пленку й дважды отмывали в растворе Дюльбенко в соотношении 1:2. Эритроцитарной массой заполняли пластиковые трубочки, перегибали их и помещали в пластиковый стакан центрифуги. Образцы центрифугировали при 12000 g на центрифуге К-24 (Германия) в течение 15 минут. Трубочки с разделенной эритроцитарной массой извлекали и разрезали острым лезвием таким образом, чтобы получить 10% верхней, средней и нижней фракции, которые впоследствии считали молодыми (М), зрелыми (3) и старыми (С) фракциями эритроцитов. Полученные фракции извлекали экстракцией воздухом.
Фракции эритроцитов взвешивали в буфере в количестве 1,6 10 с подсчетом в камере Горяева, после чего их осаждали в центрифуге при 3000 об/мин, удаляли буфер и добавляли такой же объем дистиллированной воды.
Гемолиз эритроцитов проводили методом замораживания-оттаивания [6].
Затем гемолизованные эритроциты центрифугировали при 8000 об/мин на центрифуге ОГГН-8 в течение 15 минут. Над осадочную жидкость использовали для проведения биохимического эксперимента.
Фракционирование белков эритроцитов проводили на колонках 7,5%-ного полиакрила-мидного геля по Дэвису. На одну колонку наносили 500-700 мкг белка, определенного по методу Лоури [7]. Длина разделяющего геля составляла 6 см. Электрофорез проводили в трис-глициновом буфере (рН 8,6) при силе тока 2,5 мА на каждую колонку в течение 10 минут и 5 мА в последующие 1,5 часа при температуре 4 С.
Фракции гемоглобина выявляли бензи-диновым методом [4]. Гелевые колонки помещали в 7%-ный раствор уксусной кислоты на 5 минут. Затем помещали в бензидиновый краситель, приготовленный непосредственно перед экспериментом (0,1 г. бензидина растворяли в 50 мл дистиллированной воды при кипячении, после чего быстро охлаждали в ледяной бане. Перед окрашиванием в бензидиновый раствор добавляли 0,25 мл ледяной уксусной кислоты и 0.1 мл 33%-ной перекиси водорода). Проявление зон гемоглобина происходило в течение 7-10 минут.
Все исследования выполнены в трех биологических и не менее чем в трех аналитических последовательностях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение количественного содержания белка в молодых, зрелых и старых эритро-» цитах при дегидратации организма крысы показало уменьшение содержания общего белка во всех исследуемых фракциях по сравнению с контролем.
Количественное содержание белка в молодых (М), зрелых (3) и старых (С) эритроцитах в норме и при обезвоживании организма крыс
Таблица 1
День дегидратации Количественное содержание белка в мг на 100 мкл
М 3 Л
Контроль 0,540+0,006 0,560+0,008 0,574+0,011
3-й 0,420+0,009 0,468+0,012 0,504+0,007
6-й 0,288+0,008 0,272+0.010 0,312+0,003
10-й 0,295+0,011 0,284+0,010 0,294+0,008
В молодых эритроцитах уменьшение содержания белка составляет 22,2%, 46,8% и 45,4% соответственно на 3-й, 6-й и 10-й день дегидратации организма животного гю сравнению с контролем. В зрелых эритроцитах содержание общего белка уменьшилось на 13,2% на третий, на 51,4% — на шестой и на 49,3% — на десятый день дегидратации. Такая же тенденция сохранилась и при исследовании старых эритроцитов: уменьшение количественного содержания белка на 3-й день составило 12,2%, на 6-й — 45,6%, на 10-й — 48,8% по сравнению с контролем.
Методом электрофореза в 7,5%-ном по-лиакриламидном геле в молодых, зрелых и старых эритроцитах контрольных крыс было выявлено по 6 фракций гемоглобинов (рис.1) с различной электрофоретической активностью (ОЭП 0,22, 0,26, 0,28, 0,33, 0,44, и 0,48 соответственно), что согласуется с литературными данными [4]. Из рис.1 видно, что четыре фракции (1, 2, 3 и 5) гемоглобина имеют среднюю интенсивность, 4-я фракция — мажорная и 6-я — минорная.
При исследовании молекулярной гетерогенности гемоглобина крысы на 3-й, 6-й и 10-й день при общей дегидратации организма животного были выявлены те же фракции гемоглобина. При сравнении фракционного состава гемоглобина на 3-й и 6-й день дегидратации в
молодых, зрелых и старых эритроцитах не обнаружено сколько-нибудь видимых изменений по сравнению с контролем. Изменения во фракционном составе были обнаружены на 10-й (сублетальный) день дегидратации организма животного. Как видно из рис.1, в молодых и зрелых эритроцитах фракции 1 и 5 перешли из зон средней интенсивности в минорные (по сравнению с контролем), а в старых эритроцитах появилась еще одна мажорная фракция — 5-я.
Полученные данные свидетельствуют о том, что при длительной дегидратации организма крысы происходят некоторые изменения в количественном соотношении молекулярных форм гемоглобина, что, вероятно, связано с изменением в белок-белковых взаимодействиях при экстремальных условиях существования животного, к которым относится и дегидратация организма. Известно, что клеточное обезвоживание, характерное для тяжелой дегидратации, наблюдается и в естественных условиях при старении эритроцитов [8]. Наши эксперименты показали, что наибольшие изменения во фракционном составе гемоглобинов происходят именно в старых эритроцитах на 10-й день дегидратации организма животного.
М 3 С – М 3 с-
_ _ _IV г
а + б +
Рис 1. Электрофореграммы гемоглобинов крысы в молодых (М), зрелых (3) и старых (С) эритроцитах: а – в норме, б – на 10-й день дегидратации организма животного
5. Тихомиров А.Н., Соколова Б.А. Изменение микроциркуляторного русла конъюктивы глазного яблока при экспериментальной дегидратации // Адаптивные и компенсаторные механизмы системы регуляции. М.: Изд-во 2-го мед. ин-та, 1984, С. 125-130.
6. Гааль Э., Медьеши Г., Верецки J1. Электрофорез в разделении биологических макромолекул. М.: Мир, 1982. С. 140-142.
7. Loury O.U., Rosenbringh N.Y., Farr U.L., Randall R J. Protein meagerment with Folin phenol reagent // J.Biol. Chem., 1951. V.193. P.265.
8. Williams A.R., Morris D.R. The internal viscosity of the human erythrocyte may determine its libespan in vivo// Scan. J.Haematol, 1980. V.24. P.57-62.
Литература
1. Иржак Л.И., Качмарин Э.В. Гемоглобин кошки в онтогенезе // Доклады АН СССР, 1971. Т.197, N З.С.695-697,
2. Иржак Л.И., Качмарин Э.В. Электрофорети-ческая подвижность гемоглобина кошки // Бюллетень экспериментальной биологии и медицины, 1973. Т.95,КЗ. С. 59-61.
3. Стародуб Н.Ф., Грищак А.И. Морфогенети-ческая смена типов гемоглобина в онтогенезе крыс // Онтогенез. 1979. Т. 10. С.567.
4. Стародуб Н.Ф.Гетерогенная система гемоглобина // Успехи современной биологии, 1985. Т.99. С.385-400.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ажикова А.К.
1
Журавлева Г.Ф.
2
1 ГБОУ ВПО «Астраханский Государственный медицинский университет»
2 ФГОУ ВПО «Астраханский государственный университет»
Впервые изучено влияние лекарственных форм различной консистенции на количественные изменения периферической крови крыс в условиях искусственной ожоговой травмы. Любой патологический процесс может отразиться на количественных и качественных особенностях состава циркулирующей крови. Этим и определяется огромное значение необходимости изучения крови в условиях гипертермии и выявления закономерностей изменений различных показателей. Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения. Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов. Полученные данные расширяют и углубляют представления о характере интоксикации организма в условиях стрессового воздействия различных факторов.
показатели периферической крови
кроветворные органы
ожоговые поражения кожи
термическое воздействие
гипертермия
1. Ажикова А. К. Использование пуповинной крови для восстановления кожи после термической травмы / А. К. Ажикова, М. В. Лазько // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2008. – №.4. – С. 53-57.
2. Грушко М. П. Состояние периферической крови у карповых рыб в нерестовый период / М. П. Грушко, Н. Н. Федорова // Актуальные проблемы современной науки. – Технические науки: Труды 2-го Международного форума. – Самара, 2006. – С.23-25.
3. Земков Г. В. Характер и степень патологических изменений в крови и внутренних органах судака / Г. В. Земков, Г. Ф. Журавлева // Материалы VIII конф. по экологической физиологии и биохимии рыб. – Петрозаводск, 1992. – С. 40.
4. Лазько А. Е. Состояние мембран эритроцитов при воздействии серосодержащего газа / А. Е. Лазько, Р. И. Асфандияров, А. А. Резаев // Актуальные вопросы медицинской фармакологии. – 1993. – С.41-47.
5. Мамонтова Е. В. Влияние ALPHA-токоферола на степень перекисного гемолиза белых мышей в норме и при иммобилизационном стрессе / Е. В. Мамонтова // Современные проблемы науки и образования. – 2006. – № 3. – С. 27-28.
6. Островский В. К. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях / В. К. Островский, А. В. Мащенко, Д. В. Янголенко, С. В. Макаров // Клин. лаб. диагностика. – 2006. – № 6. – С. 50-53.
7. Покровский А. А. Методика определения перекисного гемолиза эритроцитов / А. А. Покровский, А. А. Абразцов // Вопросы питания. – М.: Наука, 1964. – № 6. – С.44.
8. Рожкова И. С. Влияние хронической интоксикации на свободнорадикальные процессы плазмы крови крыс / И. С. Рожкова, Д. Л. Теплый, Б. В. Фельдман // Научный руководитель. – 2015. – № 3(10). – С. 1-7.
9. Теплый Д. Л. Особенности морфологической картины сыворотки крови мышей разных возрастных групп при экспериментальном стрессе / Д. Л. Теплый, Н. А. Аюпова // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2005. – №.10. – С. 47-50.
10. Ясенявская А. Л. Влияние антиоксидантов на уровень перекисного гемолиза эритроцитов старых крыс в норме и при иммобилизационном стрессе / А. Л. Ясенявская, Н. В. Кобзева // Современные наукоемкие технологии. – 2006. – № 2. – С. 69-70.
В медицинской биотехнологии постановка экспериментов при помощи моделирования патологических состояний, например ожогового повреждения кожи, имеет огромное значение для глубокого исследования крови и кроветворных органов [3]. Исходя из этого, необходимо тщательное и всестороннее изучение всех изменений, которые происходят в организме при этих воздействиях. Главным образом это относится к системам поддержания гомеостаза [2].
Ожоговые поражения кожи стали в современном мире одним из наиболее социально значимых и распространенных типов травматических повреждений у человека. Изучению вопроса реакции клеток крови на ожоги посвящен ряд исследований [1, 8].
Любое заболевание, патологический процесс, а также ряд физиологических сдвигов могут в той или иной степени отразиться на количественных и качественных особенностях состава циркулирующей крови [5]. Этим и определяется огромное значение необходимости изучения крови. Белые клетки крови, имея высокую реактивность, быстро включаются в адаптационные реакции. Они способны к неспецифическому реагированию в ответ на альтерирующие воздействия.
Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения [1].
Свой вклад в общее состояние системы организма вносят компоненты крови. Наиболее уязвимым объектом для действия продуктов свободнорадикального окисления липидов является стенка кровеносных сосудов, что обусловлено высоким уровнем кислорода в крови и низким уровнем его утилизации [9]. В условиях патологического процесса происходит поражение неклеточного компонента сосудистой стенки.
Цель исследования – изучение показателей периферической крови половозрелых крыс в норме и в условиях термического воздействия.
Материалы и методы. Объектом исследования явились 50 беспородных крыс-самцов 4-месячного возраста. Во время эксперимента регистрировали общее состояние и поведение животных. Самцы крыс были разделены на пять групп по типу воздействия:
I группа – животные, не подвергшиеся ожоговому воздействию (контрольная, 10 шт.);
II группа – животные, получившие ожоговое воздействие и не подвергшиеся терапии (10 шт.). Раны регенерировали естественным путем;
III группа – животные, получившие ожоговое воздействие и подвергшиеся терапии спреем «Д-Пантенол» (10 шт.);
IV группа – животные, получившие ожоговое воздействие и подвергшиеся терапии бальзамом мазевой формы «Спасатель» (10 шт.);
V группа – животные, получившие ожоговое воздействие и подвергшиеся терапии аппликациями настойки календулы (10 шт.).
Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов.
Уровень гемоглобина в образцах крови крыс определяли электрофотометрическим способом на гемоглобинометре APEL Hemoglobinmeter HG-202. Мазки фиксировали и окрашивали по Романовскому – Гимзе. Идентификация форменных элементов крови проводилась согласно методике Н. Т. Ивановой [4]. Количество эритроцитов крови подсчитывали по стандартной методике в камере Горяева. Количество лейкоцитов считали по мазкам крови крыс.
Для оценки уровня свободнорадикального окисления и выраженности в связи с этим липолитических процессов в крови проводили измерение перекисной резистентности эритроцитов. Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про– и антиоксидантный баланс организма [6].
Для определения перекисного гемолиза эритроцитов использовали модификацию методов определения степени перекисного гемолиза эритроцитов (ПГЭ) А. А. Покровского и А. А. Абразцова [7], которую предложили А. Е. Лазько, Р. И. Асфандияров и А. А. Резаев [4].
Результаты исследования и их обсуждение. Анализ гематологических исследований экспериментальных животных показал, что наиболее высокий уровень гемоглобина периферической крови наблюдался у крыс, лечившихся бальзамом «Спасатель» и спреем «Д-пантенол», что наглядно отображено в таблице 1. В группе крыс, лечившихся настойкой календулы, данный показатель незначительно отличался от значений у обожженных животных, не получавших лечения.
Таблица 1
Гематологические показатели через 3 суток после ожоговой травмы
Тип воздействия | Эритроциты (шт./мкл.) | Гемоглобин (г/л) |
1 -Контроль | 7,8х106 | 27,7 |
2-Ожог | 6,5 х106* | 25,6* |
3-Ожог+аппликации мазью «Д-пантенол» | 8,2х106 * | 29,2 * |
4-Ожог+аппликации бальзамом «Спасатель» | 8,3х106* | 28,3* |
5-Ожог+аппликации настойкой календулы | 6,8х106* | 25,7* |
Примечание: * – Р<0,05 по сравнению с контролем.
Изменение уровня гемоглобина в результате опыта отмечено в таблице 1. Высокий уровень гемоглобина наблюдался у крыс, лечившихся Д-пантенолом. Средний показатель уровня гемоглобина отмечен у крыс, леченных бальзамом «Спасатель». В экспериментальной группе с настойкой календулы он незначительно и статистически недостоверно отличался от значений у животных 3 группы.
Выявлено, что термический ожог кожи вызвал уменьшение количества эритроцитов периферической крови крыс. Установлено, что при лечении ожогов этот показатель несколько увеличивался, например, при терапии бальзамом «Спасатель» и спреем «Д-пантенол».
Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про- и антиоксидантный баланс организма [10].
По данным табл. 2 показано, что не леченный термический ожог межлопаточной области спины крыс способствует наиболее полному перекисному гемолизу эритроцитов крови крыс (степень гемолиза, в среднем, 7 %, p<0,001). Лечение ожогов кожи бальзамом «Спасатель» вызывает средний гемолиз (степень гемолиза в среднем 3,94 %, р<0,05), при терапии ожоговых травм межлопаточной области спины крыс спреем Д-пантенолом наблюдался частичный гемолиз (степень гемолиза в среднем и 3,62 %, Р<0,05).
Таблица 2
Перекисная резистентность эритроцитов самцов крыс (% гемолизированных эритроцитов)
Группа | Количество животных | М+m |
1 -Контроль | 10 | 3,82+0,121* |
2 -Ожог | 10 | 6,83+0,469 *** ### |
3 -Ожог+аппликации мазью «Д-пантенол» | 10 | 3,62+0,174*** ### |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,94+0,081* |
5-Ожог+аппликации настойкой календулы | 10 | 4,94+0,081* |
Примечание: в сравнении с контрольными животными: *р<0,05; **p<0,01; ***p<0,001; в сравнении с группой 2-Ожог: #р<0,05; ##p<0,01; ###p<0,001.
Анализ данных по определению перекисного гемолиза эритроцитов самцов белых крыс показал, что устойчивость эритроцитов к перекисной провокации значительно повышалась в условиях лечения ожогов кожи крыс аппликациями бальзамом «Спасатель». Воздействие аппликациями мазью «Д-пантенол» привели к повышению устойчивости эритроцитов к перекисной провокации и приблизили показатели перекисного гемолиза эритроцитов к контролю. Термический ожог без лечения резко снизил устойчивость эритроцитов к перекисной провокации. Аппликации настойкой календулы незначительно повысил устойчивость эритроцитов к гемолизу (см. табл. 2).
Установлено, что термические ожоги существенно влияют и на общее число лейкоцитов, что проявлялось выраженной лейкопенией во все сроки наблюдения. В табл. 3 представлена некоторая волнообразность лейкопении. Так, на 3-и сутки количество лейкоцитов составляло 1,8±1,4 × 109, на 7-е – 2,5±1,4 × 109, на 14-е – 0,85±1,4 × 109, на 30-е – 2,4±1,4 × 109. Учитывая, что в контрольной серии уровень лейкоцитов составлял 10,2±1,4 × 109, что соответствует и литературным данным [9], отмечено значительное снижение числа защитных клеток крови.
Таблица 3
Содержание лейкоцитов в периферической крови крыс
Экспериментальные группы | Количество животных, n | Количество лейкоцитов × 109 на 3 сутки эксперимента | Количество лейкоцитов × 109 на 7 сутки эксперимента | Количество лейкоцитов × 109 на 10 сутки эксперимента |
1-Контроль | 10 | 3,4 ± 0,1 | 3,2 ± 0,1 | 3,0 ± 0,1 |
2-Ожог | 10 | 3,8 ± 0,2 * | 3,3 ± 0,3 * | 2,9 ± 0,2 * |
3-Ожог+аппликации мазью «Д-пантенол» | 10 | 3,2 ± 0,3 * | 3,1 ± 0,3 * | 2,9 ± 0,3 * |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,1 ± 0,3* | 3,1 ± 0,3* | 3,2 ± 0,4* |
5-Ожог+аппликации настойкой календулы | 10 | 2,8 ± 0,2 * | 3,1 ± 0,3 * | 2,9 ± 0,2 * |
Примечание: * – p<0,05 – достоверность различий между группами животных по сравнению с контролем.
Наблюдалось изменение общего количества лейкоцитов после термического воздействия между экспериментальными группами и контролем (см. табл. 3). В ходе экспериментов было выявлено, что у животных, получавших терапию Д-пантенолом, происходило незначительное уменьшение общего количества лейкоцитов в сравнении с контролем. У животных, получавших лечение настойкой календулы, количество лейкоцитов достоверно уменьшилось в сравнении с контрольной группой на 22 % (р<0,05).
Изучение лейкоцитарной формулы дало не менее интересные результаты. В табл. 4 отражены результаты исследования влияния ожоговой травмы на показатели лейкоцитарной формулы периферической крови подопытных крыс. В контрольной серии в формуле преобладали лимфоциты до 55–60 %, нейтрофилы составляли 40 %. При исследовании получено, что термический ожог приводил к достоверному и выраженному увеличению процентного числа лимфоцитов и нейтрофилов. Так, на 3-и сутки лимфоциты составляли 67,4 %.
Таблица 4
Изменение показателей лейкоцитарной формулы на 3-и сутки эксперимента
Экспериментальные группы | Нейтрофилы, M±m, % | Лимфоциты, M±m, % | Эозинофилы M±m, % | Моноциты M±m, % |
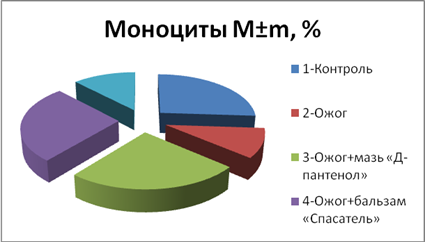
1-Контроль | 40,1±3,52 | 55,6±3,18 | 2,1±0,71 | 6,2±2,00 |
2-Ожог | 27,1± 2,97* | 67,4±2,61* | 3,1± 0,80* | 2,4± 0,34* |
3-Ожог+аппликации мазью «Д-пантенол» | 37,2± 2,91# | 60,2±2,94# | 2,7± 0,49# | 5,9± 0,61# |
4-Ожог+аппликации бальзамом «Спасатель» | 41,0± 2,99# | 58,6±5,22 # | 2,9± 0,31# | 6,4± 2,32# |
5-Ожог+аппликации настойкой календулы | 41,0± 2,99 # | 64,6±5,22 # | 2,7± 0,31# | 2,9± 2,32# |
Примечание: р<0,05, * – в сравнении с контролем,
# – в сравнении с группой получивших ожог без лечения.
Данные эксперимента моделирования термического ожога межлопаточной области спины белых крыс свидетельствовали о достоверном колебании количества нейтрофилов у животных, получавших лечение аппликациями спрея, в сравнении с контрольной группой и группой, не получавших лечение (рис. 1).
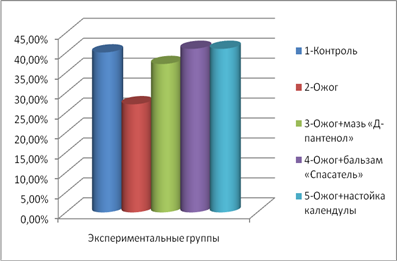
Рис. 1. Количество нейтрофилов (M±m, %) в разных опытных группах
Отмечено, что показатели количества нейтрофилов, по сравнению с контролем, чуть ниже в группе, лечившихся спреем «Д-пантенол», и незначительно выше в группе, лечившихся бальзамом «Спасатель». На рис. 2 видно, что отсутствие терапии ожога у 2 группы крыс отразилось на большем количественном содержании лимфоцитов крови.
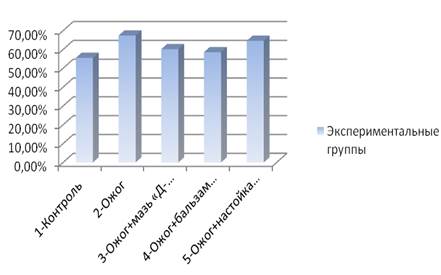
Рис. 2. Количество лимфоцитов (M±m, %) в разных опытных группах
У группы крыс, лечившихся бальзамом «Спасатель», количество лимфоцитов увеличилось. При сравнении крыс, лечившихся спреем «Д-пантенол», с контрольной группой наблюдалось снижение количества лимфоцитов, а у крыс, лечившихся настойкой календулы, количество лимфоцитов практически не отличалось от 2 группы.
При ожоге наблюдалось изменение показателей эозинофилов: увеличение этого показателя в группе 2 (ожог без терапии), в сравнении с группами крыс, получавших лечение (р<0,05). У животных, лечившихся спреем, количество эозинофилов повысилось на 22 %, по сравнению с контролем, при терапии настойкой календулы оно понизилось, что не достоверно (рис. 3).
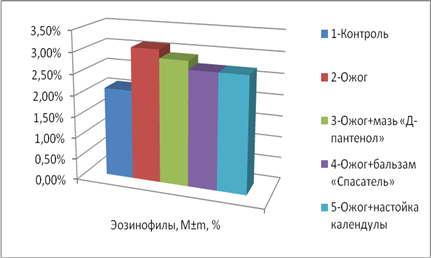
Рис. 3. Количество эозинофилов (M±m, %) в разных опытных группах
Как видно из круговой диаграммы на рис. 4, термическое воздействие без лечения приводило к снижению количества моноцитов, терапия аппликациями бальзамом «Спасатель» и спреем «Д-пантенол» стимулировало незначительное увеличение количества моноцитов в крови, по сравнению с контрольной группой подопытных животных (рис. 4).

Рис. 4. Количество моноцитов (M±m, %) в разных опытных группах
Заключение
Исследование таких гематологических показателей, как количество эритроцитов, лейкоцитов, уровень гемоглобина и состояние перекисной резистентности эритроцитов, свидетельствует о значительном поражении системы крови под воздействием местного воздействия термического фактора. Наиболее результативными оказались эксперименты терапии ожогов крыс аппликациями спрея «Д-пантенол» и бальзама «Спасатель».
Таким образом, применение в эксперименте лекарственных средств для лечения ожогов (спрей Д-пантенол, бальзам «Спасатель») способствует существенному ингибированию свободнорадикального окисления, к повышению прочности клеточных мембран компонентов крови.
Библиографическая ссылка
Ажикова А.К., Журавлева Г.Ф. ИССЛЕДОВАНИЕ ГЕМАТОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРЫС В НОРМЕ И В УСЛОВИЯХ ТЕРМИЧЕСКОГО ВОЗДЕЙСТВИЯ // Современные проблемы науки и образования. – 2016. – № 2.;
URL: https://science-education.ru/ru/article/view?id=24350 (дата обращения: 01.12.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
