В чем актуальность железодефицитной анемии у детей
В обзоре литературы приводятся причины развития железодефицитной анемии (ЖДА) у детей раннего возраста и подростков, описаны группы риска развития дефицита железа, уделено внимание особенностям лечения ЖДА с помощью солевых препаратов железа и препаратов железа на основе гидроксид-полимальтозного комплекса. Приведены критерии оценки эффективности лечения и причины неэффективности терапии ЖДА. Рекомендуется придерживаться принципов первичной и вторичной профилактики дефицита железа, что способно приводить к резкому снижению его распространенности.
Железодефицитная анемия (ЖДА) составляет 90 % всех анемий детского возраста [1]. Существует два пика распространенности дефицита железа (ДЖ) у детей: в раннем возрасте (особенно до года) и в пубертатном периоде. Эти пики совпадают с пиками интенсивного увеличения массы тела, роста детей и подростков, описанными J. Tanner и соавт. [2] еще в 1966 г. Причины развития ДЖ в эти возрастные периоды несколько различны.
Снабжение плода железом имеет ряд особенностей. Оно поступает из организма матери с помощью транспортного белка – трансферрина. Железо активно переносится через плаценту против градиента концентрации. Уровень ферритина в крови плода всегда выше, чем в крови матери. Плод может получать нормальное количество железа даже в случае дефицита его у матери. Существуют факторы, способные нарушать транспорт железа от матери к плоду: артериальная гипертензия у матери, плацентарная недостаточность, сахарный диабет у матери, хроническая гипоксия плода. Активность плацентарного транспорта железа определяется запасами его не у матери, а у плода. Таким образом, железо поступает к плоду внутриутробно, и этих запасов хватает на 4 месяца жизни ребенка после рождения [3].
После рождения ребенка происходят значимые для эритропоэза процессы: переход от синтеза фетального гемоглобина (HbF) к синтезу HbA, окончательно завершающийся к 6-му месяцу; лизис эритроцитов, приводящий к укорочению срока их жизни; увеличение объема циркулирующей крови в связи с интенсивным ростом ребенка до года. В результате этих процессов у ребенка после рождения обязательно происходит снижение концентрации Hb. У детей, рожденных доношенными, снижение концентрации Hb выявляется с 6–8-недельного возраста и достигает уровня 100–110 г/л. Это явление наблюдается среди большинства детей в популяции и получило название физиологической анемии.
У детей, рожденных недоношенными, снижение концентрации Hb возникает раньше – начиная с 4–5-й недели жизни, при этом уровень Hb достигает 60–80 г/л. Это состояние получило название ранней анемии недоношенных. Основными механизмами ее развития кроме указанных выше служат неадекватная продукция эритропоэтина, задержка эритропоэза на фоне увеличивающегося объема циркулирующей крови и возможные ятрогенные воздействия, связанные с частым забором венозной крови для анализов. Показано, что время возникновения анемии, связанной с ДЖ, у детей после рождения зависит от доношенности или недоношенности ребенка и массы его тела при рождении (табл. 1).
Группы риска развития ДЖ у детей до года наиболее полно описаны в рекомендациях по профилактике и лечению ДЖ в США [4], согласно которым наибольшему риску развития дефицита подвержены:
- недоношенные дети;
- дети с низкой массой тела при рождении;
- дети из многоплодной беременности;
- дети, не получающие грудного вскармливания или молочных смесей, обогащенных железом;
- дети из социально неблагополучных семей.
Проблема ДЖ – это прежде всего проблема питания, поэтому первичная профилактика ЖДА – это адекватное, сбалансированное питание человека в любом возрасте. Ежедневная потребность взрослого в железе составляет около 1–2, ребенка – 0,5–1,2 мг. Обычная диета обеспечивает поступление от 5 до 15 мг элементарного железа в день. В желудочно-кишечном тракте (двенадцатиперстной кишке и верхнем отделе тощей кишки) всасывается лишь 10–15 % железа, содержащегося в пище.
Основным пищевым источником железа являются продукты животного происхождения, содержащие гемовое железо. Наибольшее его количество содержится в говядине, баранине, печени, меньше – в рыбе, курином мясе, твороге. Важным является не то, сколько железа содержится в продукте, а какова его биодоступность. По сравнению с животными продуктами негемовое железо, содержащееся в растительной пище (овощи, фрукты, злаки), имеет сниженную биодоступность, что означает его более низкую всасываемость. Кроме того, всасывание железа определяется рядом факторов: витамин С усиливает его, а такие вещества, как таниновая кислота, входящая в состав чая, или фитаты, встречающиеся в некоторых продуктах, могут существенно угнетать. При ЖДА всасывание железа в двенадцатиперстной кишке резко возрастает, что связано с подавлением синтеза гепцидина.
В настоящее время для профилактики ДЖ в большинстве стран мира приняты соответствующие рекомендации. В основном они касаются детей раннего возраста, беременных и кормящих женщин, а также женщин репродуктивного возраста. Американская академия педиатрии (American Academy of Pediatrics) в 2010 г. пересмотрела рекомендации по профилактике ЖДА у детей первого года жизни и детей раннего возраста (1–3 года).
Основные положения этих рекомендаций сводятся к следующему [3]:
- доношенные здоровые дети имеют достаточные запасы железа в первые 4 месяца жизни. В связи с небольшим содержанием железа в грудном молоке детям, находящимся на грудном вскармливании, показано дополнительное назначение железа (1 мг на 1 кг массы тела в сутки) начиная с 4-месячного возраста и до введения прикорма (например, каши, обогащенной железом);
- доношенные дети, находящиеся на смешанном вскармливании (грудное молоко составляет более половины рациона), должны дополнительно получать 1 мг железа на 1 кг массы тела в сутки начиная с 4-месячного возраста и до ведения прикорма;
- дети, находящиеся на искусственном вскармливании и получающие молочные смеси, обогащенные железом, получают достаточное количество железа из молочных смесей или прикорма. Цельное коровье молоко не следует назначать детям до 12 месяцев;
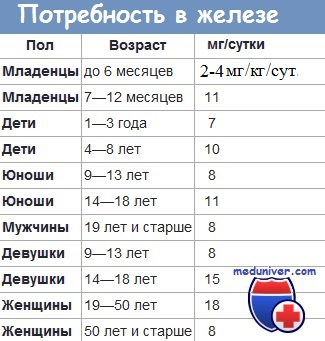
- дети в возрасте 6–12 месяцев должны получать 11 мг железа в сутки. В качестве блюд прикорма следует назначать красное мясо и овощи с высоким содержанием железа.
В случае недостаточного поступления железа с молочными смесями или прикормом следует дополнительно назначать его в виде капель или сиропа; дети в возрасте 1–3 лет должны получать 7 мг железа в сутки, лучше в виде пищи, содержащей достаточное количество красного мяса, овощей с высоким содержанием железа и фруктов с большим содержанием витамина С, который усиливает всасывание железа. Также возможно дополнительное назначение жидких форм препаратов железа или поливитаминов; все дети, родившиеся недоношенными, должны получать по крайней мере 2 мг железа на 1 кг массы тела в сутки до 12-месячного возраста, что соответствует содержанию железа в обогащенных им молочных смесях. Дети, родившиеся недоношенными, находящиеся на грудном вскармливании, должны получать 2 мг железа на 1 кг массы тела в сутки начиная с 1 месяца жизни и до перехода на искусственное вскармливание молочными смесями, обогащенными железом, или до введения прикорма, обеспечивающего поступление 2 мг железа на 1 кг массы тела в сутки.
Последствиями ДЖ в раннем детстве могут быть отставание в психомоторном развитии [5–9] и повышенная восприимчивость к инфекциям. Эти последствия сохраняются в дальнейшей жизни в виде нарушений когнитивных функций, плохой успеваемости в школе, проблем с поведением в более старшем возрасте [5–9].
Причины снижения концентрации Hb у подростков: особенности питания (вегетарианство), нарушения менструальной функции у девушек, занятия тяжелыми видами спорта (анемия атлетов).
«Золотым» стандартом лечения ЖДА многие годы считался сульфат железа. Невысокая стоимость, простота получения, высокая эффективность в лечении ЖДА, определяемая высокой всасываемостью по сравнению с другими солями железа (глюконатом, хлоридом и фумаратом), привели к тому, что препараты на основе сульфата железа преобладали на рынке. На сегодняшний день в распоряжении врача имеется множество пероральных солевых препаратов двухвалентного железа: сульфат железа (Актиферрин, Гемофер пролонгатум, Сорбифер Дурулес, Тардиферон, Ферроплекс, Ферроградумет, Ферро-Фольгамма); глюконат железа (Тотема, Апо-Ферроглюконат); хлорид железа (Гемофер); фумарат железа (Ферретаб комп., Железа фумарат 200, Ферронат) и др. [10, 11].
В лечении ЖДА могут возникать следующие проблемы, связанные с применением солевых препаратов железа [12, 13]:
- возможность передозировки, интоксикации и даже отравлений вследствие малого размера молекулы, пассивного, неконтролируемого всасывания и возможности достижения опасных концентраций в организме;
- взаимодействие с пищей и другими препаратами, если они применяются больным;
- выраженный металлический привкус, окрашивание эмали зубов и десен (иногда стойкое);
- частый отказ пациентов от лечения (до 30–35 % от начавших терапию), особенно детей и беременных женщин.
Многие проблемы, связанные с применением солевых препаратов железа, удалось решить благодаря созданию препаратов железа на основе гидроксид-полимальтозного комплекса (ГПК).
Основные свойства и преимущества этих препаратов [13, 14]:
- высокая эффективность;
- безопасность, крайне низкий риск передозировки, интоксикации и отравлений;
- редкие случаи потемнения десен и зубов;
- отсутствие взаимодействия с другими лекарственными средствами и продуктами питания;
- приятный вкус и отсутствие металлического привкуса;
- отличная переносимость, которая определяет регулярность лечения;
- антиоксидантные свойства.
Еще одна важная особенность современных препаратов железа на основе ГПК состоит в том, что разработаны лекарственные формы для всех возрастных групп (капли, сироп, таблетки), что обеспечивает гибкость дозирования и удобство применения. Врачи должны знать о существующей международной тенденции смены солевых препаратов железа на препараты железа на основе ГПК. Современные пероральные препараты трехвалентного железа на основе ГПК (Мальтофер, Мальтофер Фол, Феррум Лек) хорошо известны в нашей стране уже много лет. В последнее время значительно повысилось внимание врачей-педиатров к жидким формам препаратов железа (капли, сироп).
Возрастные терапевтические дозы солевых препаратов железа и препаратов железа на основе ГПК представлены в табл. 2.

Обязателен контроль переносимости препаратов железа и эффективности лечения ЖДА. Существует несколько критериев эффективности проводимой терапии ЖДА:
- повышение количества ретикулоцитов на 2–3 % по отношению к исходному на 7–10-й день от начала лечения препаратами железа (ретикулоцитарная реакция);
- повышение концентрации Hb (на 10 г/л) и гематокрита на 3 % к концу 4-й недели лечения [4];
- исчезновение клинических проявлений заболевания через 1–3 месяца от начала лечения;
- преодоление тканевой сидеропении через 3–6 месяцев от начала лечения (в зависимости от степени тяжести анемии), что может быть доказано по нормализации концентрации сывороточного ферритина.
Причины неэффективного лечения ЖДА:
- неправильно установленный диагноз ЖДА;
- неадекватная дозировка препарата железа;
- нарушение длительности лечения ЖДА;
- невыполнение курса лечения ЖДА родителями пациента;
- проблемы с всасываемостью препаратов у больного;
- непереносимость назначенного препарата железа больным;
- железорефрактерная ЖДА (iron refractory iron deficiency anemia − IRIDA).
IRIDA как возможную причину неэффективности проводимой терапии следует предполагать при исключении всех указанных выше причин. Отсутствие ответа на лечение препаратами железа при IRIDA обусловлено наличием различных мутаций в гене ТМРRSS6 [16]. Для IRIDA характерны отсутствие ответа на терапию пероральными препаратами железа, частичный ответ на лечение парентеральными препаратами железа, хроническое течение заболевания и наличие семейных случаев. Предполагают, что обнаруженные мутации в гене ТМРRSS6 приводят к избыточному синтезу гепцидина – белка, который регулирует в организме 2 важных процесса: всасывание железа в двенадцатиперстной кишке и высвобождение его из макрофагов в процессе реутилизации [16, 17]. Распространенность IRIDA пока не известна, методы эффективного лечения не разработаны. Почти ежегодно описывают новые мутации, характерные для IRIDA [17].
Решение проблемы ДЖ основано на двух принципах – первичной и вторичной профилактике [4]. Внедрение в практику этих принципов привело к снижению распространенности ДЖ среди населения США до 1–2 %. Первичная профилактика ДЖ подразумевает правильное, полноценное питание, вторичная профилактика – активное выявление ДЖ и ЖДА в процессе диспансеризации, медицинских осмотров, при каждом посещении врача.
- Хертл М. Дифференциальная диагностика в педиатрии. Пер. с нем. М., 1990. Т. 2. 510 с.
- Tanner J.M., Whitehouse R.H., Takaishi M. Standards from birth to maturity for height, weight, height velocity, and weight velocity: British children, 1965. I. Arch. Dis. Child. 1966;41(219):454–71.
- Baker R.D., Greer F.R. Committee on Nutrition American Academy of Pediatrics. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0–3 years of age). Pediatrics. 2010;126(5):1040–50.
- Recommendation to prevent and control iron deficiency in the United States. MMWR Recomm. Rep. 1998;47(RR-3):1–29.
- Lozoff B., Wolf A.W., Jimenez E. Iron-deficiency anemia and infant development: effects of extended oral iron therapy. J. Pediatr. 1996;129(3):382–89.
- Lozoff B., Klein N.K., Nelson E.C., et al. Behavior of infants with iron-deficiency anemia. Child. Dev. 1998;69(1):24–36.
- Lozoff B. Perinatal iron deficiency and the developing brain. Pediatr. Res. 2000;48(2):137–39.
- Lozoff B., Jimenez E., Hagen J., Mollen E., Wolf A.W. Poorer behavioral and developmental outcome more than 10 years after treatment for iron deficiency in infancy. Pediatrics. 2000;105(4):E51.
- Grantham-McGregor S., Ani C. A review of studies on the effect of iron deficiency on cognitive development in children. J. Nutr. 2001;131(2S–2):649S–66S.
- Регистр лекарственных средств России. Энциклопедия лекарств. Ежегодный сборник: htpp://www.rlsnet.ru.
- Vidal 2011. Справочник Видаль. Лекарственные препараты в России. М., 2011.
- Кольцов О.В. Особенности клинической картины, диагностики и лечения случайных отравлений ферросодержащими препаратами у детей. Дисс. канд. мед. наук. Новосибирск, 2002. 18 с.
- Tobili J.E., Brignoli R. Iron(III)-hydroxide polymaltose complex in iron deficiency anemia (review and meta-analysis). Arzneimittel Forschung. 2007;57(6a):431–38.
- Geisser P. Safety and efficacy of iron (III)-hydroxide polymaltose complex. A review of over 25 years of experience. Arzneimittel Forschung. 2007;57(6a):439–52.
- Румянцев А.Г., Коровина Н.А., Чернов В.М. и др. Диагностика и лечение железодефицитной анемии у детей. Методическое пособие для врачей. М., 2004. 45 с.
- Finberg K.E., Heeney M.M., Campagna D.R., et al. Mutations in TMPRSS6 cause iron-refractory iron deficiency anemia (IRIDA). Nat. Genet. 200;40(5):569–71.
- Pellegrino R.M., Coutinho M., D’Ascola D., et al. Two novel mutations in the tmprss6 gene associated with iron-refractory iron-deficiency anaemia (irida) and partial expression in the heterozygous form. Br. J. Haematol. 2012;158(5):668–72.
В.М. Чернов – д.м.н., проф., зав. отделом детской гематологии и редких заболеваний «Федерального научно-клинического центра детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России venmihcher@mail.ru
И.С. Тарасова – д.м.н., доцент, зав.отделом наследственных и редких болезней «Федерального научно-клинического центра детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России; IrTarasova@mail.ru
Источник
Железодефицитная анемия у детей: клиника, диагностика, лечение
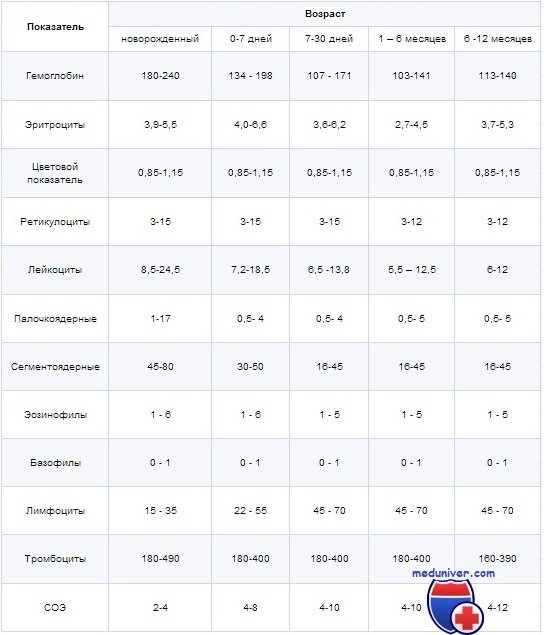
Анемия определяется при Hb ниже нормального уровня. Нормальный уровень варьирует в зависимости от возраста, поэтому анемия определяется как:
• в неонатальном периоде: Hb менее 14 г/дл;
• 1-12 мес: Hb менее 10 г/дл;
• 1-12 лет: Hb менее 11 г/дл.
Анемия формируется в результате одного или нескольких механизмов.
• Снижение продукции эритроцитов — как в связи с неэффективным эритропоэзом (например, дефицит железа — наиболее распространённая причина анемии), так и в связи с аплазией эритроцитов.
• Увеличение деструкции эритроцитов (гемолиз).
• Кровопотеря — относительно нечастая причина у детей.
Может быть комбинация всех трёх механизмов, например, анемия недоношенных.
Определение анемии варьирует в зависимости от возраста: Нb менее 10 г/л — у младенцев (постнеонатальный период), Нb менее 11 г/л — в возрасте от 1 до 12 лет.
Анемия в связи со снижением продукции эритроцитов
Снижение продукции эритроцитов может быть связано:
• с неэффективным эритропоэзом — в данном случае продукция происходит на нормальном или увеличенном уровне, однако дифференциация или выживание эритроцитов нарушены (например, дефицит железа);
• полным отсутствием продукции эритроцитов (аплазией эритроцитов). Диагностические подсказки для установления неэффективного эритропоэза.
• Нормальное число ретикулоцитов.
• Патологический средний клеточный объём (MCV) эритроцитов: низкий при железодефицитной анемии и увеличивается при дефиците фолиевой кислоты при миелодисплазии.
Дефицит железа как причина анемии
Основные причины железодефицитной анемии:
• Неадекватное поступление железа.
• Мальабсорбция.
• Кровопотеря.
Неадекватное поступление железа типично для младенцев, поскольку при увеличении объёма крови, сопровождающем рост, и для формирования запасов железа требуется дополнительное его количество. Годовалому младенцу требуется около 8 мг/кг железа в день, приблизительно столько же, сколько его отцу (9 мг/кг), однако лишь половину количества, необходимого его матери (15 мг в день).

Железо может поступать:
• из грудного молока (низкое содержание железа, при этом усваивается 50%);
• смеси для искусственного вскармливания (обогащаются адекватными количествами железа);
• коровьего молока (более высокое содержание железа, чем в грудном молоке, однако усваивается только 10%);
• прикорм, например, зерновых продуктов (обогащены железом, но усваивается только 1%).
Дефицит железа может развиваться при задержке введения смешанного вскармливания позже 4-6-месячного возраста или при диете, недостаточно обогащенной железом, особенно если она содержит большое количество коровьего молока. Всасывание железа значительно увеличивается, если оно употребляется в составе пищи, богатой витамином С (свежие фрукты и овощи) и ингибируется танином, содержащимся в чае.
Младенцев нельзя вскармливать немодифицированным коровьим молоком, поскольку содержание железа в нём низкое и оно плохо всасывается.
Пищевые источники железа:
I. Высокое содержание железа:
– Красное мясо — говядина, ягнятина.
– Печень, почки.
– Жирная рыба — сардины и т.д.
II. Среднее содержание железа:
– Бобы и груши.
– Обогащенные сухие завтраки из зерновых с добавлением витамина С.
– Продукты из непросеянной муки.
– Орехи и зерновые — кешью, арахисовое масло и т.д.
– Сухофрукты — изюм, кишмиш.
– Тёмно-зелёные овощи — брокколи, шпинат и т.д.
III. Продукты, избыточное потребление которых необходимо избегать у детей, начинающих ходить:
– Коровье молоко.
– Продукты с большим содержанием клетчатки — фитиновая кислота ингибирует всасывание железа.
– Чай — танин ингибирует всасывание железа.
Клинические признаки анемии у детей
У большинства младенцев и детей отсутствуют клинические проявления до тех пор, пока Hb не упадёт ниже 6-7 г/дл. При усугублении анемии дети становятся легкоутомляемыми, а младенцы сосут намного медленнее, чем обычно. Может отмечаться бледность, однако она является недостоверным признаком, пока не подтвердится бледностью конъюнктив, языка или ладонных складок.
У некоторых детей отмечается «геофагия» (извращённый аппетит) — термин, который описывает противоестественное поедание несъедобных материалов, таких как земля, мел, гравий или пенорезина. Имеются доказательные данные, что железодефицитная анемия может разрушительно действовать на поведение и интеллектуальные функции. Сбор анамнеза должен включать опрос о кровопотере и симптомах или признаках, предполагающих мальабсорбцию.
Диагностика анемии у детей
Диагностические подсказки:
• Микроцитарная, гипохромная анемия [низкие MCV и МСН (среднее содержание Нb в эритроците)].
• Низкий ферритин плазмы.
Другие основные причины микроцитарной анемии:
• малая b-талассемия (обычно у детей азиатского, арабского и средиземноморского происхождения);
• малая а-талассемия (обычно у детей африканского и дальневосточного происхождения);
• анемия при хронических заболеваниях (например, связанная с почечной недостаточностью).
Лечение анемии у детей
У большинства детей лечение подразумевает рекомендации по питанию и дополнительный приём пероральных препаратов железа. Наиболее легкопереносимыми препаратами являются ситрон («Sytron», натрий железо ЭДТА) или ниферекс («Niferex», полисахаридный комплекс железа) — в отличие от некоторых других препаратов они не пачкают зубы.
Приём препаратов железа должен продолжаться как минимум 3 мес для восстановления уровня Нb до нормы и также для восполнения запасов железа. При хорошем комплайансе уровень Нb поднимается со скоростью 1 г/дл в неделю. Отсутствие ответа на терапию препаратами железа обычно означает, что ребёнок просто не получает лечение.
Однако рекомендуется диагностика других причин, в особенности мальабсорбции (например, вследствие целиакии) или хронической кровопотери (например, при дивертикуле Меккеля), если имеются указания из анамнеза или обследования. Предполагается непищевая причина железодефицитной анемии, если отсутствует ответ на терапию у комплаентных пациентов.
При железодефицитной анемии, связанной с недостатком потребления железа, никогда не показано проведение гемотрансфузий. Низкий уровень гемоглобина могут переносить даже дети с Нb до 2-3 г/дл при длительном снижении его уровня.
Лечение железодефицитного состояния при нормальном Нb
Спорным является вопрос, должны ли дети с нормальным уровнем Нb, но при биохимическом подтверждении наличия дефицита железа (например, низкий ферритин сыворотки) получать лечение оральными препаратами железа. В пользу лечения выступают сведения, что железо требуется для нормального развития головного мозга, и имеются доказательные данные, что железодефицитная анемия сопровождается нарушениями поведения и интеллекта, которые могут быть обратимы при лечении препаратами железа.
Однако до сих пор нет ясности относительно того, даёт ли лечение субклинического дефицита железа значительное улучшение. Лечение также несёт риск случайного отравления оральными препаратами железа, поскольку они очень токсичны. Простая стратегия заключается в рекомендациях по поводу питания для увеличения поступления железа и его всасывания у всех детей с субклиническим дефицитом. Можно предложить родителям дополнительно вводить ребёнку препараты железа.
Лечение железодефицитной анемии проводится при помощи рекомендаций по питанию и пероральной терапии железом на протяжении нескольких месяцев.
Пример железодефицитной анемии у детей. У 2-летней Адели врач общей практики отметил бледность при осмотре по поводу инфекции верхних дыхательных путей. Согласно результатам анализа крови было выявлено: Нb — 5,0 г/дл, MCV — 54 фл (норма — 72-85 фл) и МСН — 16 пг(норма — 24-39 пг). Она выпивала по три пинты коровьего молока в день и очень быстро ела, отказывалась от мяса. Затем начала есть землю, играя в саду.
В связи с неадекватно большим объёмом молока, которое она потребляла, она не была достаточно голодна для употребления твёрдой пищи. Замена некоторого количества потребляемого ею молока обогащенной железом пищей и лечение пероральными препаратами железа привели к увеличению Нb до 7,5 г/дл в течение 4 нед. Её геофагия (поедание несъедобных предметов) прекратилась.
Примечание. Нb — гемоглобин; МСН — среднее содержание гемоглобина в эритроците; MCV — средний клеточный объём.
– Также рекомендуем “Аплазия эритроцитов у детей. Анемия Даймонда-Блекфана”
Оглавление темы “Болезни крови детей”:
- Гистиоцитоз клеток Лангерганса у детей: клиника, диагностика, прогноз
- Прогноз при раке у ребенка. Рекомендации
- Образование гемоглобина у плода и новорожденного. Показатели в норме
- Железодефицитная анемия у детей: клиника, диагностика, лечение
- Аплазия эритроцитов у детей. Анемия Даймонда-Блекфана
- Гемолитическая анемия у детей: причины, диагностика
- Наследственный сфероцитоз у детей: причины, диагностика, лечение
- Дефицит глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) у детей: причины, диагностика, лечение
- Серповидно-клеточная анемия (СКА) у детей: клиника, диагностика
- Лечение серповидно-клеточной анемии у детей. Рекомендации
Источник
