В12 дефицитная анемия pdf

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Махмудова А.А.
1
1 ФГБОУ ВО «Пермский государственный медицинский университет им. акад. Е.А. Вагнера» Минздрава России
В12-дефицитная анемия одна из форм мегалобластной анемии, возникающая вследствие недостатка в организме цианокобаламина. Дефицит витамина В12 могут вызвать различные этиологические факторы, которые могут быть как наследственными так приобретаемыми в течении жизни заболеваниями. Данный вид анемии считается сравнительно редко встречающимся клинико-гематологическим синдромом. Склонны к этому виду анемии лица в возрасте 40–50 лет. Клинические проявления долгое время не прослеживаются, так как они наступают лишь после полного истощения запасов, что при отсутствии поступления кобаламина наступает только через 1000 дней. В12-дефицитная анемия характеризуется нарушением превращения витамина В12 в одну из активных форм, в результате анемия приводит к нарушению процесса кроветворения, а также поражениям пищеварительной и нервной системы. Существует несколько методов диагностики данной анемии характеризующиеся выявлением в крови клеток патологической регенерации – мегалобластов и эритроцитов, содержащих тельца Жолли и кольца Кебота. Однако лечение сходится к одному – пероральному и парентеральному введению витамина В12.
B12–дефицитная анемия
цианокобаламин
мегалобластная анемия
1. Алексеев Н.А. Анемии. – СПб.: Гиппократ, 2004. – 512 с.
2. Боровский Е.В., Данилевский Н.Ф. Атлас заболеваний слизистой оболочки рта. – М.: Медицина, 1991. – 256 с.
3. Внутренние болезни: учебник / В.И. Маколкин, С.И. Овчаренко. – М.: Медицина, 2005. – 592 с.
4. Дворецкий Л.И. Анемии: стратегия и тактика диагностического поиска. Справочник поликлинического врача, 2002. – №6.
5. Детские болезни: учебник / Под ред. А.А. Баранова. – 2–е изд., – 2009. – 1008 с.
6. Практическая терапевтическая стоматология: учеб. пособие / А.И. Николаев, Л.М. Цепов. – М.: МЕДпресс-информ, 2016. – 928 с.
7. Экспериментальные модели в патологии: учебник / В.А. Черешнев, Ю.И. Шилов, М.В. Черешнева, Е.И. Самоделкин, Т.В. Гаврилова, Е.Ю. Гусев, И.Л. Гуляева. – Пермь: Перм. гос. ун-т., 2011. – 267 с.
В настоящее время В12-дефицитная анемия считается сравнительно редко встречающимся клинико-гематологическим синдромом. Причины этой патологии носят различный характер, поэтому изучение вопросов этиологии, патогенеза, диагностики и лечения данной болезни представляет собой актуальную тему для исследования.
В12-дефицитная анемия по типу эритропоэза относится к мегалобластным анемиям, развивающимся из-за нарушения пролиферации и созревания эритрокариоцитов в связи с подавлением синтеза нуклеиновых кислот. Основным признаком данного вида анемии является появление в костном мозге большого количества мегалобластов. Причиной возникновения мегалобластной анемии в данном случае является дефицит витамина В12 [1].
Недостаток цианокобаламина (витамин В12) может возникнуть в результате нарушения всасывания витамина, причиной которого могут быть наследственные или приобретаемые в течении жизни заболевания. К наследственным факторам развития относятся дефицит гастромукопротеина, генетически обусловленные нарушения всасываемости в тонком кишечнике, наследственный дефицит и функциональные аномалии транскобаламина II. Приобретенные формы дефицита витамина В12 проявляются в нарушении секреции гастромукопротеина в желудке, атрофии париетальных клеток слизистой оболочки, антитела к этим клеткам, гастромукопротеину или к его комплексу с цианокобаламином, органические поражения желудка, такие как гастрэктомия, опухоли желудка, распространенный полипоз желудка, а также органические нарушения тонкого кишечника в виде резекции кишечника, илеита, болезни Крона. На развитие В12-дефицитной анемии влияет также повышенное потребление организмом кобаламина в связи с беременностью, наличием кишечной флоры при дивертикулезе кишечника или инвазия широкого лентеца. Немаловажной причиной развития данного синдрома является снижение потребления витамина В12 из-за неправильного питания, недостатка продуктов животного происхождения в рационе, вегетарианства [7].
При достаточном поступлении цианкобаламина в организм происходит последовательное протекание преобразовательных процессов. В желудке при кислом значении рН витамин может связываться с внутренним фактором Касла, продуцируемым париетальными клетками желудка, или R-факторами, находящимися в слюне и желудочном соке. Данные комплексы нужны для защиты витамина В12 от разрушения при транспортировке по системе пищеварительных органов. В тонкой кишке при щелочном значении рН под влиянием протеиназ панкреатического сока цианкобаламин отщепляется от R-протеинов и соединяется с внутренним фактором Касла. В подвздошной кишке комплекс внутреннего фактора с кобаламином связывается с помощью ионов кальция со специфическими рецепторами клеток слизистой оболочки, происходит освобождение витамина В12 и транспорт к тканям, причем транспорт осуществляется с помощью белков плазмы крови – транскобаламинов I, II, III. Транспорт витамина В12 к гемопоэтическим клеткам костного мозга осуществляется преимущественно транскобаламином II. В конечном итоге кобаламин переносится в кровоток, а внутренний фактор Касла остается в просвете кишечника [3, 4]. После попадания в клетку витамин преобразуется в одну из активных форм: метил-кобаламин, принимающий активное участие в процессе образования тимидина в ДНК, и дезоксиаденозилкобаламин, который участвует в образовании жирных кислот и синтеза миелина [1, 3].
Гиповитаминоз в организме приводит к прекращению образования тимидина, нарушению присоединения уридина к ДНК, что приводит к синтезу нуклеиновой кислоты со структурными дефектами. ДНК быстро разрушается, что является причиной прекращения дальнейшего деления и дифференцировки клеток. При этом возникает мегалобластный тип кроветворения, происходит накопление больших форм лейкоцитов и тромбоцитов, их раннее внутрикостномозговое разрушение и укорочение жизни клеток, циркулирующих крови [3]. В результате гемопоэз оказывается неэффективным, развивается анемия, сочетающаяся с тромбоцитопенией и лейкопенией.
Вместе с тем, кобаламин является коферментом в реакции превращения метилмалонил-КоА в сукцинил-КоА. Данная реакция необходима для метаболизма миелина, из которого состоят оболочки нервных волокон, в связи с чем при дефиците кобаламина нарушается проведение нервного импульса по нервам, что может проявляться разнообразными неврологическими симптомами.
Клинические проявления В12-дефицитной анемии долгое время не возможно проследить, так как они наступают лишь после полного истощения запасов, что при отсутствии поступления наступает только через 1000 дней.
Развитие наступает медленно, анемии предшествуют за много лет желудочная ахилия, и может быть малосимптомной. Начальными симптомами болезни являются нарастающая физическая и психическая слабость, утомляемость, головные боли, головокружение, шум в ушах, сонливость днем и ночная бессонница, тахикардия, в последующем присоединяются диспепсические явления, в виде поноса и анорексии. Наблюдаются демиелинизация нервных волокон, повышение сухожильных рефлексов дистальные парестезии, периферическая полиневропатия, расстройства чувствительности, снижение желудочной секреция, атрофия слизистой оболочки желудка [1,3,5]. Таким образом для В12-дефицитной анемии характерна триада: поражение крови, ЖКТ, нервной системы. Чаще болеют лица 40–50 лет.
Но первые симптомы данного синдрома может проследить врач-стоматолог на приеме. Пациент может прийти с жалобами на боли и жжение в языке. Наблюдаются атрофия эпителия языка, глоссит Хантера, выражающийся в появлении на дорсальной поверхности языка болезненных ярко-красных участков воспаления по краям и кончику языка, часто захватывающих весь язык. Язык при пальпации дряблый, поверхность покрыта глубокими складками и края в виде зазубрин. В эпителии языка отмечается уменьшение количества вкусовых рецепторов, а сохранившиеся рецепторы подвергаются некробиотическим изменениям; рядом с желобоватыми сосочками происходят дегенерационные изменения нервных волокон. Нередко на языке наблюдается высыпание афт, которые распространяются слизистые оболочки глотки, пищевода. В дальнейшем воспалительные явления уменьшаются, сосочки языка атрофируются, язык становится блестящим и гладким («лакированный язык»). В области уздечки языка появляются множественные эрозии. Период обострения болезни характеризуется бледностью кожных покровов с лимонно-желтым оттенком, желтушностью слизистой оболочки, субиктеричностью склер. Лицо опухшее, с выраженной пигментацией в виде «бабочки». У больных часто выявляют множественный кариес [2, 6].
При исследовании шиповатых клеток слизистой оболочки щеки наблюдаются прогрессирующий рост цитоплазмы и ядра; определяются гиперхромия ядер с неравномерным распределением хроматина; выявляется полиморфизм клеток. Также в эпителиальном слое слизистой оболочки присутствует небольшое количество гликогена [2].
Диагностируется В12-дефицитная анемия по исследованиям крови, и тесту Шиллинга. В крове наблюдается уменьшение содержания эритроцитов, моноцитов, снижение гемоглобина, повышение цветного показателя (выше 1.05), базофильная пунктация эритроцитов, макроцитоз, анизоцитоз, пойкилоцитоз, гиперхромия, появление мегалобластов, эритроцитов с тельцами Жолли и кольцами Кебота, снижение количества ретикулоцитов, лейкоцитов, тромбоцитов [4, 7]. В сыворотке наблюдается гипербилирубинемия за счет непрямой фракции. Для уточнения диагноза необходима обязательная пункция костного мозга так как такие изменения в крови могут наблюдаться при лейкозе, гемолитической анемии, апластических и гипопластических состояниях (кроме гипохромии). Число ядросодержащих эритроидных элементов увеличено в 2–3 раза больше нормы, в связи с чем снижется число ретикулоцитов и эритроцитов на периферии, и происходит укорочение их продолжительности жизни, что способствует неэффективному эритропоэзу. Обнаруживаются типичные мегалобласты, от наличия которых зависит постановка диагноза В12 -дефицитная анемия. Это клетки с «ядерно-цитоплазматической диссоциацией», также обнаруживаются клетки больших размеров гранулоцитарного ростка кроветворения и гигантские мегакариоциты [4]. Дополнительно проводится тест Шиллинга. Витами В12 вводится в виде инъекции, если уровень витамина в моче ниже нормы – это свидетельствует о В12-дефицитной анемии. Диагноз мегалобластного кроветворения может быть поставлен только на основании сочетанного исследования мазков крови и костного мозга.
При лечении В12-дефицитной анемии терапия должна быть комплексной. Необходимо назначить правильное сбалансированное питание, содержащее достаточное количество цианкобаламина, нормализовать работу кишечника, с помощью ферментных средств, устранить диспепсические явления и провести заместительную терапию парентеральным введением витамина В12 или гидрооксикобаламина (метаболит цианкобаламина) в дозах, обеспечивающих удовлетворение дневной потребности и удвоение запасов депо. В течении двух недель внутримышечно вводят по 1000 мкг витамин В12, затем один раз в неделю до нормализации уровня гемоглобина, после чего переходят на введение 1 раз в месяц в течение всей жизни. Начало терапии цианкобаламином быстро улучшает самочувствие больных. Костномозговой эритропоэз уже через 12 часов после введения витамина В12 превращается из мегалобластного в нормобластный. Поэтому назначение витамина В12 при коматозном состоянии относится к неотложным мероприятиям. Ретикулоцитоз появляется на 3–5 день, пик его (ретикулоцитарный криз) наиболее выражен на 4–10 день. Концентрация гемоглобина нормализуется через 1–2 месяца. Гиперсегментация нейтрофилов сохраняется до 10–14 дней [1,4].
Оксикобаламин по сравнению с кобаламином быстрее переходит в активную форму кофермента, а также более длительное время циркулирует в крови. Применяют препарат дозе 500–1000 мкг каждый день. Если присутствуют симптомы поражения нервной системы, оксикобламин назначают в дозе 1000мкг курсом в две недели в течении шести месяцев [4].
При наличии изменений со стороны слизистой оболочки полости рта ротовые ванночки с 0,1% раствором димедрола, 3% взвеси анестезина в подсолнечном или персиковом масле, смесь 2 г новокаина и 5 г уротропина в 200 мл дистиллированной воды для обезболивания. С целью снижения чувства жжения в языке и восстановления репаративных процессов в виде эпителизации используют аппликации раствора витамина В12, смеси подсолнечного масла с каротолином (в соотношении 2:1), масел шиповника, облепихи [2].
Эффективность лечения оценивается с помощью изучения картины крови. Критериями подтверждающими правильность назначенного лечения являются: обнаружение резкого ретикулоцитоза, полная нормализация показателей эритроцитов и их качественного состава через 2–2,5 месяца, исчезновение неврологической симптоматики клинико-гематологического синдрома через 6 месяцев после начала терапии [2].
После завершения лечения пациент должен регулярно сдавать анализ крови, чтобы вовремя обнаружить возможные рецидивы данной анемии.
Прогноз при В12-дефицитной анемии зависит от стадии данного синдрома. На начальных этапах патологические изменения легко устраняются заместительной терапией цианокобаламином, но отсутствие необходимого лечения может привести к необратимым поражения в первую очередь головного, спинного мозга и сердца. С момента применения в лечении В12-дефицитной анемии цианокобаламина внутримышечно прогноз для жизни и здоровья пациентов значительно улучшился. Соблюдение режима приема препарата продлевает длительность жизни больных и снижает риск возобновления проявлений анемии в будущем.
Библиографическая ссылка
Махмудова А.А. В12-ДЕФИЦИТНАЯ АНЕМИЯ // Международный студенческий научный вестник. – 2018. – № 4-7.;
URL: https://eduherald.ru/ru/article/view?id=19060 (дата обращения: 10.10.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).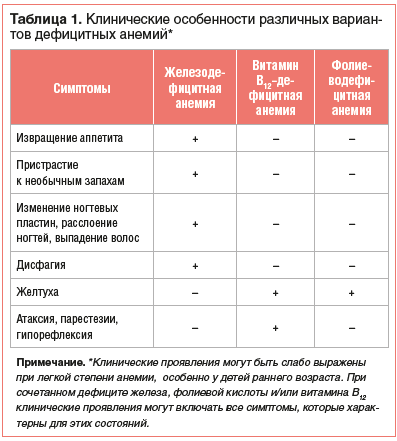
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).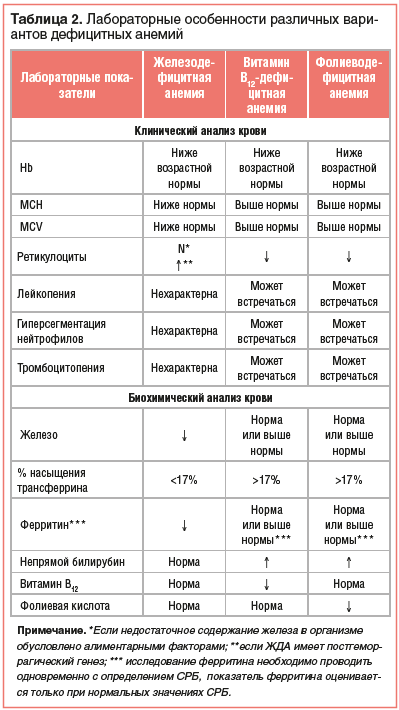
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
