Виды физиологических соединений гемоглобина
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
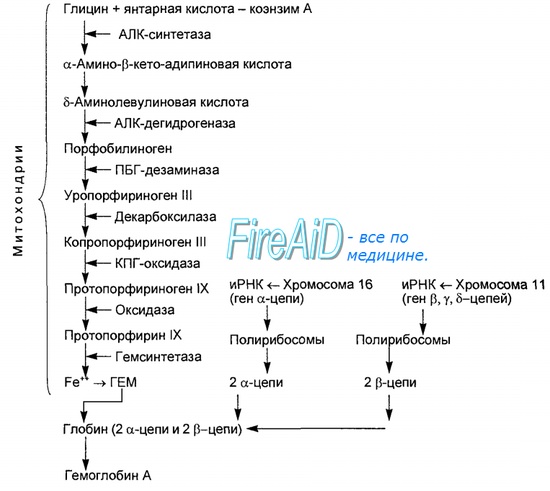
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ГЕМОГЛОБИНА В КРОВИ
Гемоглобин [от греч. haima кровь + globus шар] – кровяной пигмент, содержащийся в эритроцитах и придающий крови красный цвет. Основными функциями гемоглобина является перенос кислорода от легких к тканям и углекислого газа от тканей к легким, а также поддержание постоянной рН крови.
По химическому строению гемоглобин (Hb) относится к сложным белкам – хромопротеинам. Его простетическая группа, включающая двухвалентное железо, называется гемом, а белковый компонент – глобином. Молекула гемоглобина содержит 4 гема и один глобин. Глобин состоит из двух пар полипептидных цепей, которые в зависимости от аминокислотного состава обозначаются как α, β, γ и δ цепи.
Типы гемоглобина различаются структурой полипептидных цепей глобина. Существуют физиологические и патологические типы гемоглобина.
К физиологическим типам гемоглобина относятся гемоглобин А, F и Р.
Hb A – гемоглобин взрослых [от англ. adultвзрослый]. Гемоглобин А состоит из двух α- и двух β-цепей (α2β2). Имеется несколько фракций гемоглобина А: А1, А2, А3. В норме у взрослых фракция А1 является основной и составляет 96-98%, фракция А2 – не превышает 3%, А3 – в виде следов.
Hb F – фетальный гемоглобин [от лат. fetus плод]. Этот тип гемоглобина состоит из α2γ2 цепей и содержится у плода с 3 месяцев. У новорожденных содержание НbF составляет около 20%, остальной гемоглобин представлен НbА. В дальнейшим HbF продолжает уменьшаться и к 4-5 месяцам достигает величин взрослого человека – 1-2%.
Hb P – примитивный гемоглобин, содержится у плода на ранних стадиях эмбрионального развития (до 3-х месяцев).
Патологические типы гемоглобина: B(S), C, D, G и др. возникают в результате изменения аминокислотного состава глобина, обусловленного наследственным дефектом синтеза гемоглобина, и приводят к развитию гемоглобинопатий – тяжелых анемий гемолитического типа. Замена только одной аминокислоты (глютаминовой на валин) превращает HbA в патологический HbS, имеющий структуру α2s2. После отдачи кислорода в тканях HbS образует плохо растворимую форму и кристаллизуется в эритроцитах, вызывая их деформацию – образование серповидных эритроцитов, что приводит к развитию серповидноклеточной анемии.
Соединения гемоглобина бывают физиологические и патологические. К физиологическим соединениям гемоглобина относятся оксигемоглобин (соединение гемоглобина с кислородом), карбогемоглобин (соединение гемоглобина с углекислым газом) и редуцированный (восстановленный) гемоглобин – соединение гемоглобина с молекулой воды.
В легких гемоглобин соединяется с кислородом, образуя оксигемоглобин, который с током артериальной крови разносится ко всем органам и тканям. Здесь оксигемоглобин диссоциирует (распадается) на кислород, который используется клетками для окислительных процессов, и гемоглобин, который присоединяет молекулу воды и становится редуцированным гемоглобином. Свободные валентности редуцированного гемоглобина связывают углекислый газ. Образующийся при этом карбогемоглобин с током венозной крови доставляется в легкие, где он диссоциирует на составные части. Углекислый газ выделяется с выдыхаемым воздухом, а гемоглобин присоединяет новую порцию кислорода и весь процесс повторяется снова.
К патологическим соединениям гемоглобина относятся карбоксигемоглобин, метгемоглобин и сульфгемоглобин. Патологические соединения гемоглобина являются очень стойкими, не способными к диссоциации, поэтому они не могут переносить кислород и при их образовании в организме развивается кислородная недостаточность.
Метгемоглобин – это соединение гемоглобина с кислородом, в котором двухвалентное железо заменено трехвалентным. Образование метгемоглобина происходит при отравлениях амидо- и нитросоединениями бензольного ряда. Специфическим лабораторным признаком образования метгемоглобина является наличие в эритроцитах телец Гейнца.
Карбоксигемоглобин – соединение гемоглобина с угарным газом (СО). Угарный газ является токсичным продуктом неполного сгорания углеродсодержащих веществ. Образование в крови карбоксигемоглобина происходит при несоблюдении санитарно-гигиенических требований и нарушении технологических процессов при доменном и мартеновском производстве, в автогаражах, при печном отоплении, авариях и взрывных работах в шахтах, на пожарах. Сродство гемоглобина к угарному газу в несколько сот раз больше, чем к кислороду, поэтому даже незначительная концентрация (0,07%) в воздухе угарного газа связывает более 50% имеющегося в организме гемоглобина и является смертельной.
Сульфгемоглобин обнаруживается при применении сульфаниламидов и при отравлении соединениями бензольного ряда одновременно с образованием метгемоглобина.
Дата добавления: 2014-11-29; Просмотров: 4481; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
- Алюминий и его соединения. Применение.
- Баланс свободной торговли и протекционизм в контексте присоединения Казахстана к ВТО
- Водородные соединения галогенов. Свойства, применение.
- Выбор норм точности деталей резьбового соединения
- ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (ВМС) И ИХ РАСТВОРЫ
- Высокомолекулярные соединения (ВМС). Основные отличия ВМС от низкомолекулярных веществ. Молекулярная масса полимеров (среднемассовая. среднечисловая), степень полидисперсности.
- Высшие жирные кислоты (ВЖК): строение, конфигурация двойных связей, биологическая роль.
- Галогены и их соединения в быту и технике
- Гетерофункциональные органические соединения (кетокислоты, гидроксикислоты, аминокислоты, аминофенолы, аминоспирты. Привести примеры.
- Гормоны. Определение понятия, строение, физиологические эффекты.
- Диаграммы состояния трехкомпонентной систем с двойными химическими соединениями, плавящуюся конгруэнтно.
- Диоксины и родственные им соединения
Источник

Виды гемоглобина.
Различают три вида гемоглобина; первоначально эмбрион имеет примитивный гемоглобин (HbP) – до 4-5 мес. внутриутробной жизни, затем начинает появляться фетальный гемоглобин (HbF), количество которого увеличивается до 6–7 мес. внутриутробной жизни. С этого срока происходит увеличение гемоглобина А (взрослого) максимальная величина которого достигает к 9 мес. внутриутробной жизни (90%). Количество фетального гемоглобина при рождении является одним из признаков доношенности: чем больше HbF, тем менее доношенный ребенок. Следует отметить, что HbF в присутствии 2,3 дифосфоглицерата (ДФГ – продукт метаболизма оболочки эритроцита при недостатки кислорода) не меняет своего сродства к кислороду в отличии от HbA, сродство которого к кислороду снижается.
Виды Нв отличаются друг от друга по степени химического сродства к О2. Так, НвF в физиологических условиях имеет более высокое сродство к О2, чем НвА. Эта важнейшая особенность НвF создает оптимальные условия для транспорта О2 кровью плода.
Гемоглобин представляет собой кровяной пигмент, роль которого заключается в транспорте кислорода к органам и тканям, транспорте двуокиси углерода от тканей к легким, кроме этого он является внутриклеточным буфером, который поддерживает оптимальную для метаболизма pH. Гемоглобин содержится в эритроцитах и составляет 90% их сухой массы. Вне эритроцитов гемоглобин практически не обнаруживается.
Химически гемоглобин относится к группе хромопротеидов. Его простетическая группа, включающая железо, называется гемом, белковый компонент – глобином. Молекула гемоглобина содержит 4 гема и 1 глобин.
К физиологическим гемоглобинам относятся НЬА (гемоглобин взрослого) и HbF (фетальный гемоглобин, составляющий основную массу гемоглобина плода и исчезающий почти полностью ко 2-му году жизни ребенка). Современными электрофоретическими исследованиями доказано существование по крайней мере двух разновидностей нормального гемоглобина А: А1 (главный) и А2 (медленный). Основную массу гемоглобина взрослого (96-99%) составляет HbAl, содержание других фракций (А2 F) не превышает 1 – 4%. Каждый вид гемоглобина, вернее его глобиновая часть, характеризуется своей «полипептидной формулой». Так, HbAl обозначается как ά2 β2, то есть он состоит из двух ά-цепей и двух β-цепей (всего 574 аминокислотных остатка, расположенных в строго определенном порядке). Другие виды нормальных гемоглобинов – F, A2 обладают общей с HbAl β-пептидной цепью, но отличаются структурой второй полипептидной цепи (например, структурная формула HbF – ά2γ2).
Помимо физиологических гемоглобинов, существуют еще несколько патологических разновидностей гемоглобина. Патологические гемоглобины возникают в результате врожденного, передаваемого по наследству дефекта образования гемоглобина.
В эритроцитах циркулирующей крови гемоглобин находится в состоянии беспрерывной обратимой реакции. Он то
присоединяет молекулу кислорода (в легочных капиллярах), то отдает ее (в тканевых капиллярах).
К основным соединениям гемоглобина относятся: ННв – восстановленный гемоглобин и НвСО2 – соединение с углекислым газом (карбогемоглобин). Они в основном находятся в венозной крови и придают ей темно-вишневый цвет.
НвО2 – оксигемоглобин– находится, в основном, в артериальной крови, придавая ей алый цвет. НвО2 – чрезвычайно нестойкое соединение, его концентрация определяется парциальным давлением О2 (рО2): чем больше рО2, тем больше образуется НвО2 и наоборот. Все вышеперечисленные соединения гемоглобина относятся к физиологическим.
Гемоглобин в венозной крови с низким парциальным давлением кислорода связан с 1 молекулой воды. Такой гемоглобин называется редуцированным (восстановленным) гемоглобином. В артериальной крови с высоким парциальным давлением кислорода гемоглобин соединен с 1 молекулой кислорода и имеет название – оксигемоглобин. Путем непрерывного превращения оксигемоглобина в редуцированный гемоглобин и обратно осуществляется перенос кислорода из легких к тканям. Восприятие углекислоты в тканевых капиллярах и доставка ее в легкие также является функцией гемоглобина. В тканях оксигемоглобин, отдавая кислород, превращается в редуцированный гемоглобин. Кислотные свойства редуцированного гемоглобина в 70 раз слабее свойств оксигемоглобина, поэтому свободные валентности его связывают углекислоту. Таким образом, углекислота доставляется из тканей в легкие с помощью гемоглобина. В легких образующийся оксигемоглобин в силу своих высоких кислотных свойств вступает в связь с щелочными валентностями карбогемоглобина, вытесняя углекислоту. Так как основной функцией гемоглобина является обеспечение тканей кислородом, то при всех состояниях, сопровождающихся снижением концентрации гемоглобина в крови, или при качественных его изменениях развивается гипоксия тканей.
Однако есть и патологические формы гемоглобина.
Гемоглобин обладает способностью вступать в диссоциирующие соединения не только с кислородом и углекислый газом, но и с другими газами. В результате образуются карбоксигемоглобин, оксиазотистый гемоглобинисульфгемоглобин.
Карбоксигемоглобин (оксиуглеродный) диссоциирует в несколько сотен раз медленнее, чем оксигемоглобин, поэтому даже незначительная концентрация (0,07%) в воздухе угарного газа (СО), связывая около 50% имеющегося в организме гемоглобина и лишая его способности переносить кислород, является смертельным. Карбоксигемоглобин (НвСО) – очень прочное соединение с угарным газом, обусловленное химическими свойствами угарного газа по отношению к Нв. Оказалось, что его родство к Нв в 400-500 раз больше, чем сродство О2 к Нв. Поэтому при незначительном повышении концентрации СО в окружающей среде образуется очень большое количество НвСО. Если в организме находится много НвСО, то возникает кислородное голодание. Фактически О2 в крови очень много, а клетки тканей его не получают, т.к. НвСО – прочное соединение с О2.
Метгемоглобин представляет собой более стойкое, чем оксигемоглобин, соединение гемоглобина с кислородом, получающееся при отравлениях некоторыми лекарственными препаратами – фенацетином, антипирином, сульфаниламидами. При этом двухвалентное железо простетической группы, окисляясь, превращается в трехвалентное. Метгемоглобин (MetНв) – окисленная форма Нв, крови придает коричневую окраску. Образуется MetНв при действии на Нв любым окислителями: нитраты, перекиси, перманганат калия, красная кровяная соль и т.д. Это стойкое соединение, потому что железо из ферроформы (Fe++) переходит в ферриформу (Fe+++), необратимо связывающую О2. При образовании в организме больших количеств MetНв также возникает кислородная недостаточность (гипоксия).
Сульфгемоглобин обнаруживается в крови иногда при применении лекарственных веществ (сульфаниламидов). Содержание сульфгемоглобина редко превышает 10%. Сульфгемоглобинемия – необратимый процесс. Так как пораженные эритроциты
разрушаются в те же сроки, что и нормальные, явлений гемолиза не наблюдается и сульфгемоглобин может находиться в крови в течение нескольких месяцев. На этом свойстве сульфгемоглобина основан метод определения сроков пребывания нормальных эритроцитов в периферической крови.
Дата добавления: 2015-11-05; просмотров: 4841 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Источник
