Виды иммунных гемолитических анемий

Иммунные гемолитические анемии – группа заболеваний, обусловленных повышенным разрушением эритроцитов вследствие выработки антител против неизмененных красных кровяных телец или гаптенов, появившихся на мембране эритроцита. Различают изоиммунные, трансиммунные, гетерогенные и аутоиммунные гемолитические анемии. Клинические признаки: бледность или желтушность кожных покровов, умеренное увеличение печени и селезенки, боли в поясничной области, одышка и другие симптомы. Диагностика основана на изучении клинических данных, результатов лабораторных и инструментальных исследований. Лечение: гемотрансфузии, введение препаратов крови и кортикостероидов, иногда – спленэктомия.
Общие сведения
Иммунные гемолитические анемии – группа заболеваний, характеризующихся повреждением и преждевременной гибелью эритроцитов или эритрокариоцитов в связи с развитием иммунной реакции с участием IgG и IgM или иммунных лимфоцитов. Основные факторы, вызывающие разрушение эритроцитов – аутоиммунный процесс, гемотрансфузионные осложнения, эритробластоз плода и гемолиз, обусловленный действием некоторых лекарственных средств.
Гемолиз может происходить в самом кровеносном русле или вне сосудов: в печени, селезенке, костном мозге. В результате массовой гибели красных кровяных телец развиваются анемический и желтушный синдромы, свидетельствующие о нарушении функции печени, почек, дыхательной системы, системы кровообращения, других органов и систем организма. По данным статистики, распространенность иммунных гемолитических анемий составляет примерно 1 случай на 70-80 тысяч населения.
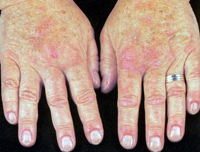
Иммунные гемолитические анемии
Причины иммунных гемолитических анемий
Возникновение этой группы заболеваний связано с воздействием различных неблагоприятных факторов внешней и внутренней среды, приводящих к развитию иммунных реакций против собственных эритроцитов. Чаще всего встречается аутоиммунный механизм, при котором происходит выработка антител против неизмененных естественных антигенов мембраны эритроцитов, находящихся в кровяном русле, или их предшественников – эритрокариоцитов костного мозга. Первичный причинный фактор, вызывающий разрушение эритроцитов, неизвестен (идиопатическая форма).
При вторичных анемиях патологический процесс развивается на фоне хронического лимфолейкоза, лимфомы, антифосфолипидного синдрома или иммунодефицитных состояний. Чаще встречается тепловая форма аутоиммунной анемии, при которой внутренняя среда организма имеет нормальные температурные параметры, а на эритроцитах располагаются иммуноглобулины класса G и компоненты комплемента C3 и C4. Красные кровяные тельца разрушаются макрофагами в печени и селезенке. Менее распространенная холодовая форма может быть идиопатической или вторичной, связанной с инфекцией (инфекционным мононуклеозом и микоплазменной пневмонией), переохлаждением и лимфопролиферативными заболеваниями у больных старше 60 лет. Реакция антиген-антитело с гемолизом развивается в периферическом кровяном русле, где температура опускается ниже 32 градусов.
Иммунная гемолитическая анемия может возникать при фиксации на мембране эритроцита фрагмента, имеющего лекарственное, вирусное или бактериальное происхождение (гетероиммунная форма). Образовавшиеся гаптены превращают красные кровяные тельца в чужеродные клетки-мишени для иммунной системы, что в итоге приводит к гемолизу. Чаще всего такую реакцию вызывают антибиотики из группы пенициллинов, цефалоспоринов и тетрациклинов, противотуберкулезные препараты, анальгетики и антиаритмические средства.
Изоиммунная форма встречается при несовместимости крови матери и плода по группе крови или резус-фактору. При этом антиэритроцитарные антитела матери через плаценту проникают к плоду и вызывают разрушение эритроцитов. Подобный механизм наблюдается и при переливании (гемотрансфузии) несовместимой крови от донора пациенту.
Классификация иммунных гемолитических анемий
Выделяют изоиммунные, трансиммунные, гетерогенные и аутоиммунные гемолитические анемии.
- К изоиммунным вариантам заболевания относятся посттрансфузионные осложнения, связанные с непереносимостью крови донора или неправильным соблюдением процедуры трансфузии, а также гемолитическая болезнь новорожденных.
- При трансиммунных анемиях гемолиз возникает при попадании к плоду через плаценту антител от матери, болеющей аутоиммунной анемией.
- Гетероиммунная (гаптеновая) анемия – результат изменения мембраны эритроцита при воздействии вирусов или лекарственных препаратов.
- Аутоиммунные гемолитические анемии (с тепловыми и холодовыми агглютининами).
Симптомы иммунных гемолитических анемий
Болезнь чаще начинается остро: повышается температура тела, появляется озноб, головная боль и головокружение, одышка, боли в эпигастральной области и пояснице. Кожные покровы становятся бледными, затем желтушными, могут появиться геморрагии, увеличивается селезенка, печень, цвет мочи становится темным.
При холодовой форме иммунной гемолитической анемии нередко нарушается периферическое кровообращение с развитием синдрома Рейно, посинением и отечностью кожных покровов кистей рук, лица, ушных раковин. В некоторых случаях нарушение кровоснабжения тканей конечностей может привести к развитию гангрены пальцев стоп.
Тяжелое течение эритробластоза плода характеризуется развитием ядерной желтухи с поражением центральной нервной системы – билирубиновой энцефалопатии. При этом отмечается вялость, заторможенность, снижение аппетита, частые срыгивания, судорожный синдром. При пальпации обнаруживают увеличение селезенки, печени, периферических лимфоузлов.
Диагностика иммунных гемолитических анемий
Чтобы установить правильный диагноз, определить форму заболевания, необходимо тщательное обследование пациента со сбором анамнеза, проведением клинического физикального осмотра врачом-гематологом, аллергологом-иммунологом, инфекционистом, ревматологом и другими специалистами. Уже на этапе осмотра можно обнаружить бледность, желтушность кожных покровов и слизистых, пропальпировать увеличенную селезенку и печень. Выраженность спленомегалии и гепатомегалии уточняется при проведении ультразвукового исследования (УЗИ печени и селезенки).
Лабораторная диагностика подтверждает наличие нормо- или гипохромной (реже – гиперхромной) анемии, ретикулоцитоза, увеличение СОЭ, гипербилирубинемию. В анализе мочи может выявляться протеинурия, уробилинемия, гемоглобинурия. При исследовании пунктата костного мозга обнаруживаются признаки гиперплазии за счет активации эритропоэза. При гемолитической болезни новорожденных выявляется выраженный эритробластоз (100-150 тысяч в 1 мкл).
Диагноз аутоиммунной гемолитической анемии подтверждается положительной прямой пробой Кумбса (прямым антиглобулиновым тестом) или полибреновым тестом (сенсибилизированная проба Кумбса). Дифференциальная диагностика проводится с другими иммунными болезнями, различными формами анемий, гемобластозами, тяжелыми отравлениями, болезнями печени и почек.
Лечение иммунных гемолитических анемий
Лечебная тактика различается при различных формах болезни. При аутоиммунном характере гемолиза с тепловыми антигенами проводится введение высоких доз иммуноглобулина, кортикостероидов, иногда – циклофосфамида и других иммуносупрессивных препаратов. Возможно применение плазмафереза. При неэффективности консервативной терапии рекомендуется проведение спленэктомии. При холодовой иммунной гемолитической анемии используется введение моноклональных антител (ритуксимаба), плазмаферез, трансфузия индивидуально подобранных, отмытых и подогретых эритроцитов.
При эритробластозе плода проводится дезинтоксикационная терапия, переливание крови или эритроцитарной массы. При пострансфузионных осложнениях необходимо проведение неотложных противошоковых мероприятий, борьба с синдромом диссеминированного внутрисосудистого свертывания.
В зависимости от природы антител выделяют 4 варианта иммунной гемолитической анемии: аллоиммунные (изоиммунные), трансиммунные, гетероиммунные (гаптеновые), аутоиммунные.
Изоиммунные гемолитические анемии
Отмечаются в случаях антигенной несовместимости генов матери и плода (гемолитическая болезнь новорожденных) или при попадании несовместимых по групповым антигенам эритроцитов (переливание несовместимой крови), что приводит к реакции сыворотки донора с эритроцитами реципиента.
Гемолитическая болезнь новорожденных чаще всего связана с несовместимостью крови матери и плода по антигену RhD, реже по антигенам А В О, еще реже по антигенам с, С, Kell и другим. Антитела, проникающие через плаценту, фиксируются на эритроцитах плода и затем элиминируются макрофагами. Развивается внутриклеточный гемолиз с образованием непрямого билирубина, токсичного для ЦНС, с компенсаторным эритробластозом, образованием экстрамедуллярных очагов кроветворения.
Иммунизация матери происходит в результате кровотечения от матери к плоду в объеме 0,25 мл и больше, не менее чем в 15 % случаев первых родов у резус-отрицательных матерей. Частота гемолитической болезни новорожденных увеличивается при акушерских вмешательствах и патологии плаценты. Повторные роды, особенно с коротким интервалом между иммунизирующей и следующей беременностью, а также предшествующие аборты при относительно больших сроках (10-14 нед) увеличивают вероятность сенсибилизации и, следовательно, развития гемолитической болезни. Защитный эффект по отношению к резус-конфликту оказывает несовместимость крови матери и плода по АВО-системе вследствие деструкции фетальных клеток материнскими антителами к А- и В-антигенам.
К мерам профилактики резус-сенсибилизации относится определение антирезусных антител у сенсибилизированной женщины в динамике беременности на 20-й, 28-й и 36-й неделях и во время родов. Это необходимо для решения вопроса о профилактическом введении антирезус-иммуноглобулина – анти-D IgG – после родов. В случаях риска внутриутробного поражения плода (титр антител более 1 : 8 в непрямой пробе Кумбса) показан амниоцентез с определением содержания билирубина и последующим выбором тактики ведения. Эффективным является введение сенсибилизированной женщине анти-D IgG на 28 – 36 – й неделях беременности.
Наиболее перспективным является профилактическое введение анти-D IgG в дозе 200-500 мкг в первые 36-72 ч после родов. При этом наблюдается подавление продукции специфических антител при повторной беременности, снижение частоты гемолитической болезни новорожденных более чем на 10 %. Показанием для введения иммуноглобулина является рождение у резус-отрицательной первородящей женщины резус-положительного ребенка, совместимого с кровью матери по системе AB0.
Трансиммунная гемолитическая анемия
Обусловлена трансплацентарной передачей антител от матерей, страдающих аутоиммунными гемолитическими анемиями; антитела направлены против общего антигена эритроцитов как матери, так и ребенка. Трансиммунная гемолитическая анемия у новорожденных требует систематического лечения с учетом периода полураспада материнских антител (IgG) в 28 дней. Применение глюкокортикоидов не показано.
Гетероиммунная гемолитическая анемия
Связана с фиксацией на поверхности эритроцита гаптена лекарственного, вирусного, бактериального происхождения. Эритроцит является случайной клеткой-мишенью, на которой происходит реакция гаптен-антитело (организм вырабатывает антитела против «чужих» антигенов). В 20 % случаев при иммунном гемолизе может быть выявлена роль лекарственных препаратов. Ряд лекарств, таких как пенициллин и цефалоспорины, прикрепляется к мембране эритроцита, меняя при этом его антигенные свойства, что приводит к выработке антител, направленных против комплекса эритроцит-лекарственный препарат. Другие лекарственные препараты, такие как фенацетин, сульфаниламиды, тетрациклин, ПАСК, изониазид, гидрохлортиазид, хинин и хинидин, образуют тройные иммунные комплексы (Fab-фрагмент IgG – препарат – белок мембраны эритроцита), вызывающие разрушение эритроцита. Антитело и лекарственный препарат образуют иммунные комплексы, связывающиеся неспецифически с белками мембраны эритроцитов, и активируют комплемент. Антитело направлено как против лекарственного препарата, так и против мембранного белка. Альфа-метилдопа, леводопа, прокаинамид, ибупрофен, диклофенак, тиоридизин, а-интерферон вызывают образование антител, направленных против мембраны белков эритроцита, а не против лекарственного препарата. Установлено, что положительная прямая проба Кумбса наблюдается у 10-20 % больных, получающих альфа-метилдопу, но гемолиз отмечается только у 2-5 %. Цефалотин вызывает неспецифическое связывание белков плазмы (включая IgG, белки комплемента, трансферрин, альбумин и фибриноген) с эритроцитарной мембраной. Проба Кумбса положительна, но гемолиз бывает редко.
Гетероиммунные гемолитические анемии близки по клинической картине к аутоиммунным гемолитическим анемиям с неполными тепловыми агглютининами. Прогноз благоприятен, лечебный эффект достигается элиминацией гаптена, например, отменой лекарственного препарата, санацией инфекции. Применение глюкокортикоидов возможно и обусловлено тяжестью анемии. Гемотрансфузионная терапия не показана в связи с тяжестью изоиммунизации.
Аутоиммунные гемолитические анемии
При данном варианте гемолитической анемии в организме больного вырабатываются антитела, направленные против собственных неизмененных антигенов эритроцитов. Встречаются в любом возрасте.
В зависимости от клеточной направленности антител выделяют аутоиммунную гемолитическую анемию с антителами к антигену эритрокариоцитов костного мозга и аутоиммунную гемолитическую анемию с антителами к антигену эритроцитов периферической крови.
Аутоиммунная гемолитическая анемия, сопровождающие основной патологический процесс – лимфопролиферативные заболевания ( хронический лимфолейкоз, лимфому), системные заболевания соединительной ткани (системную красную волчанку, антифосфолипидный синдром) или иммунодефицитные состояния, рассматриваются в качестве вторичных или симптоматических. Если причину возникновения аутоиммунной гемолитической анемии установить не удается, говорят об идиопатической аутоиммунной гемолитической анемии.
Аутоиммунные гемолитические анемии классифицируют в зависимости от характеристик опосредующих их аутоантител: температуры, при которой антитела реагируют с эритроцитами, и способности вызывать их агглютинацию и гемолиз. Тепловыми называют антитела, связывающие эритроциты при температуре 36 °С, Холодовыми – реагирующие с эритроцитами при температуре не более 26 °С. Антитела, на холоде связывающиеся с эритроцитами, а в тепле – вызывающие гемолиз, называют двухфазными. Если антитела способны только агглютинировать эритроциты, то их называют агглютининами (полными или неполными), если они активируют комплемент и вызывают внутрисосудистый гемолиз, то речь идёт о гемолизинах.
Согласно указанным признакам, выделяют следующие виды аутоиммунной гемолитической анемии:
- с неполными тепловыми агглютининами;
- пароксизмальную холодовую гемоглобинурию (аутоиммунная гемолитическая анемия с двухфазными гемолизинами Доната-Ландштейнера);
- с полными Холодовыми агглютининами.
Изредка тепловые агглютинины могут быть полными и принадлежать к классу IgM. Описаны также случаи комбинированных аутоиммунных гемолитических анемий с тепловыми и Холодовыми антителами, в частности, после инфекционного мононуклеоза, когда вирус Эпстайна-Барр активирует огромный пул В-лимфоцитов, продуцирующих широкий спектр антител.
По этиологии аутоиммунные гемолитические анемии могут быть идиопатическими или вторичными по отношению к инфекциям, иммунодефицитным синдромам, аутоиммунным заболеваниям, лимфопролиферативным синдромам [хронический лимфоцитарный лейкоз (ХЛЛ), лимфомы], опухолям, экспозиции к медикаментам.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Содержание
- Гемолитическая анемия
- Классификация гемолитических анемий
- Причины гемолитических анемий
- Симптомы гемолитических анемий
- Наследственные мембранопатии, ферментопении и гемоглобинопатии
- Приобретенные гемолитические анемии
- Диагностика гемолитических анемий
- Лечение гемолитических анемий
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для гемолитических анемий типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения гемолитической анемии используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Гемолитическая анемия
Гемолитическая анемия — анемия, обусловленная нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Группа гемолитических анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных группах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. При гемолитической анемии жизненный цикл эритроцитов укорочен и их распад (гемолиз) происходит раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Классификация гемолитических анемий
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные.
Наследственные гемолитические анемии включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – гемолитические анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – гемолитические анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — гемолитические анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные гемолитические анемии подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные анемии) – обусловлены воздействием антител
- токсические – гемолитические анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- гемолитические анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Причины гемолитических анемий
Патогенетическую основу наследственных гемолитических анемий составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфо-функциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды.
Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода, прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков). Аутоиммунные реакции с образованием антител, агглютинирующих эритроциты, возможны при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе, миеломной болезни), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии).
В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Механическое повреждение и гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Центральным звеном патогенеза гемолитических анемий является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. Эти процессы сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Симптомы гемолитических анемий
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы гемолитических анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке.
Манифестация микросфероцитарной гемолитической анемии возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитарной гемолитической анемии во всех случаях увеличена селезенка, а у половины пациентов – еще и печень.
Кроме наследственной микросфероцитарной гемолитической анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические гемолитические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет.
Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных вариантов приобретенных гемолитических анемий чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер.
Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка.
При некоторых формах аутоиммунных гемолитических анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические гемолитические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия.
Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Диагностика гемолитических анемий
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки.
Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. При аутоиммунных гемолитических анемиях большое диагностическое значение имеет положительная проба Кумбса. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, гемобластозы.
Лечение гемолитических анемий
Различные формы гемолитической анемии имеют свои особенности и подходы к лечению. При всех формах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной гемолитической анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной гемолитической анемии выполняется спленэктомия.
Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов. При развитии почечной недостаточности прогноз неблагоприятен.
