Врожденная апластическая анемия фанкони

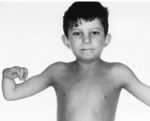
Анемия Фанкони – это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения – пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
Общие сведения
Синонимичные названия анемии Фанкони – врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие – 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
Анемия Фанкони
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена – 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга – неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом – злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
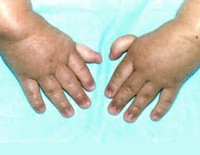
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования – лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних – панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень – 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ клеток. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% – в аллели FANCC, в 10% – в генах FANCG. Частота мутаций в других парах – 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток – в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ. Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции – до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста – эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты – донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.
Конституциональная апластическая анемия (анемия Фанкони)
Протекает с угнетением всех ростков гемопоэза и врожденными аномалиями развития. Описано не менее 900 случаев анемии Фанкони. Наследуется по аутосомно-рецессивному типу, встречаются семейные формы заболевания — у братьев и сестер. Установлено, что группа больных с анемией Фанкони неоднородна в генетическом отношении — выделяют как минимум 5 различных групп (так называемые группы комплементации) — А, В, С, F, Е, для 3 из которых определена локализация генного дефекта и для 2 идентифицирован специфический протеин.
Заболевание чаще всего диагностируется в возрасте 4-12 лет, когда появляется гематологическая симптоматика, однако у некоторых больных может отмечаться уже при рождении.
Клинически характерны задержка внутриутробного развития, снижение массы тела (
Костный возраст отстает на 2-5 лет от паспортного. Наиболее типичны для больных врожденные аномалии развития: микроцефалия, микрофтальмия, косоглазие, эпикант, гипертелоризм, аплазия или гипоплазия большого пальца кисти и I метакарпальной кости, отсутствие лучевой кости, лучелоктевой синостоз, косорукость, синдактилия, гипоплазия тазобедренных суставов, аномалии развития ребер, врожденные пороки сердца, врожденные аномалии мочевых путей и почек, снижение слуха. Около 10-33 % пациентов не имеют врожденных пороков развития. Отмечается бронзовокоричневая пигментация кожи (за счет отложения меланина в клетках базального слоя эпидермиса), диффузная, усиливающаяся в местах естественных складок, и пятна «кофе с молоком». Часто наблюдаются трофические нарушения кожи, ногтей, зубов. Часты «простудные» заболевания. У некоторых больных имеются изменения ЦНС в виде замкнутости, «психической инфантильности», реже дебильности. Родители жалуются на бледность ребенка с рождения, постоянно сниженный аппетит, позднее дети отмечают головную боль, слабость, снижение толерантности к физическим нагрузкам. Печень и селезенка не увеличены.
Появление гематологических изменений чаще всего регистрируется в возрасте 4-12 лет, у мальчиков появление гематологических изменений обычно регистрируется раньше, чем у девочек. Средний возраст дебюта панцитопении у мальчиков составляет 7,9 лет (от 0 до 32 лет), у девочек – 9 лет (0-48 лет) [Young N. S. et al., 1994]. Нередко первым появляется геморрагический синдром, обусловленный тромбоцитопенией, в виде спонтанных экхимозов и петехиальной сыпи, периодических носовых кровотечений, затем присоединяются прогрессирующая анемия и лейкопения. Заболевание может начаться и с изолированной лейкопении или анемии либо одновременное начало с анемии и тромбоцитопении.
В периферической крови отмечается панцитопения. Анемия нормохромная, характерен анизоцитоз с тенденцией к макроцитозу, умеренный пойкилоцитоз. Ретикулоциты исходно достигают 2-2,5 %, по мере прогрессирования заболевания ретикулоцитоз снижается. Лейкопения стойкая и достигает наибольшей выраженности в терминальном периоде (гранулоциты составляют до 0,1 х 109/л). Тромбоцитопения по мере прогрессирования заболевания достигает значительной степени (до единичных тромбоцитов в мазке). СОЭ, как правило, увеличена.
При анемии Фанкони имеется стресс-эритропоэз, который характеризуется макроцитозом, высоким уровнем Нb Б, высоким уровнем эритропоэтина в сыворотке и наличием ьантигена.
Стернальный пунктат на ранних стадиях заболевания нормо- или гипоклеточный.
Количество бластов в пределах нормы. Содержание клеток эритроидного ростка увеличено с задержкой их созревания и морфологическими нарушениями в виде анизоцитоза, базофильной пунктации в нормобластах, иногда отмечается появление мегалобластов. Гранулоцитарный росток «сужен», возможна задержка созревания на стадии неитрофильных миелоцитов и метамиелоцитов. Мегакариоцитарный росток значительно «сужен» уже на ранних стадиях заболевания. По мере прогрессирования заболевания отмечается выраженная гипоклеточность костного мозга с угнетением всех ростков и разрастанием жировой ткани. В костном мозге увеличено число ретикулярных, плазматических и тучных клеток. Гипоплазия костного мозга подтверждается результатами трепанобиопсии.
Из биохимических показателей для АА характерно повышение уровня фетального гемоглобина до 15 % (при норме 2 %) еще до развития цитопении, по мере прогрессирования аплазии фетальный гемоглобин достигает 45 %.
Установлено, что клетки больных с анемией Фанкони не способны репарировать поперечные сшивки ДНК, вызываемые так называемыми кластогенами — диэпоксибутаном, митомицином С и др. На этом феномене основана современная диагностика анемии Фанкони и у всех больных с подозрением на анемию Фанкони должен проводиться тест с диэпоксибутаном.
Течение анемии Фанкони характеризуется наличием периодов обострения и ремиссии. Без лечения через 2 года после диагностики панцитопении умирают 80 % больных, а через 4 года – около 100 % [Young N. S. et al., 1994]. Причиной смерти, наряду с тяжелой анемией, являются наиболее серьезные проявления геморрагического синдрома — желудочно-кишечные кровотечения, внутричерепные кровоизлияния и присоединение различных инфекций.
У больных анемией Фанкони имеется высокий риск трансформации в миелодиспластический синдром, острый лейкоз (особенно миелобластный или монобластный), злокачественные опухоли ЖКТ.
Наследственная апластическая анемия с общим поражением гемопоэза без врожденных аномалий развития (анемия Эстрена—Дамешека)
Является тотальной формой наследственной апластической анемии, наследуется аутосомно-рецессивно, протекает с панцитопенией, не сопровождается врожденными пороками развития. Заболевание встречается крайне редко, гематологические нарушения отмечаются в раннем детском возрасте. Прогноз неблагоприятный.
Врожденный дискератоз (синдром Цинссера—Коула—Энгмана)
Синдром характеризуется признаками эктодермальной дисплазии (патологическое ороговение отдельные клеток шиповатого слоя эпидермиса кожи и слизистых оболочек) в сочетании с гематологическими изменениями (примерно у 50 % больных развивается АА). В 75 % случаев синдром наследуется рецессивно сцепленно с Х-хромосомой и, соответственно, встречается у мальчиков; у 25 % детей больных наследуется по аутосомно-доминантному типу (описано примерно одинаковое количество больных). Поражаются кожа и ее дериваты, слизистые оболочки. Наблюдаются множественный рассеянный гиперкератоз с преимущественной локализацией на лице, шее, спине, груди; атрофия кожи ладоней и ступней, ладонно-подошвенный гипергидроз; нарушение роста и дистрофия ногтей; гипотрихоз ресниц; закупорка слезных канальцев и слезотечение; лейкоплакия слизистых полости рта, в основном языка и десен; поражение эндокринных желез (нанизм, недоразвитие вторичных половых признаков). Гематологические изменения разнообразны: панцитопения, изолированная анемия, тромбоцитопения, нейтропения. Возраст дебюта АА при данном синдроме может быть весьма вариабелен, средний возраст дебюта АА составляет 15 лет [Масчан А.
А. и соавт., 1997].
В отличие от больных с анемией Фанкони клетки больных с врожденным дискератозом не обладают повышенной чувствительностью к антигенам, вызывающим поперечные сшивки, поэтому эти иногда фенотипически похожие синдромы могут быть дифференцированы на основании теста с диэпоксибутаном.
Синдром Швахмана—Даймонда
Характеризуется экзокринной недостаточностью поджелудочной железы, карликовостью, метафизарной хондродисплазией, нейтропенией, иногда анемией, тромбоцитопенией. Наследуется аутосомно-доминантно.
Заболевание клинически проявляется в раннем возрасте и характеризуется признаками поражения ЖКТ и гематологическими изменениями. Отмечаются диарея, стеаторея, замедление весовых прибавок, гипотрофия. Характерны изменения костной системы в виде хондроднсплазии метафиза и формирование ортопедической патологии, задержка роста. У части больных возможна галактоземия, что приводит к гепатоспленомегалии, задержке психомоторного развития. Характерны рецидивирующие респираторные заболевания, отиты, абсцессы, остеомиелит. У некоторых детей наблюдается задержка наступления пубертатного периода.
В анализах крови с раннего возраста отмечается абсолютная нейтропения, число нейтрофилов менее 1 х 109/л. Для зрелых нейтрофилов характерна гипосегментация ядер, отмечается снижение хемотаксиса нейтрофилов. Наряду с нейтропенией приблизительно у 50 % больных отмечается анемия с ретикулоцитопенией, у 60-70 % детей — тромбоцитопения, примерно у 25% больных развивается АА. В стернальном пунктате число миелокариоцитов может быть нормальным, сниженным или повышенным; отмечается задержка созревания нейтрофилов на стадии метамиелоцита. Прогноз наиболее неблагоприятный в раннем детском возрасте, когда около 25% детей погибают от инфекционных осложнений; летальный исход возможен и от кровоизлияний в жизненно важные органы.
Наследственная апластическая анемия с избирательным поражением эритропоэза (анемия Блекфена—Даймонда)
Частота данного заболевания составляет 1:1 000 000 живых новорожденных; 5—7:1 000 000 во Франции [Ball S. et al., 19951, 10:1 000 000 в Скандинавии [Wranne L.,1992], встречается во всех этнических группах, мальчики и девочки заболевают одинаково часто. Подавляющее большинство (75 %) составляют спорадические случаи заболевания; в некоторых случаях возможно аутосомно-доминантное наследование, аутосомно-рецессивное или сцепленное с Х-хромосомой.
Первые признаки болезни выявляются в первые месяцы или на протяжении первого года жизни — у 35 % больных анемией при рождении, у 65 % в первые 6 месяцев жизни и в 90 % случаев заболевание диагностируется до года. Диагноз анемии Блекфена — Даймонда у детей старше 2 лет маловероятен. Дети, как правило, рождаются доношенными с нормальной массой тела и ростом, психомоторное развитие нормальное. Бледность кожи и слизистых отмечается с первых дней жизни, но явные клинические признаки гипоксии: вялость или возбуждение, беспокойство, сонливость, отказ от еды, диспепсические явления — появляются при снижении гемоглобина до 60-30 г/л. Врожденные пороки развития встречаются реже (в 25 % случаев), чем при анемии Фанкони. Некоторые больные имеют характерные фенотипические особенности: волосы цвета пакли, курносый нос, большая верхняя губа, гипертелоризм. По мере прогрессирования заболевания кожа приобретает восковидный, а к 5-6 годам, в связи с развитием гемосидероза, — сероватый оттенок, особенно в области шейных, подмышечных, паховых складок, половых органов. Геморрагический синдром отсутствует. Наблюдаются гепатомегалия, спленомегалия, в динамике заболевания селезенка сокращается, а печень прогрессивно увеличивается. Костный возраст отстает от паспортного на 4-5 лет, темпы окостенения изменены. Смена молочных зубов запаздывает, часто выявляется кариес.
В периферической крови нормохромная макроцитарная гипо- или арегенераторная анемия (ретикулоциты 0-0,1 %), как правило, тяжелой степени. Число лейкоцитов и тромбоцитов остается на нормальном уровне в течение первых лет жизни; иногда отмечается тенденция к тромбоцитозу. При длительном течении заболевания может развиваться умеренная тромбоцитопения. После первого десятилетия жизни может также появиться умеренная нейтропения, вероятно, из-за снижения клональной эффективности предшественников гранулоцитов.
Биохимически отмечается высокий уровень активности эритроцитарной аденозиндезаминазы; уровень фетального гемоглобина нормальный или умеренно повышен; повышено содержание ьантигена в эритроцитах; увеличено содержание эритропоэтина в сыворотке.
В стернальном пунктате костный мозг нормоклеточный, по мере прогрессирования заболевания отмечается гипоклеточность. Эритроидный росток резко сужен; диагностическим критерием является отсутствие или малое количество эритробластов (менее 5 % ядросодержащих клеток) в костном мозге. Миелоидный и мегакариоцитарный ростки не изменены. Число ретикулярных клеток и лимфоцитов увеличено, плазматических клеток не изменено.
Анемия Блекфена—Даймонда протекает хронически, у 80 % больных получают ремиссию при использовании кортикостероидов; у 20 % больных описана спонтанная ремиссия. «Постоянная гипоксия, нарушение утилизации железа, необходимость по жизненным показаниям трансфузии эритроцитарной массы неуклонно ведут к гемосидерозу, который в дальнейшем является “убийцей” больного ребенка» [М. Л. Уиллоуби, 1981]. Возможна трансформация в миелодиспластический синдром, острый лейкоз (лимфобластный, миелобластный, промиелоцитарный, мегакариоцитарный), солидные опухоли (гепатобластому, рстеосаркому, злокачественную фиброзную гистиоцитому), лимфогранулематоз.
Дифференциальный диагноз
Дифференциальный диагноз при анемии Блекфена —Даймонда проводится с другими видами анемий, при которых в периферической крови уменьшается количество ретикулоцитов.
Анемия в период выздоровления после гемолитической болезни новорожденных
Иногда может сочетаться со снижением интенсивности эритропоэза. Апластические кризы, характеризующиеся ретикулоцитопенией и уменьшением числа предшественников эритроцитов, могут осложнять разные типы гемолитической болезни. Подобные эпизоды являются транзиторными, кроме того, обычно выявляются признаки предшествующей гемолитической болезни. Развитие апластических кризов связывают с В19-парвовирусной инфекцией. Тактика ведения больных, как правило, выжидательная: при значительном снижении уровня НЬ проводятся гемотрансфузии.
Транзиторная эритробластопения детского возраста
Одна из наиболее частых форм аплазии эритроидного ростка. Этиология заболевания не известна. У здоровых ранее детей в возрасте 5 мес — 6 лет, чаще всего в возрасте 2 лет, медленно развивается тяжелая арегенераторная анемия, обусловленная резким снижением эритроцитов в костном мозге.
Развитию анемии за 1—2 мес может предшествовать вирусная инфекция, хотя связь заболевания с определенным возбудителем не доказана, нередко им является парвовирус В19. Анамнез и физикальное исследование неинформативны, обращает на себя внимание лишь выраженная бледность кожных покровов и слизистых. В периферической крови уровень НЬ снижен до 30-80 г/л, ретикулоциты отсутствуют, количество лейкоцитов и тромбоцитов обычно нормальное, однако у 10 % больных имеется нейтропения (
Дифференциальный диагноз транзиторной эритробластопении и анемии Блекфена—Даймонда
[Lanskowsку Р., 20001

Дифференциальный диагноз транзиторной эритробластопении и анемии Блекфена —Даймонда представлен в табл. 30.
Вторичные (приобретенные) аплазии эритроидного ростка
Также проявляются анемией, сопровождающейся ретикулоцитопенией и уменьшением количества предшественников эритроцитов в костном мозге. Вторичная аплазия эритроидного ростка может быть вызвана вирусными инфекциями (паротит, вирус Эпштейна —Барр, парвовирус В19), атипичными пневмониями и бактериальным сепсисом; лекарственными средствами (хлорамфеникол, пенициллин, фенобарбитал, дифенилгидантоин); антиэритроцитарными антителами; иммунодефицитом; тимомой; злокачественными опухолями.
Эпизоды острой недостаточности эритропоэза могут сопровождать целый ряд вирусных инфекций. При этом значительно снижается количество циркулирующих ретикулоцитов (менее 0,1 %) и повышается уровень железа в сыворотке. В костном мозге уменьшено число предшественников эритроцитов. Эти эпизоды, как правило, купируются и не оставляют каких-либо последствий. Наиболее часто вторичная аплазия эритроидного ростка вызывается парвовирусом В19.
У всех больных грудного возраста при диагностике эритробластопении необходимы следующие исследования [ ВиллингТ. Н. и др., 1998]:
1. Содержание сывороточных антител IgМ и IgG (мать и ребенок).
2. Вирусной ДНК в сыворотке крови.
3. Вирусной ДНК в костном мозге.
Эти исследования могут помочь в дифференциации эритробластопении при инфицировании парвовирусом В19 и эритробластопении другого генеза.
В терапии вторичных эритробластопении важно устранение причины, вызвавшей заболевание — отмена препарата, лечение основного заболевания или тимэктомия. При обнаружении антиэритроидных антител показаны кортикостероиды, при их неэффективности — иммунодепрессанты (циклофосфан или азатиоприн). При иммунодефиците парвовирусная инфекция может быть хронической, тогда применяют иммуноглобулин внутривенно.
Еще по теме Врожденные апластические анемии:
- АНЕМИИ ВСЛЕДСТВИЕ ОПУСТОШЕНИЯ КОСТНОГО МОЗГА, ГИПО- И АПЛАСТИЧЕСКИЕ АНЕМИИ. МИЕЛО-АПЛАСТИЧЕСКИЙ СИНДРОМ
- ВРОЖДЕННЫЕ ГИПО- И АПЛАСТИЧЕСКИЕ АНЕМИИ
- ПРИОБРЕТЕННЫЕ ГИПО-АПЛАСТИЧЕСКИЕ АНЕМИИ
- Гипо- и апластические анемии
- Апластические анемии
- Апластические и гипопластические анемии
- АПЛАСТИЧЕСКИЕ ( ГИПОПЛАСТИЧЕСКИЕ ) АНЕМИИ
- Приобретенные апластические анемии
- Гипо- и апластические анемии. Синдром костно-мозговой недостаточности
- Лечение врожденных форм апластических анемий
- ВРОЖДЕННЫЕ (НАСЛЕДСТВЕННЫЕ) СИДЕРОАХРЕСТИЧЕСКИЕ АНЕМИИ
- Врождённые гемолитические анемии
- ХРОНИЧЕСКИЕ ЭНЗИМОДЕФИЦИТНЫЕ («НЕСФЕРОЦИТАРНЫЕ») ВРОЖДЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ
- ВРОЖДЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ ГЕНЕТИЧЕСКИМИ (НАСЛЕДСТВЕННО-СЕМЕЙНЫМИ) ФАКТОРАМИ
- Классификация апластических анемий
- АНЕМИИ ВСЛЕДСТВИЕ ТОКСИЧЕСКОГО УГНЕТЕНИЯ КОСТНОГО МОЗГА (МИЕЛОТОКСИЧЕСКИЕ АНЕМИИ)
- АНЕМИИ ПРИ СОСТОЯНИЯХ ФУНКЦИОНАЛЬНОЙ АГАСТРИИ (АГАСТРАЛЬНЫЕ АНЕМИИ)
- Анемии, связанные с нарушением синтеза ДНК и РНК (мегалобластные анемии)
- АПЛАСТИЧЕСКАЯ (ГИПОПЛАСТИЧЕСКАЯ) АНЕМИЯ
- Гипопластнческая (апластическая) анемия
