Врожденные гемолитические анемии патогенез

Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Общие сведения
Гемолитическая анемия (ГА) – малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Гемолитическая анемия
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Гемолитическая анемия
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии – анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические – анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом – обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще – Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий – талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Аутоиммунная гемолитическая анемия
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
Наледственный микросфероцитоз (болезнь Минковского – Шоффара)
Этиология и патогенез
В основе заболевания лежит генетический дефект белка мембраны эритроцита. Имеющаяся аномалия мембраны приводит к проникновению в эритроцит избытка ионов натрия и повышенному накоплению в нем воды, вследствие чего образуются сферические эритроциты (сфероциты). Сфероциты, в отличие от двояковогнутых нормальных эритроцитов, не обладают способностью деформироваться в узких участках кровотока, например при переходе в синусы селезенки. Это ведет к замедлению продвижения эритроцитов в синусах селезенки, отщеплению части поверхности эритроцита с образованием микросфероцитов (отсюда название болезни – микросфероцитоз) и постепенной их гибели. Разрушенные эритроциты поглощаются макрофагами селезенки. Постоянный гемолиз эритроцитов в селезенке ведет к гиперплазии клеток ее пульпы и увеличению органа. В связи с усиленным распадом эритроцитов в сыворотке повышается содержание свободного билирубина. Поступающий в повышенном количестве в кишечник билирубин выводится из организма с мочой и главным образом с калом в виде стеркобилина. Суточное выделение стеркобилина при наследственном микросфероцитозе превышает норму в 10 – 20 раз. Следствием повышенного выделения билирубина в желчь является плейохромин желчи и образование пигментных камней в желчном пузыре и протоках.
Клиническая картина
Клиника зависит от выраженности гемолиза. В большинстве случаев первые признаки выявляются в юношеском или зрелом возрасте. У детей болезнь обнаруживается обычно при обследовании по поводу заболевания их родственников. Жалобы вне обострения заболевания могут отсутствовать. В период обострения отмечаются слабость, головокружение, повышение температуры. Одним из основных клинических симптомов является желтуха, которая долгое время может оставаться единственным признаком заболевания. Выраженность желтухи зависит, с одной стороны, от интенсивности гемолиза, а с другой – от способности печени к конъюгированию свободного билирубина с глюкуроновой кислотой. В моче билирубин не обнаруживается, так как свободный билирубин не проходит через почки. Кал интенсивно окрашен в темно-коричневый цвет вследствие повышенного содержания стеркобилина. В связи со склонностью к камнеобразованию у больных могут наблюдаться приступы желчнокаменной болезни, нередко сопровождающиеся признаками холецистита. В случае закупорки камнем общего желчного протока возникает синдром обтурационной желтухи (значительное повышение содержания билирубина наличие желчных пигментов в моче, кожный зуд и так далее). Кардинальным симптомом наследственого микросфероцитоза является увеличение селезенки, которая обычно выступает из-под подреберья на 2 – 3 см. При длительно протекающем гемолизе наблюдается значительная спленомегалия, в связи с чем больные жалуются на тяжесть в левом подреберье. Печень при неосложненном заболевании обычно нормальных размеров, но иногда у больных, длительно страдающих гемолитической анемией, обнаруживается ее увеличение. Могут наблюдаться признаки замедленного развития, а также нарушения лицевого скелета в виде “башенного черепа”, седловидного носа, высокого стояния неба, нарушения расположения зубов, узких глазниц. Выраженность анемического синдрома различна. Часто отмечается умеренное снижение гемоглобина. У некоторых больных анемия вообще отсутствует. Наиболее резкая анемизация наблюдается в период гемолитических кризов. У лиц среднего и пожилого возраста иногда встречаются плохо поддающиеся лечению трофические язвы голени, связанные с агглютинацией и распадом эритроцитов в мелких капиллярах конечностей. Течение заболевания характеризуется так называемыми гемолитическими кризами, проявляющимися резким усилением симптомов на фоне непрерывно текущего гемолиза. При этом повышается температура в связи с массовым распадом эритроцитов, увеличивается интенсивность желтухи, появляется сильные боли в животе, рвота. Гемолитические кризы возникают обычно после интеркуррентных инфекций, переохлаждения, у женщин в связи с беременностью. Частота кризов различна, у ряда больных они не возникают.
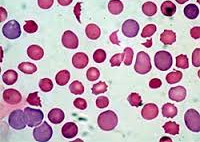
Диагноз
Анемия при наследственном микросфероцитозе носит нормохромный характер. В мазке крови преобладают микросфероциты, отличающиеся отсутствием характерного для нормальных эритроцитов центрального просветления. Преобладание микроцитов выявляется графически на кривой Прайс-Джонса, отражающей количественные соотношения эритроцитов различных диаметров (средний диаметр нормального эритроцита составляет 7 – 7,5 мкм). При наследственном микросфероцитозе вершина кривой Прайс-Джонса растянута и сдвинута влево в сторону микроцитов. Количество ретикулоцитов увеличено. Число лейкоцитов обычно нормально. При гемолитических кризах отмечается нейтрофильный лейкоцитоз со сдвигом влево. Количество тромбоцитов варьирует в пределах нормы. В костном мозге отмечается выраженная гиперплазия эритроидного ростка. Содержание непрямого билирубина в крови повышено умеренно и, как правило, не превышает 50 – 70 мкмоль/л. Определяется повышенное содержание уробилина в моче и стеркобилина в кале. Диагноз наследственного микросфероцитоза ставится на основании течения заболевания (чередование кризов и ремиссий), клинической картины (желтуха, спленомегалия, боли в правом подреберье, анемия), данных исследования периферической крови (нормохромная анемия, ретикулоцитоз, микросфероцитоз). Важное значение имеет обследование родственников больных, у которых могут определяться едва уловимые признаки гемолиза или микросфероцитоз без клинических проявлений. Дополнительными диагностическими критериями может служить ряд лабораторных тестов. Характерным лабораторным признаком заболевания является снижение осмотической резистентности эритроцитов по отношению к гипотоническим растворам хлористого натрия. Начало гемолиза при наследственном микросфероцитозе соответствует 0,6 – 0,7 %, а конец – 0,4 % вместо 0,48 и 0,22 % в норме. Снижение осмотической резистентности свидетельствует о преобладании в крови эритроцитов сферической формы – сфероцитов, которые, менее стойки к осмотическому гемолизу, чем нормальные макропланоциты. Эритроциты больных наследственным микросфероцитозом легко разрушаются после суточной инкубации дефибринированной крови в термостате при 37° С. Добавление к эритроцитам глюкозы значительно уменьшает гемолиз, в то время как АТФ не влияет на него. Дифференциальная диагностика наследственного микросфероцитоза сводится прежде всего к диагностике гемолитических анемий вообще и требует исключения целого ряда заболеваний (аутоиммунная гемолитическая анемия, наследственный микросфероцитоз, дефицит глюкозо-6-фосфатдегидрогеназы, болезнь Маркиафавы – Микели, талассемия). Гемолитический криз, сопровождающийся анемией, лейкоцитозом с выраженным левым сдвигом, появлением в крови нормоцитов, гиперплазией эритроидного ростка костного мозга при незначительном увеличении недифференцированных клеток, наряду с увеличением селезенки, нередко дает повод к ошибочной диагностике некоторых форм лейкозов, в частности острого эритромиелоза. При дифференциальной диагностике наследственного микросфероцитоза с другими гемолитическими анемиями необходимо исключить аутоиммунные гемолитические анемии. Правильному диагнозу способствует проба Кумбса, выявляющая фиксированные на эритроцитах аутоантитела при аутоиммунных гемолитических анемиях.
Лечение
Единственным методом лечения больных наследственным микросфероцитозом является спленэктомия, которая оказывается эффективной в 100 % случаях. После спленэктомии у больных наступает практическое излечение, несмотря на то, что эритроциты сохраняют свои патологические свойства (микросфероцитоз, снижение осмотической резистентности). Прекращение гемолиза после спленэктомии объясняется удалением основного плацдарма разрушения микросфероцитов. Спленэктомия показана при частых гемолитических кризах, резкой анемизации больных, инфарктах селезенки, приступах печеночной колики. При наличии соответствующих показаний в некоторых случаях одновременно со спленэктомией может быть произведена холецистэктомия. При легких компенсированных формах заболевания у взрослых показания к спленэктомии следует ограничивать. В качестве предоперационной подготовки анемизированных больных показаны переливания эритроцитарной массы. Глюкокортикоидные гормоны при наследственном микросфероцитозе неэффективны. Прогноз при наследственном микросфероцитозе относительно благоприятен. Многие больные доживают до старости. Вероятность возникновения заболевания у детей, если один из супругов болен микросфероцитозом, несколько ниже 50 %.
Наследственные гемолитические анемии, связанные с дефицитом активности ферментов
Эта неоднородная группа заболеваний обозначается также как несфероцитарные гемолитические анемии. В отличие от микросфероцитоза они характеризуются нормальной формой эритроцитов с тенденцией к макропланоцитозу, нормальной или повышенной осмотической резистентностью эритроцитов, рецессивным типом наследования, отсутствием эффекта от спленэктомии.
Этиология и патогенез
В основе патогенеза несфероцитарных гемолитических анемий лежит дефицит активности некоторых ферментов эритроцитов, в результате чего эритроциты становятся чувствительными к воздействию различных веществ растительного происхождения, лекарственных средств. Наиболее распространенной среди этой группы заболеваний является острая гемолитическая анемия, связанная с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Дефицит Г-6-ФДГ наследуется по рецессивному типу, сцепленному с полом, в связи с чем клинические проявления данной патологии наблюдаются преимущественно у мужчин. При низкой активности Г-6-ФДГ в эритроцитах нарушаются процессы восстановления никотинамиддинуклеотидфосфата (НАДФ) и превращения окисленного глютатиона в восстановленный, предохраняющий эритроцит от разрушающего действия потенциальных гемолитических агентов (фенилгидразин, некоторые медикаменты, бобовые и т.д.). Гемолиз происходит преимущественно внутрисосудисто. Кожа и внутренние органы желтушны. Отмечается увеличение и полнокровие печени и селезенки, умеренное увеличение и набухание почек. Микроскопически в почечных канальцах обнаруживают гемоглобинсодержащие цилиндры. В печени и селезенке наблюдается макрофагальная реакция с наличием в макрофагах гемосидерина.
Клиническая картина
Как правило, дефицит Г-6-ФДГ не проявляется клинически без воздействия различных гемолитических агентов. Спровоцировать гемолитический криз могут противомалярийные препараты, сульфаниламиды, анальгетики, некоторые химиопрепараты (фурадонин, ПАСК), витамин К, растительные продукты (бобовые, стручковые). Выраженность гемолитического процесса зависит от степени дефицита Г-6-ФДГ и от дозы принятого препарата. Гемолиз наступает не сразу, а через 2 – 3 дня после приема препаратов. В тяжелых случаях у больных появляется высокая температура резкая слабость, боли в животе и спине, обильная рвота. Отмечается выраженная одышка, сердцебиение, нередко развитие коллаптоидного состояния. Характерным симптомом является выделение темной мочи, имеющей иногда черный цвет, что связанно с внутрисосудистым распадом эритроцитов и выделением с мочой гемосидерина. В некоторых случаях вследствие закупорки почечных канальцев продуктами распада гемоглобина и резкого снижения клубочковой фильтрации возможно развитие острой почечной недостаточности. При объективном исследовании отмечается желтушная окраска кожных покровов и слизистых оболочек, увеличение селезенки, реже печени. Через неделю гемолиз прекращается, независимо от того, продолжается прием препарата или нет.
Диагноз
В течение первых двух суток гемолитического криза у больных развивается выраженная нормохромная анемия с падением гемоглобина до 30 г/л и ниже. Отмечается высокий ретикулоцитоз, наличие нормоцитов в крови. Особенностью эритроцитов является присутствие в них телец Гейнца, представляющих собой денатурированный гемоглобин и выявляющихся при суправитальной окраске. Осмотическая резистентность эритроцитов нормальная или повышена. Со стороны белой крови во время криза отмечается лейкоцитоз со сдвигом влево до миелоцитов и более молодых форм. В костном мозге наблюдается гиперплазия эритроидного ростка и явления эритрофагоцитоза. Диагноз острой гемолитической анемии, связанной с дефицитом Г-6-ФДГ, ставится на основании типичной клинико-гематологической картины острого внутрисосудистого гемолиза, связи заболевания с приемом лекарств и данных лабораторных исследований, выявляющих снижение активности Г-6-ФДГ в эритроцитах больных, а иногда их родственников. При диагностике необходимо учитывать географическую распространенность дефицита Г-6-ФДГ.
Лечение
Основным методом лечения острой гемолитической анемии при выраженном падении содержания гемоглобина являются повторные переливания свежецитратной одногруппной крови по 250 – 500 мл 1 – 2 раза в неделю внутривенные вливания больших количеств физиологического раствора или 5 % раствора глюкозы. В качестве противошоковых препаратов применяют морфин, преднизолон, промедол. Из сосудистых средств используют кордиамин, камфору. При развитии острой почечной недостаточности проводят обычный комплекс терапевтических мероприятий, при отсутствии эффекта показано проведение гемодиализа. При нетяжелых гемолитических кризах в качестве антиоксидантного препарата назначают эревит внутримышечно по 2 мл 2 раза в день. Профилактика гемолитических кризов заключается в тщательном сборе анамнеза перед назначением средств, способных спровоцировать гемолитический криз при дефиците Г-6-ФДГ. При необходимости применения этих препаратов у лиц с дефицитом Г-6-ФДГ рекомендуется использовать средства для восстановления глютатиона. С этой целью применяют ксилит в суточной дозе 30 г в комбинации с рибофлавином в дозе 0,03 г в течение 1 – 2 месяцев. Прогноз неблагоприятен при развитии анурии и почечной недостаточности. При молниеносных формах заболевания смерть наступает от шока или острой аноксии.
