Вычислите какое количество кислорода отдает оксигенированный гемоглобин
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
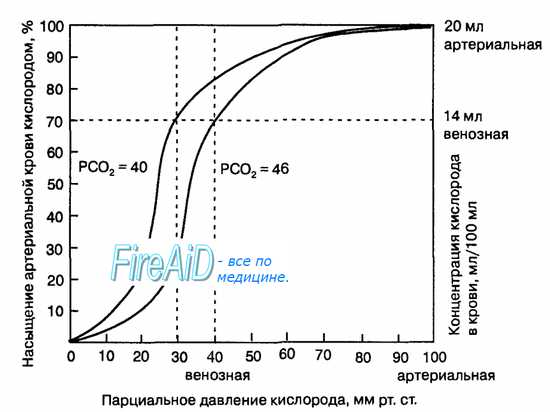
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
– Также рекомендуем “Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.”
Основная функция гемоглобина – транспорт кислорода, которую онвыполняет очень эффективно. Гемоглобин артериальной крови насыщен кислородом приблизительно на 96%, гемоглобин венозной крови – на 64% (White А. et al, 1981).
Уменьшение степени насыщения на 32 % соответствует количеству О2, потребляемому тканями. Принимая, что 100 мл крови содержат 15,0 г гемоглобина и что каждый грамм гемоглобина может связать 1,34 мл О2 (число Хюфнера) находим, что:
0,96 х 1,34 х 15 = 19,2 мл О2 –
транспортируется 100 мл артериальной крови (19,2 объемных %);
0,64 х 1,34 х 15 = 12,8 мл О2 –
транспортируется 100 мл венозной крови (12,8 объемных %);
19,2 – 12,8 = 6,4 мл О2 (6,4% объемных %)
или
0,32 х 1,34 х 15 = 6,4 мл О2 (6,4 % объемных %)
отдается тканям каждыми 100 мл артериальной крови, протекающими через капилляры.
Поскольку минутный объем крови (МОК) равен 5 литрам, в сутках 1440 минут, определяем, что в течение суток общий объем перекачиваемой сердцем крови составит:
5 х 1440 = 7200 литров
А так как один литр артериальной крови способен транспортировать 19,2 объемных % кислорода, из которых 6,4 объемных процента потребляются тканями, находим:
7200 х 19,2
———————– = 1382 литра – количество кислорода, транспортируемое
100 за сутки артериальной кровью
7200 х 6,4
———————– = 461 литр – количество кислорода, потребляемое тканями
100 за сутки из артериальной крови
В целом, за сутки кровь переносит от легких к тканям около 1400 л кислорода, из которых 450-600 л потребляются тканями. Причем, практически весь перенос кислорода обеспечивается гемоглобином, т.к. кислород плохо растворим в водных растворах. Ограниченная растворимость кислорода позволяет транспортировать его в растворенном состоянии в количестве, составляющем всего 0,3 мл О2 / 100 мл крови (White А. еt al, 1981) при РаО2 равном 12,7 кПа (95 мм рт ст). Это соотношение вытекает из закона Генри-Дальтона, в соответствии с которым «количество растворенного в жидкости газа пропорционально его напряжению». Важно отметить, что несмотря на малое количество растворенного кислорода, именно эта его фракция обусловливает РаО2.
Гемоглобин растворен в водном цитозоле эритроцитов в очень высокой концентрации, порядка 34%. Его синтез осуществляется в процессе созревания ретикулоцитов и перехода их в эритроциты. Гемоглобин состоит из белка – глобина и простетической группы – гема. Гем представляет собой соединение, в молекулу которого входят атом двухвалентного железа и 4 замещенных пиррольных кольца, связанных между собой метиновыми группами ( – СН = ). Скелетом молекулы гема служит порфирин. Fe2+ имеет в геме координационное число, равное 6, т.е. 6 пар электронов. Четыре из этих пар связаны с атомами азота, одна пара с белком (глобином) через гистидин. Оставшаяся пара электронов используется для образования донорско-акцепторной координационной связи (ковалентной химической связи) с кислородом (рис. 12).
Функциональные свойства гемоглобина, обусловленные его уникальной структурой, специфически соответствуют задачам обеспечения дыхательной функции. Каждая из четырех полипептидных цепей глобина содержит по одной молекуле гема. А поскольку атом железа в геме может обратимо связывать одну молекулу О2 понятно, что одна молекула полностью оксигенированного гемоглобина (НbО2) содержит четыре молекулы кислорода.Гемоглобин, отдавший кислород тканям, называется свободным (неоксигенированным) гемоглобином.
Рис. 12.Координационные связи железа в молекуле гема
(по A. Ленинджеру, 1985)
В процессе присоединения и отдачи кислорода железо в молекуле гемоглобина свою валентность не меняет, т.е. при присоединении кислорода или при его отдаче железо не окисляется и не восстанавливается. Следовательно, в этих случаях речь идет об оксигенированном (оксигемоглобин) и неоксигенированном (свободном) гемоглобине, но не об окисленном и восстановленном гемоглобине.
Окисленный гемоглобин – это метгемоглобин (MetHb), содержащий Fe3+. Он не способен присоединять кислород, однако Fe3+ в MetHb может взаимодействовать со многими анионами, например, при щелочном рН с ОН- и при кислом рН – с Cl-. В небольшом количестве, составляющем 0, 5% от всего гемоглобина, метгемоглобин образуется ежесуточно в условиях in vivo (White A. et al, 1981).
Кроме кислорода к атому железа в молекуле гемоглобина могут присоединяться и другие вещества (лиганды) : Н2О; СО; СN. Их сродство, проявляемое к атому железа, неодинаково. Оно наиболее выражено у цианидов, затем у окиси углерода, затем у кислорода и наименее выражено у воды.
Степень насыщения гемоглобина кислородом зависит от парциального давления кислорода (РО2). Это давление в легких ( 100 мм рт.столба) достаточно, чтобы практически полностью оксигенировать весь гемоглобин в эритроцитах. Уникальной особенностью связывания гемоглобином О2 является кооперативное взаимодействие между гемсвязывающими участками, получившее название гем-гем – взаимодействие. И хотя прямых физических контактов между четырьмя группами гема нет, кооперативность связывания О2 проявляется в том, что по мере протекания оксигенирования гемоглобина облегчается связывание последующих молекул кислорода. При физиологических условиях сродство к О2 у гемоглобина и у полностью оксигенированного гемоглобина отличается в 500 раз (A. White et al, 1981); это показывает, что после присоединения первых молекул О2 сродство частично насыщенного гемоглобина к кислороду увеличивается.Данное положение характеризуетсясигмовидной формой кривой диссоциации HbO2 (рис. 5).Такая формауказывает на то, что связывание О2 одной из гемовых групп гемоглобина влияет на константы диссоциации других гемовых групп этой же молекулы. Сигмовидный характер кривой диссоциации НbО2 имеет большое физиологическое значение. Как видно из рис. 5 парциальное давление О2 существенно влияет на насыщение гемоглобина в пределах от 20 до 60 мм рт. ст., когда показатель насыщения кислородом характеризуется наиболее крутым подъемом отрезка кривой. При больших значениях РО2 кривая насыщения приобретает пологий характер, увеличиваясь в диапазоне 60-90 мм рт. ст. всего на 7%.
Связывание гемоглобином кислорода зависит не только от РО2. Этот процесс тонко регулируется рядом соединений, подобно тому как это имеет место при действии на аллостерический фермент.Таким регуляторным действием обладают 2,3 – дифосфоглицерат, диоксид углерода (СО2) и ионы Н+.
Главной фракцией фосфатов в эритроцитах является 2,3 – дифосфоглицерат (ДФГ); его внутриклеточная концентрация составляет приблизительно 4-5 – ммоль, т.е. сопоставима с концентрацией гемоглобина. Дифосфоглицерат (ДФГ) связывается с тетрамерным гемоглобином при нейтральном рН, образуя комплекс с соотношением компонентов 1 : 1. Связывание с гемоглобином ДФГ обусловлено наличием в молекуле последнего отрицательно заряженных групп (рис. 13):
-О О
С
Н С О Р О-
Н С Н
О
О Р О
О-
Рис. 13. Структура молекулы ДФГ(по А. Ленинджеру, 1985).
Жирным выделены группы, взаимодействующие с β-цепями
Местом связывания служит центральная полость или канал в молекуле гемоглобина, выстланный многочисленными положительно заряженными R-группами β-цепей. В итоге образуется поперечная связь между двумя β-субъединицами. При связывании гемоглобина кислородом ДФГ вытесняется из этого канала.
Главным результатом образования комплекса ДФГ-гемоглобин является снижение сродства гемоглобина к кислороду:
НbO2 + ДФГ Нb • ДФГ + О2
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. Чем ниже это давление (при подъеме на высоту), тем выше концентрация ДФГ в эритроцитах, тем легче будет освобождаться кислород от связи с гемоглобином в тканях.
Таким образом, при фиксированной концентрации оксигенированного гемоглобина, увеличение концентрации ДФГ повышает диссоциацию НbO2. При увеличении же РО2 и росте концентрации НbО2 будет усиливаться диссоциация комплекса Нb ДФГ.
Повышенное сродство крови плода к кислороду не является следствием различий сродства фетального (НbF) и постнатального (НbA) гемоглобинов к О2, поскольку кривые диссоциации изолированных НbАО2 и НbFO2 существенно не отличаются. Этот феномен повышенного сродства к кислороду крови плода является результатом менее эффективного связывания ДФГ фетальным гемоглобином, поскольку на ДФГ – связывающем участке НbF незаряженный Sery γ 143 заменяет His β 143.
В крови, консервированной в некоторых средах (цитрат-декстрозной) концентрация ДФГ снижается (в течение 10 дней с 4,5 до 0,5 мМ). Гемоглобин такой крови приобретает очень высокое сродство к кислороду, в связи с чем увеличивается риск развития гипоксии, обусловленной снижением отдачи им кислорода. Тем более, что восстановление содержания ДФГ самими эритроцитами происходит медленно (за 24 часа – до половины нормальной концентрации). Исправление ситуации путем добавления экзогенного ДФГ не эффективно, поскольку высокий отрицательный заряд его молекулы не позволяет ей проникать через мембрану эритроцитов. В связи с этим используются вещества, добавление которых к консервированной крови обеспечивает поддержание нормальной концентрации ДФГ (Волкова Н.П., 2005).
Способность гемоглобина взаимодействовать с СО2 и ионами Н+ определяется не наличием атома Fe2+ в гемах, а другими участками его молекулы, с которыми происходит связывание этих соединений. В частности, ионы водорода присоединяются к R – группам остатков гистидина в α и β – цепях глобина :
R CH COOH (общая формула аминокислоты)
NH2
R – группа, с которой связывается
ион водорода.
Что касается диоксида углерода, то он присоединяется к концевой α-аминогруппе каждой из четырех полипептидных цепей с образованием карбаминогемоглобина:
O O
R CH C + CO2 R CH C
OH OH
NH2 NHCOO- + H+
карбаминоконцевой остаток
( карбаминогемоглобин )
Важно подчеркнуть, что процессы связывания с гемоглобином О2, Н+ – ионов и СО2 (как и ДФГ) взаимозависимы. Эту взаимозависимость иногда называют кооперативным эффектом гемоглобина, который заключается в том, что изменение концентрации одного из этих веществ влияет на связывание гемоглобина с другими. В частности,связывание с гемоглобином СО2 и ионов водорода снижает его способность связывать кислороди наоборот:связывание с гемоглобином кислорода снижает его способность связывать СО2 и ионы Н+.Поэтому в периферических тканях с относительно низким значением рН и высокой концентрацией СО2 сродство Нb к кислороду падает по мере связывания СО2 и ионов водорода. И наоборот, в легочных капиллярах выделение СО2 и сопутствующее ему повышение рН крови приводят к увеличению сродства гемоглобина к кислороду. Это влияние величины рН и концентрации СО2 на связывание и освобождение кислорода гемоглобином называется эффектом Бора(в честь датского физиолога Христиана Бора, впервые открывшего его).
В основе данного эффекта лежит изменение четвертичной структуры (т.е. упаковки субьединиц молекулы белка) гемоглобина при его оксигенации. В результате молекула оксигенированного гемоглобина приобретает несколько более компактную структуру по сравнению с неоксигенированным. Вследствие этого аминокислотные остатки в α и β – цепях, связывающие ионы водорода, перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщепление ионов водорода от протонированных групп. Иначе говоря, протонированные группы при оксигенации гемоглобина приобретают свойства более сильных кислот (как донаторов ионов водорода). Т.е. НbО2 более сильная кислота (в 70 раз – Войнов В.А., 1992), чем ННb. Можно сказать и так, что оксигенированный гемоглобин (НbO2) плохо присоединяет протоны, но зато легко их отдает. А неоксигенированный гемоглобин наоборот – плохо отдает протоны, но зато легко их присоединяет (ННb).
В легочной ткани вследствие уменьшения РСО2 и превращения гемоглобина в НbО2 освобождается также СО2, находящийся в виде карбаминогемоглобина..
Повышение или снижение сродства Hb к кислороду проявляется изменением кривой диссоциации оксигемоглобина (рис. 14).
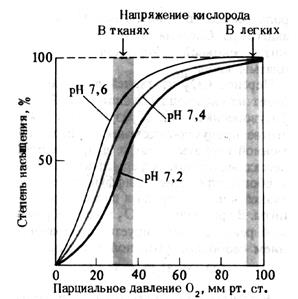
Рис. 14.Кривая диссоциации оксигемоглобина. Влияние рН(по A. Ленинджеру, 1985)
Эти изменения обозначаются понятием «сдвиг вправо» и «сдвиг влево». При сдвиге вправо, как это следует из рисунка, при снижении рН (рН = 7,2), 50% насыщение Hb кислородом, которое в норме происходит при значениях РаО2 ≈ 26,6 мм рт. ст, будет осуществляться уже при больших значениях РаО2, приближающихся к 40 мм рт. ст. Это означает, что сродство Hb к кислороду понизилось. Соответственно, при сдвиге влево (рН = 7,6) 50% насыщение Hb кислородом происходит при меньших, чем при нормальном рН значениях РаО2. Это означает, что сродство Hb к кислороду оказалось повышенным. Помимо кислотно-основного состояния на характер кривой диссоциации оксигемоглобина влияют и другие факторы (табл. 3).
Таблица 3.
