Железо необходимо для синтеза гемоглобина
Гемоглобин синтезируется в клетках костного мозга. Все необходимые для синтеза гемоглобина составные части поступают с током крови.
Белковая часть молекулы синтезируется как и все простые белки из аминокислот матричным способом.
Синтез гема протекает в несколько стадий под влиянием различных ферментов:
1. Вначале происходит образование дельта-аминолевулиновой кислоты. Это реакция протекает в результате конденсации сукцинил-КоА и глицина в митохондриях под действием фермента аминолевулинатсинтетазы.
2.Следующая реакция протекает в цитоплазме. Происходит образование порфобилиногена в результате реакции конденсации двух молекул дельта-аминолевулиновых кислот.
3.Затем, в результате многоступенчатых реакций из четырех монопиррольных молекул порфобилиногена образуется протопорфирин 1Х, являющийся непосредственным предшественником гема.
4. Протопорфирин IX присоединяет молекулу железа (реакция осуществляется под влиянием фермента гемсинтетазы или феррохелатазы) и образуется гем, который затем используется для биосинтеза всех гемопротеидов. Оба фермента, участвующие в синтезе ПБГ, регулируемые, они ингибируются гемом и НЬ. Поэтому гем не образуется в избытке или недостатке. Также строго в определенном количестве образуется и белковая часть Нb, т. к. ее синтез может происходить только в присутствии тема, и образующиеся полипептидные цепи тут же соединяются с гемом. При низкой концентрации гема, когда нарушается его синтез, образование гемоглобина также замедляется.
Каждая из образовавшихся полипетидных цепей глобина присоединяются кодному гему, образуя моном ер гемоглобиан. 4 таких мномера, объединивщись, образуют гемоглобин.
Основной функцией гемоглобина является перенос кислорода из легких к тканям и перенос углекислого газа от тканей к легким, участие в поддержке рН крови. Свои функции гемоглобин выполняет только в составе эритроцита. Продолжительность жизни эритроцита 110-120 дней. Затем эритроцит подвергается гемолизу
3. Распад гемоглобина. Превращение билирубина в желудочно- кишечном тракте. Свободный и связанный билирубин. Свойства.
При гемолизе эритроцитов гемоглобин попадает в кровь и соединяется с белком гаптоглобином, в виде комплекса гемоглобин-гаптоглобин (Нр-Нb) транспортируется в клетки макрофагально-моноцитарной системы (ММС): это Купферовы клетки печени, клетки лимфоузлов, селезенки, пейеровых бляшек в кишечнике.
Процесс начинается с окислительного расщепления метинового мостикамежду первым и вторым пиррольными кольцами и образуется вердоглобин. Затем от вердоглобина отщепляется глобин, железо и образуется биливердин (зеленого цвета), вещество линейной структуры. Железо соединяется с b-глобулинами и в виде трансферина доставляется в печень и селезенку, где депонируется в виде ферритина. Глобин распадается так же как и все простые белки до аминокислот.
Биливердин восстанавливается за счет НАДФН2 в неконьюгированный,
свободный билирубин, который не растворим в воде и является токсичным соединением. Свободный билирубин выходит из клеток ММС, соединяется с
альбуминами и поступает в гепатоциты. В крови он называется непрямым потому, что дает реакцию с реактивом Эрлиха не сразу, а после добавления в сыворотку крови кофеинового реактива или спирта для осаждения белка.
В Купферовых клетках печени распад гемоглобина также начинается с
образования вердоглобина, затем биливердина. В печени непрямой билирубин обезвреживается в гепатоцитах путем реакции конъюгации, соединяясь с одной или двумя молекулами глюкуроновой кислоты, образуя моно- или диглюкуронид билирубина. Такой билирубин называется конъюгированным и
связанным и прямым. Этот билирубин хорошо растовряется в воде, не обладает токсическими свойствами. Биливердин и прямой билирубин собираются в желчном пузыре, придавая желчи оливковый цвет и потому их относят к пигментам желчи. Желчь поступает в тонкий кишечник, но в желчном протоке прямой билирубин, теряя глюкуроновые кислоты, снова превращается в непрямой. Биливердин проходит через весь кишечник не изменяя своей химической структуры и удаляется с калом, окрашивая его в зеленоватый цвет, т.е. он является пигментом кала. А непрямой билирубин в кишечнике восстанавливается до мезобилиногена (уробилиногена), часть которого всасывается в воротную вену и возвращается в печень, где распадается до бесцветных моно- и дипирролов. Последние выводятся через почки вместе с мочой.
Большая часть мезобилиногена поступает в толстый кишечник, где под
влиянием ферментов микроорганизмов восстанавливается в стеркобилиноген. Часть стеркобилиногена, всасываясь в кровь через геморроидальные вены, попадает в почки. В моче под действием света и воздуха происходит окисление стеркобилиногена до стеркобилина, который придает моче желтый цвет, т.е. является пигментом мочи. Остальная часть стеркобилиногена окисляется в толстом кишечнике на свету до стеркобилина и вместе с биливердином является пигментом кала, придавая ему коричнево-зеленый цвет.
У грудных детей в кишечнике нет гнилостных бактерий, поэтому
билирубин не превращается в стеркобилиноген и выводится как таковой. Соответственно цвет кала у детей обусловлен биливердином и билирубином (желто-зеленый).
У детей в первые три месяца эмбрионального периода образуется эмбриональный гемоглобин. Затем он преобразуется в фетальный (гемоглобин F), который доминирует вплоть до рождения ребенка. После рождения в течение первого месяца жизни фетальный гемоглобин постепенно заменяется на гемоглобин взрослого (гемоглобин А), отличающегося составом полипептидных цепей. Эмбриональный и фетальный гемоглобин обладают более высоким сродством к кислороду по сравнению с гемоглобином взрослого.
Пигменты желчи, кала и мочи.
При распаде гемоглобина образуются пигменты желчи, кала и мочи.
Пигменты желчи: биливердин (зеленого цвета), связанный билирубин (глюкурониды билирубина –желтого цвета). Цвет желчи зависит от соотношения этих пигментов.
Пигменты кала: биливердин (зеленого цвета), стеркобилин (коричневого цвета)
Пигмент мочи: стеркобилин
Цвет сыворотки крови тоже зависит в определенной степени от наличия в ней билирубина. В норме количество общего билирубина в крови равно 8—20 мкмоль/л, на долю непрямого билирубина приходится 75- 100%, а прямого от 0 до 25%. Количество прямого билирубина незначительно. Прямой билирубин проходит через пачечную ткань, и появляется в моче, непрямой билирубин в моче появиться не может, вследствие его нерастворимости в воде.
Источник

Синтез гемоглобина происходит в костном мозге. Он образуется из гема и глобина. Гем – это соединение порфирина и железа, а глобин представлен двумя цепочками аминокислот: 2 альфа и 2 бета.
Один гем и глобин называются субъединицей, в гемоглобине их 4. Каждая может присоединять из воздуха и отдавать клетке кислород, а в обратном направлении переносится углекислый газ. При недостатке железа развивается железодефицитная анемия, так как железо удерживает части гема, обеспечивает соединение гема и глобина.
При нарушении образования цепей глобина развивается талассемия со склонностью к тромбозу и серповидно-клеточная анемия с поражением печени, селезенки, накоплением железа. Если есть врожденный дефект синтеза порфирина, то возникают порфирии, их типичный признак – это красная моча. Печеночная порфирия также появляется при злоупотреблении снотворными группы барбитуратов.
Синтез гемоглобина: пояснение простыми словами
Синтез гемоглобина проходит в клетках-предшественниках эритроцитов – эритробластах и ретикулоцитах костного мозга. Для его образования нужны порфирины, глобин (белок) и ионы железа. Порфирин – это аморфное (некристаллическое) вещество, при пропускании через него света появляется красное окрашивание. Источниками для его синтеза является аминокислота, глицин и коэнзим А (производное янтарной кислоты).
Из порфирина и железа образуется гем. Биохимия этого процесса включает ряд последовательных реакций с появлением порфобилиногена. Потом требуется его 4 молекулы для формирования комплекса уропорфириногена, превращающегося в протопорфирин. Именно последний и соединяется с железом. Одновременно и в том же количестве образуется белок глобин из аминокислот. При соединении гема и глобина появляется гемоглобин.
Для нормального образования гема требуется витамин В6, В12, фолиевая кислота, ионы меди и кобальта. Поэтому при однообразном питании с дефицитом мяса, овощей, ягод и круп уменьшается синтез гемоглобина. Также причиной нарушений бывают и врожденные болезни с нарушением усвоения витаминов и минералов. Так развиваются дефицитные анемии. Наиболее известная и распространенная форма – это железодефицитная, но возможны и фолиеводефицитная, В12-дефицитная.
Какую структуру имеет молекула гемоглобина
Молекула гемоглобина в структуре содержит белковую часть – глобин и пигментный комплекс с железом (гем). У взрослого человека белок имеет 2 альфа и 2 бета цепи, они состоят из 141 и 146 аминокислот соответственно. Нормальный гемоглобин имеет обозначение HbA1. Следовые количества представлены HbA2, в нем вместо бета-цепей есть дельта-цепи. Такой комплекс прочно удерживает кислород и с трудом его отдает тканям.
В крови у плода есть два вида гемоглобина – эмбриональный и фетальный. Они имеют другую первичную структуру. У новорожденного 80% составляет фетальный, а к концу первого месяца молекула приобретает вид обычного, характерного для взрослого.
Число гемов в составе молекулы
Молекула гемоглобина состоит из четырех гемов. Каждый гем внутри содержит железо и окружен глобином, образующим гемовый «карман». Такое расположение обеспечивает растворимость и возможность соединения с кислородом. Каждая субъединица может связывать одну молекулу кислорода.
Поэтому на каждый гемоглобин эритроцита приходится 4 молекулы кислорода. После того, как доставка кислородных молекул завершена, гемоглобин забирает из тканей углекислоту, и в легких она выделяется в воздух при выдохе.
Роль железа в синтезе гемоглобина
Железо является необходимым компонентом для синтеза гемоглобина, так как оно обеспечивает связи ядер порфирина, аминокислот глобина, то есть оно удерживает весь комплекс. Биологическая роль железа состоит также в:
- связывании кислорода в легких;
- транспортировке кислорода к тканям и внутриклеточном переносе к митохондриям;
- использовании кислородных ионов для образования энергии;
- обезвреживании токсичных соединений.
Источниками минерала является пища и ионы, образовавшиеся при распаде гемоглобина (повторное использование). Усиление всасывания железа из кишечника происходит при снижении его запасов. Хранится микроэлемент в виде ферритина.
Болезни с нарушением синтеза гемоглобина
Снижение синтеза гемоглобина происходит при дефицитных анемиях, но есть и более редкие формы нарушений – образование неправильных цепей глобина (гемоглобинозы) и дефекты порфирина (порфирии).
Гемоглобинозы
Гемоглобинозы делятся на гемоглобинопатии и талассемии.
Гемоглобинопатии характеризуются образованием гемоглобина неправильной структуры. Могут протекать бессимптомно при мелких изменениях или тяжело при существенных аномалиях. Примером опасной формы является серповидно-клеточная анемия. При ней образуется HbS. Глутаминовая кислота в нем заменена на валин в шестом положении бета-цепи. Это приводит к снижению растворимости гемоглобина внутри эритроцита, и он образует осадок в виде серпа. Для этого заболевания характерны:
- нарушение кровотока в мелких сосудах;
- склонность к тромбозам;
- высокий риск инсульта, инфаркта;
- ускоренное разрушение эритроцитов (гемолитическая анемия);
- одышка, особенно при физических нагрузках.
При талассемии нарушается синтез одной из цепей гемоглобина. Чаще всего изменяется бета-цепь. Фетальный гемоглобин из-за этого не превращается в полноценный HbA1, его в крови у взрослых содержится до 60%, а вторая форма с плохой отдачей кислорода HbA2 составляет около 15%. Эти формы гемоглобина нестойкие, поэтому эритроциты быстро разрушаются. Болезнь сопровождается:
- разрастанием и разрушением костного мозга;
- изменениями формы лица и черепа;
- поражением селезенки и печеночной ткани;
- увеличением количества железа в сыворотке крови и его отложением в тканях.
Причиной смерти больного чаще всего бывает сердечная недостаточность из-за накопления железа в миокарде.
Порфирии
Нарушение янтарно-глицинового пути образования порфирина приводит к порфирии. Это врожденные и приобретенные болезни, наиболее распространены эритроцитарная и печеночная. Первая характеризуется дефектом ферментов, участвующих в синтезе гема. В организме накапливается уропорфириноген, он не может включиться в гемовый остаток и выделяется с мочой, концентрируется в костном мозге. Типичные признаки:
- красная моча;
- ускоренное разрушение эритроцитов;
- красноватый оттенок зубов;
- высокая чувствительность к солнечным лучам.
Печеночная порфирия бывает врожденной и на фоне злоупотребления барбитуратами (снотворные). Моча имеет цвет красного вина, больные предъявляют жалобы на частую рвоту, запоры, нарушения работы сердца, боль в животе. Нередко возникают психические расстройства.
Для синтеза гемоглобина нужно железо, белок, витамины, немного меди и кобальта. Его образование происходит в костном мозге, а при нарушении возникает талассемия, порфирии, серповидно-клеточная и дефицитные анемии.
Источник
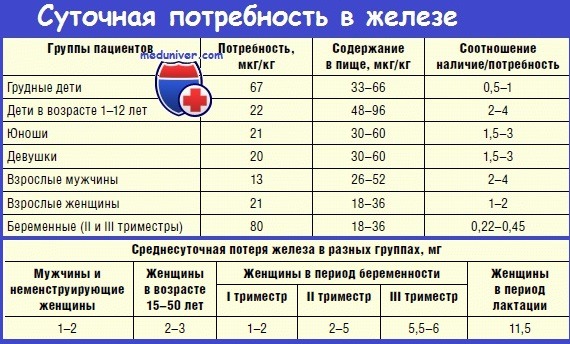
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Железо. Железо в норме. Роль ионов железа в эритропоэзе. Трансферрин. Потребность организма в железе. Дефицит железа.В организме содержится 4—5 г железа в виде резервного (1/4) и функционально-активного железа (3/4). 62—70 % железа находится в гемоглобине эритроцитов, 5—10 % — в миоглобине, остальное — в тканях, где оно участвует во многих метаболических процессах: в составе металсодержащих энзимов—цитохромов обеспечивают митохондриальный транспорт электронов, синтез ДНК и деление клеток, метаболизм гормонов мозгового вещества надпочечников, детоксикационные механизмы, снижающие активность токсичных веществ под влиянием цитохрома Р450, в состав которого входит железо; поддерживают активность глицерол-3-фосфатдегидрогеназы в поперечно-полосатых мышцах, что сохраняет физическую работоспособность человека. Резервное железо постоянно переходит в функциональное и обратно. Так, за счет повторного использования костный мозг получает ежесуточно 20—25 мг железа. Ионы железа (Fe++) ежедневно всасываются в кишечнике из пищи. Fe2+ в кишечном содержимом вначале связывается с белком-рецептором на поверхности эпителия слизистой оболочки кишки (b3-интегрином), что необходимо для перехода его через мембрану клетки слизистой в цитозоль. Далее, образовав комплекс с цитозольным транспортным белком- мобилферрином, Fe2+ пересекает клетку эпителия слизистой кишечника оставаясь в этом комплексе вплоть до поступления Fe2+ в капиллярную сеть кишечника. С выходом в кровоток двухвалентное железо окисляется до трехвалентного белком плазмы крови церрулоплазмином и присоединяется к трансферрину, гликопротеину плазмы крови. Трансферрином Fe3+ доставляется к тканям и используется в митохондриях эритроб-ластов для синтеза гема, депонируется в макрофагах в виде резерва. Плазма содержит от 1,8 до 2,6 мг/л трансферрина, 1 мг которого связывает 1,25 мкг Fe. В общем объеме плазмы содержится около 3 мг Fe2+. В норме лишь ‘/з трансферрина плазмы насыщена железом. Количество железа, которое может быть связано трансферрином, называется общей железосвязывающей способностью крови и в норме составляет 250—400 мкг % (45— 72 мкмоль/л). Концентрация железа в сыворотке крови у взрослых людей обоего пола колеблется от 50 до 160 мкг % (9—29 мкмоль/л). С мочой выводится за сутки 60—100 мкг железа. Комплекс трансферрин — железо фиксируется на рецепторах мембран эритробластов. Количество этих рецепторов уменьшается за счет торможения их синтеза в ходе созревания эритроидных клеток и исчезает после созревания ретикулоцитов, поэтому в зрелые эритроциты железо не включается. Освобождение железа из комплекса трансферрин — железо обеспечивается энергией молекул АТФ, образуемых в эритробластах. Молекула трансферрина, отдавшая железо, смещается с мембранного участка молекулами трансферрина, связанными с железом, поскольку их сродство к рецепторам более сильное. Железо, поступившее в эритробласт, используется в митохондриях для синтеза гема и депонируется в эритробласте в виде резерва. В макрофагах печени и костного мозга резервное железо депонируется в молекуле ферритина. Внутри лизосом молекулы ферритина образуют большие аморфные нерастворимые агрегаты — гемосидерин. Таким образом, ферритин и гемосидерин — это формы резервного железа в клетках. Из клеточного резерва железо освобождается в двухвалентном состоянии (благодаря энзиму ксантиноксидазе, аскорбиновой кислоте и др.), затем церулоплазмин окисляет Fe2+ до трехвалентного состояния, Fe3+ соединяется с трансферрином и транспортируется с плазмой крови к эритробластам.
Абсорбции железа эпителиальными клетками желудочно-кишечного тракта способствуют сниженное насыщение трансферрина железом и повышенная эритропоэтическая активность крови. Абсорбция снижается при увеличении концентрации железа в клетках слизистой оболочки кишечника. В кишечнике более эффективна абсорбция Fe2+, чем Fe3+. Поэтому аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин) поддерживают двухвалентную форму железа и ускоряют его абсорбцию. В кишечнике лучше абсорбируется биодоступное железо, входящее в состав гема (мясные продукты, кровяная колбаса), чем железо из пищи растительного происхождения. Абсорбция Fe2+ в желудочно-кишечном тракте зависит от возраста человека, функционального сотояния его организма. Она наиболее высокая у детей первых месяцев жизни и достигает 57 %, у 7— 10-летних —7,75—17,75 %, у взрослых мужчин и женщин — 1,1—11,2 % и у беременных женщин — 20 % от поступившего в желудочно-кишечный тракт железа. Отсюда ежедневная потребность в железе, абсорбируемом из пищи в организме человека, составляет: у детей от 0 до 4 мес жизни — 0,5 мг/день, от 1 года до 12 лет— 1,0 мг/день, женщины детородного периода — 2,8 мг/день (во время менструации потери железа составляют от 5 до 45 мг), молодые мужчины — 1 мг/день, старики — 0,9 мг/день, беременные женщины — 3—3,5 мг/день. В организм последних за время беременности должно поступать до 1 г железа (500 мг железа используется для синтеза дополнительного количества гемоглобина в организме беременной, 300 мг Fe2+ необходимо формирующемуся плоду и 200 мг Fe2+ компенсируют естественные потери металла организмом беременной женщины). Дефицит железа в организме человека приводит к развитию гипохромной анемии. – Также рекомендуем “Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз.” |
Источник
