Жизненная роль гемоглобина общеизвестна он переносит кислород
Цифры напротив символа Hb, или гемоглобина, в бланке с результатами общего анализа крови могут раскрыть врачу причины низкого давления, головокружения, судорог ног пациента, а также оповестить о надвигающихся серьезных угрозах. Своевременное выявление отклонений и приведение концентрации гемоглобина в норму позволит избежать серьезных проблем со здоровьем. Речь идет о снижении рисков инфарктов и инсультов у людей в возрасте, патологий развития детей, ухудшения состояния матери и плода во время беременности.
Что такое гемоглобин и каковы его функции
Гемоглобин (Hb) — сложный железосодержащий белок, содержащийся в эритроцитах (красных кровяных тельцах) крови и частично присутствующий в свободном виде в плазме. Именно он осуществляет перенос кислорода от легких к клеткам и углекислого газа — в обратном направлении. Если говорить образно, то эритроцит — это своеобразное грузовое судно, курсирующее по кровяному руслу, а молекулы гемоглобина — контейнеры, в которых транспортируется кислород и углекислый газ. В норме один эритроцит вмещает порядка 400 млн молекул гемоглобина.
Участие в газообмене — важнейшая, но не единственная функция «кровяных шаров» (от греч. haima — «кровь» + лат. globus — «шар»). Благодаря своим уникальным химическим свойствам гемоглобин является ключевым элементом буферной системы крови, поддерживающим кислотно-щелочной баланс в организме. Hb связывает и выводит на клеточном уровне кислые соединения (препятствует ацидозу — закислению тканей и крови). А в легких, куда он поступает в форме карбгемоглобина (HbCO2), за счет синтеза углекислоты предотвращает противоположный процесс — защелачивание крови, или алкалоз[1].
Производная Hb — метгемоглобин (HbOH) — обладает еще одним полезным свойством: прочно связывать синильную кислоту и другие токсичные вещества. Таким образом, железосодержащий белок принимает удар на себя и снижает степень отравления организма[2].
Итак, гемоглобин крайне важный элемент жизнедеятельности и патологическое уменьшение его концентрации (анемия или малокровие) может спровоцировать в лучшем случае ломкость ногтей и волос, сухость и шелушение кожи, мышечные судороги, тошноту и рвоту, головокружение. Острая же форма анемии вызывает кислородное голодание клеток, приводящее к обморокам, галлюцинациям и фатальным последствиям — гипоксии мозга, атрофии нервных клеток, параличу дыхательной системы.
Как должно быть в норме
Уровень гемоглобина в нашей крови может несколько увеличиваться и уменьшаться по естественным причинам. Обновление гемоглобина связано с жизненным циклом эритроцита, к которому он прикреплен. Так, примерно каждые 120 дней часть молекул гемоглобина вместе с эритроцитами отправляется в печень — на расщепление и после вновь синтезируется, присоединяясь к свободному эритроциту[3].
Количество гемоглобина зависит от возраста и пола, меняется в процессе вынашивания и рождения ребенка[4].
На гемоглобин также оказывают влияние специфические условия труда или проживания (например, повышенные показатели бывают у пилотов и жителей гористой местности), приверженность вегетарианству и донорство (эти факторы, напротив, снижают гемоглобин)[5].
Согласно рекомендациям ВОЗ[6], нормой гемоглобина считается:
- для детей от полугода до 5 лет — 110 г/л и выше;
- для детей 5–11 лет — 115 г/л и больше;
- для детей 12–14 лет, а также девушек и женщин (15 лет и старше) — 120 г/л и выше;
- для мужчин (15 лет и старше) — 130–160 г/л.
Беременным женщинам, обеспечивающим минералами (в том числе железом) себя и малыша, важно следить, чтобы уровень гемоглобина не падал ниже 110 г/л. Отметим, что, по данным ВОЗ, железодефицитная анемия (ЖДА) диагностируется у 38,2% беременных на планете[7]. Дефицит молекул гемоглобина может возникнуть после 20-й недели «интересного положения»: из-за увеличения объема циркулирующей крови, растущих потребностей плода, уменьшения поступления и всасывания железа вследствие токсикоза и расстройств ЖКТ. В это время женщину может мучить слабость, головокружение, одышка даже при непродолжительной ходьбе, судороги нижних конечностей. Опасное следствие острых форм ЖДА — преждевременные роды, задержки в развитии плода.
Кстати, необычные вкусовые запросы беременных (вплоть до анекдотичных, таких как салат из жареной клубники и селедки) порой тоже связаны с потребностью в железе для синтеза гемоглобина. Роды, сопровождающиеся потерей крови, ведут к дополнительному понижению гемоглобина. В целом от зачатия до появления ребенка на свет организм женщины утрачивает порядка 700 мг железа, еще 200 мг — за период лактации[8]. На восстановление запасов требуется не менее трех лет.
Виды анализов на гемоглобин
Подсчет числа молекул гемоглобина производится при общем анализе крови. Помимо количества белка (строка Hb), в бланке анализа могут указать MCH/MCHC, что соответствует среднему содержанию/концентрации гемоглобина в эритроците. Это уточнение позволяет подсчитать полезный железопротеин и исключить из расчета аномальные, нестабильные формы гемоглобина, не способные переносить кислород.
Для измерения гемоглобина во внелабораторных условиях — в машинах скорой помощи или при проведении профилактических выездных осмотров — применяются специальные гемоглобинометры. Это портативные приборы, в которые помещается кровь с реагентом для фотометрического автоматического определения количества гемоглобина.
Для массового тестирования на анемию в странах третьего мира ВОЗ разработала малозатратный колорометрический метод исследования. При колориметрии каплю крови наносят на специальную хроматографическую бумагу и сопоставляют ее со шкалой цветов, соответствующих разным показателям гемоглобина с шагом 20 г/л[9].
Уровень гликированного гемоглобина определяется и при биохимическом анализе венозной крови. Цель исследования в данном случае — определение глюкозы в крови, которая образует прочное соединение с гемоглобином и лишает его возможности транспортировать кислород. Показатель важен для диагностики сахарного диабета и оценки эффективности его лечения.
Чем опасен повышенный гемоглобин в крови
Высокий гемоглобин может быть вызван объективной нехваткой кислорода, стимулирующей организм на увеличенное производство этого белка крови. Подобная патология часто фиксируется у экипажей воздушных судов и часто летающих пассажиров, жителей высокогорья, альпинистов, горнолыжников. В силу большей потребности в кислороде повышенный уровень гемоглобина свойственен профессиональным спортсменам, преимущественно лыжникам, легкоатлетам, борцам, тяжелоатлетам. Это физиологический механизм компенсации, не вызывающий никаких медицинских опасений (кавказское долголетие — яркий тому пример).
Повысить гемоглобин может и пагубная привычка: во время курения человек вдыхает меньше кислорода, чем требуется, и организм реагирует на это выработкой дополнительного гемоглобина.
К сожалению, повышенный гемоглобин может указывать и на патологии системы кроветворения: эритроцитоз, рак крови, обезвоживание организма, порок сердца и легочно-сердечную недостаточность, а также на непроходимость кишечника[10].
Увеличенное количество гликированного гемоглобина отмечается при сахарном диабете: часть молекул Hb «перетягивает» на себя глюкозу, и для нормального дыхания требуются добавочные кислородные «контейнеры»[11].
Повышенный свободный гемоглобин в плазме фиксируется и при ожоговых поражениях вследствие разрушения эритроцитов с высвобождением из них гемоглобина[12].
Опасность высокого гемоглобина (+20 г/л от нормы и более) заключается в сгущении и увеличении вязкости крови, приводящему к образованию тромбов. Тромбы, в свою очередь, могут вызвать инсульт, инфаркт, кровотечение в ЖКТ или венозный тромбоз[13].
Гемоглобин ниже нормы: что это значит и к чему приводит
Железо — один из самых распространенных и легко добываемых химических элементов на Земле. При этом, как ни парадоксально, от дефицита железа в организме страдает больше людей, чем от какого-либо другого нарушения здоровья[14]. В группе риска население из низких социальных слоев, не получающее достаточного количества железа из продуктов питания, женщины репродуктивного возраста и дети, то есть люди, у которых «приход» элемента меньше «расхода».
Причиной низкого уровня гемоглобина (минус 20 г/л от нормы и более) зачастую являются скудное или несбалансированное питание — недостаточное поступление железа и меди, витаминов A, С и группы B или употребление железосодержащей пищи совместно с цинком, магнием, хромом или кальцием, которые не позволяют Fe усваиваться[15].
Низкие показатели могут наблюдаться у вегетарианцев, т.к. негемовое железо из растительной пищи усваивается намного хуже, чем гемовое, источником которого служат продукты животного происхождения[16].
Смежная причина — наличие кишечных паразитов, которые перехватывают поступающие микроэлементы и витамины. Усвоению железа могут также мешать проблемы с желудочно-кишечным трактом.
Заметное снижение уровня гемоглобина сопровождает кровопотери, вызванные ранениями, оперативным вмешательством, менструацией, кровотечениями, возникающими во время родов и абортов, а также при донации крови и ее компонентов.
На уровень гемоглобина влияют и скрытые кровопотери при патологии ЖКТ (язвы желудка и ДКП), варикозе, миомах и кистах органов женской половой системы, кровоточивость десен.
Причины снижения гемоглобина, возникающие во время беременности и лактации, а также осложнения, к которым они могут привести, мы рассмотрели выше. Длительный железодефицит у мужчин, детей и небеременных женщин имеют сходную симптоматику: ухудшение состояния кожи, ногтей и волос, головокружение, обмороки, онемение рук и ног, беспричинная слабость.
Кислородное голодание вследствие недостатка гемоглобина может привести к ухудшению памяти, замедлению нервных реакций, в запущенной форме — к атрофии клеток мозга и других органов и систем организма.
Усиленное кровообращение (более частый прогон гемоглобина от легких к тканям и обратно) чревато проблемами с сердцем и сосудами: кардиомиопатией и развитием сердечной недостаточности.
Низкий гемоглобин негативно отражается на буферной функции: это значит, что закисление крови подрывает иммунную защиту организма, снижает сопротивляемость простудным и инфекционным заболеваниям.
Наиболее уязвимы перед анемией дети и подростки. Острый дефицит жизненно важного минерала может сказаться на их умственном и физическом развитии[17].
Гемоглобин — незаменимый участник жизнедеятельности, на который возложены важнейшие функции: перенос кислорода и углекислого газа, сохранение кислотно-щелочного баланса, противостояние ядам. Еще одна функция — сигнальная — помогает по отклонению уровня гемоглобина от нормы выявить риски развития патологий и принять контрмеры. Таким образом, контроль и оперативная коррекция уровня гемоглобина — не прихоть врачей, а действенный способ сохранить здоровье.
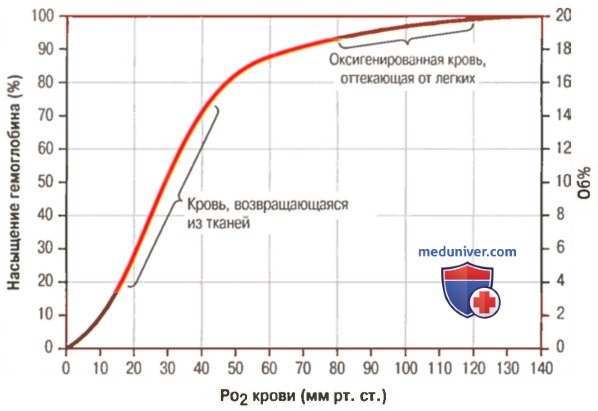
Гемоглобин. Роль гемоглобина в транспорте кислородаОбычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином. а) Обратимая связь кислорода с гемоглобином. Химический состав гемоглобина представлен в отдельных статьях на сайте, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком PO2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком PO2, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
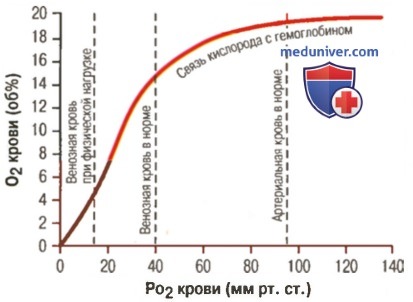
1. Кривая диссоциации оксигемоглобина. На рисунке выше приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении PO2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%. В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом. 2. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов). Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода. 3. Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови (для облегчения понимания просим вас изучить рисунок ниже). При прохождении через капилляры ткани этот объем снижается до 14,4 мл (PO2 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
4. Транспорт кислорода при тяжелой физической нагрузке. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению PO2 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст. При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 – 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое. Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение PO2 в мышечной ткани. – Также рекомендуем “Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях” Оглавление темы “Кислород и его доставка в организме”: |
Гемоглобин — железосодержащий дыхательный пигмент крови позвоночных и многих беспозвоночных животных, осуществляющий перенос кислорода от органов дыхания к тканям организма. В крови позвоночных и некоторых беспозвоночных гемоглобин содержится внутри эритроцитов в растворенном состоянии.
Молекула гемоглобина позвоночных животных состоит из белка — глобина и железосодержащей группы — гема. В состав гема входят четыре протопорфириновых кольца, каждое из которых содержит атом двухвалентного железа. Молекулярный вес гемоглобина — 66 000– 68 000. Физиологическая функция гемоглобина как переносчика кислорода основана на его способности обратимо связывать кислород в зависимости от концентрации последнего в крови. В присутствии кислорода железо гема связывает одну молекулу кислорода, при этом гемоглобин превращается в оксигемоглобин. При взаимодействии гемоглобина с окисью углерода (например, при отравлении этим газом) образуется более стабильный комплекс — карбоксигемоглобин.
Продуктами распада гемоглобина являются многочисленные железопорфириновые комплексы. При этом происходит полное отделение гема от белка (хромопротеида); это отделение протекает с превращением железа в трехвалентную форму. Получаемый железопротопорфирин называется гемином, а его соединения — геминодериватами.
Рисунок 2 – Структура гема гемоглобина
Молекула гемоглобина состоит из четырех субъединиц: двух б и двух в – и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая б-цепочка содержит 141, а в-цепочка – 146 аминокислотных остатков. Таким образом, вся молекула гемоглобина включает 574 аминокислоты. Хотя аминокислотные последовательности б- и в-цепочек различны, они имеют практически одинаковые третичные пространственные структуры. Собственно говоря, приведенные выше детали структуры относятся не к гемоглобину, а к его белковой компоненте – глобину. Каждая субъединица гемоглобина содержит одну небелковую (так называемую простетическую) группу – гем. Гем представляет собой комплекс Fe(II) с протопорфирином. Структура гемма представлена на рисунке 2.
Группировка гема представляет собой сложную копланарную циклическую систему, состоящую из центрального атома, который образует координационные связи с четырьмя остатками пиррола, соединенными метановыми мостиками (= СН -). В гемоглобине железо обычно находится в состоянии окисления (2+).
Четыре субъединицы – две б и две в – соединяются в единую структуру таким образом, что б -субъединицы контактируют только с в -субъединицами и наоборот, как показано на рисунке 3.
Рисунок 3 – Схематичное изображение четвертичной структуры гемоглобина: Fe – гем гемоглобина
Как видно из рисунка 3, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры б – ив -субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна. Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гемма [Fe(II) > Fe(III); гем > гемин]. В дезоксигемоглобине глобин предохраняет железо от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина.
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. В этом проявляется так называемый аллостерический эффект [15].
Стоит заметить, что лазерное излучение оказывает влияние на процесс оксигенации гемоглобина. Авторы работы [16] измеряли величину насыщения артериальной крови кислородом первой фаланги пальца с помощью высокочувствительного быстродействующего пульсоксиметра. Третью фалангу пальца подвергали облучению He-Ne лазера (20 мВт).
На рисунке 4 представлено изменение величины насыщения артериальной крови кислородом при воздействии лазерного излучением.
Рисунок 4 – Влияние лазерного излучения на насыщение артериальной крови кислородом
На кривой насыщения регистрируются изменения от дыхательных циклов: 40 секунд – начало воздействия, 170 секунд – окончание. Снижение насыщения гемоглобина синхронное с воздействием, демонстрирует дополнительное освобождение кислорода в результате фотодиссоциации гемоглобина. Это не может быть связано с улучшением микроциркуляции. Все происходит слишком быстро и синхронно. Таким образом, это значит, что низкоинтенсивное лазерное облучение высвобождает кислород в месте облучения. Авторы говорят о лазерно-индуцированной оксигенации тканей. Речь идет о селективном повышении локальной концентрации кислорода в тканях. Авторы объясняют этот эффект сдвигом кривой диссоциации оксигемоглобина. И обосновывают это совпадением спектра поглощения гемоглобина и оксигемоглобина с длиной волны He-Ne лазера. То есть, по мнению авторов, оксигемоглобин является акцептором фотона.
Большой интерес для исследователей представляют особенности поведения молекул газов (лигандов) в гемовом кармане гемоглобина и миоглобина. В работе [16] рассмотрены механизмы диффузии лигандов в миоглобине, строение которого очень сходно со строением в-субъединицы молекулы гемоглобина.
Результат расчетов Д. Кейза и М. Карплюса в 1979 году оказался по тем временам несколько неожиданным. Выяснилось, что скорость диффузии лиганда в белке чрезвычайно чувствительна к виду межатомных потенциалов взаимодействия, определяющих конформационную подвижность. Конформационная подвижность обусловлена возможностью вращения молекулярных групп вокруг одинарных С-С-связей [17]. В вакууме при повороте на полный угол преодолеваются обычно три потенциальных барьера высотой ~ 2-4 ккал/моль. В плотноупакованной белковой глобуле эти вращения сильно заторможены из-за стерических препятствий, и, казалось бы, ими можно пренебречь и рассматривать только небольшие колебания атомов около локальных положений равновесия. Расчет динамики связывания лиганда с миоглобином показал, что в этом случае энергия активации диффузии составляет ~ 100т ккал/моль, что примерно в 10 раз больше экспериментальной величины, и процесс при комнатных температурах практически заморожен. Этот результат полностью опроверг представление о белковой глобуле как об апериодическом микрокристаллике. Оказалось, что включение в расчет конформационных степеней свободы совершенно принципиально для белков и снижает энергию активации диффузии лиганда до приемлемого значения ~ 10 ккал/моль. Более того, оказалось, что в структуре миоглобина можно выделить два канала для проникновения лиганда из раствора в гемовый карман. Эти каналы работают с вероятностью около 60 и 40% соответственно и по своей структуре представляют систему флуктуационно открывающихся щелей (дверей), образованных аминокислотными остатками. На рисунке 5 схематически показан путь миграции СО в молекуле гемоглобина из гемового кармана параллельно гемовой плоскости через участок альфа-спирали Е по наиболее эффективному каналу. Молекула СО сначала преодолевает участок между гистидином HisE7 и валином ValEll, а затем между HisE7 и треонином ThrElo с дальнейшим выходом в растворитель.
Рисунок 5 – Схематическое изображение одного из каналов для диффузии лиганда в миоглобине
На рисунке 5 шариком указано место расположения связанного СО в гемовом кармане. Пунктир показывает путь выхода лиганда в растворитель. Плоскость рисунка параллельна гемовой плоскости и находится над ней на расстоянии 3,2 ?. Обозначены положения аминокислотных остатков с указанием спирального участка и номера остатка в спирали (HisE7, ValE11, ThrE10); положение первого аминокислотного остатка в неспирализованном участке, соединяющем спирали С и D (CD1Phe); участок одной из пропионатных боковых цепей, присоединенных к молекуле гемма (3 prop).
Рисунок 6 – Модель диффузии в структурированной среде (белке)
При раскрытии флуктуационной щели на величину х>x0 субстрат 1 может диффундировать сквозь щель. Диффузия субстрата 2 сильно затруднена, так как требуется большая деформация щели (большая энергия активации).
Рисунок 6 иллюстрирует общую схему процесса диффузии через флуктуирующую щель, образованную элементами структуры белковой глобулы. Суть состоит в том, что для акта диффузии необходимо, чтобы просвет во флуктуирующей щели был не меньше, чем ванн-дер-ваальсов размер лиганда. Энергия активации диффузии при этом будет определяться соответствующей энергией раскрытия щели. В жидкостях на форму флуктуационной полости или дырки практически не накладывается существенных ограничений. В белковой глобуле это не так. Здесь имеется относительно жесткий упругий каркас, образованный спиральными элементами структуры. Подвижные боковые группы обеспечивают формирование дырки для диффузионного проникновения лиганда. Но форма этой дырки или щели диктуется локальной геометрией белковой структуры. В твердых телах геометрические ограничения еще более жесткие, но в этом случае в отличие от белка нет подвижных боковых групп, обеспечивающих раскрытие щелей с приемлемой энергией активации. Таким образом, белковая глобула представляет собой структурированную среду, в которой подвижная часть похожа на вязкую жидкость, но возможные формы флуктуационных полостей и щелей ограничены упругим каркасом [19]. Проникновение внутрь белковой глобулы молекул (лигандов), геометрия которых не соответствует этим формам, будет сильно затруднено, так как потребует более широкого раскрытия щелей и соответственно значительно большей энергии активации. На этом этапе с точки зрения физики и закладываются основы стереоспецифичности биохимических процессов.