Аллостерические свойства гемоглобина это
274-275
Òêàíè è îðãàíû. Êðîâü
Ãåìîãëîáèí
 Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
(ñì. ñ. 268)
òðàíñïîðò êèñëîðîäà îò ëåãêèõ â òêàíè è ÑÎ2 îò òêàíåé
îáðàòíî â ëåãêèå. Âûñøèå îðãàíèçìû íóæäàþòñÿ äëÿ ýòîãî â ñïåöèàëüíîé
òðàíñïîðòíîé ñèñòåìå, òàê êàê ìîëåêóëÿðíûé êèñëîðîä ïëîõî ðàñòâîðèì â âîäå:
â 1 ë ïëàçìû êðîâè ðàñòâîðèìî òîëüêî îêîëî 3,2 ìë Î2.
Ñîäåðæàùèéñÿ â ýðèòðîöèòàõ áåëîê ãåìîãëîáèí (Hb) ñïîñîáåí ñâÿçàòü
â 70 ðàç áîëüøå 220 ìë Î2/ë. Ñîäåðæàíèå Hb â êðîâè ñîñòàâëÿåò
140-180 ã/ë ó ìóæ÷èí è 120-160 ã/ë ó æåíùèí, ò. å. âäâîå âûøå ïî ñðàâíåíèþ ñ
áåëêàìè ïëàçìû (50-80 ã/ë). Ïîýòîìó Hb âíîñèò íàèáîëüøèé âêëàä â îáðàçîâàíèå
ðÍ-áóôåðíîé åìêîñòè êðîâè (ñì. ñ. 280).
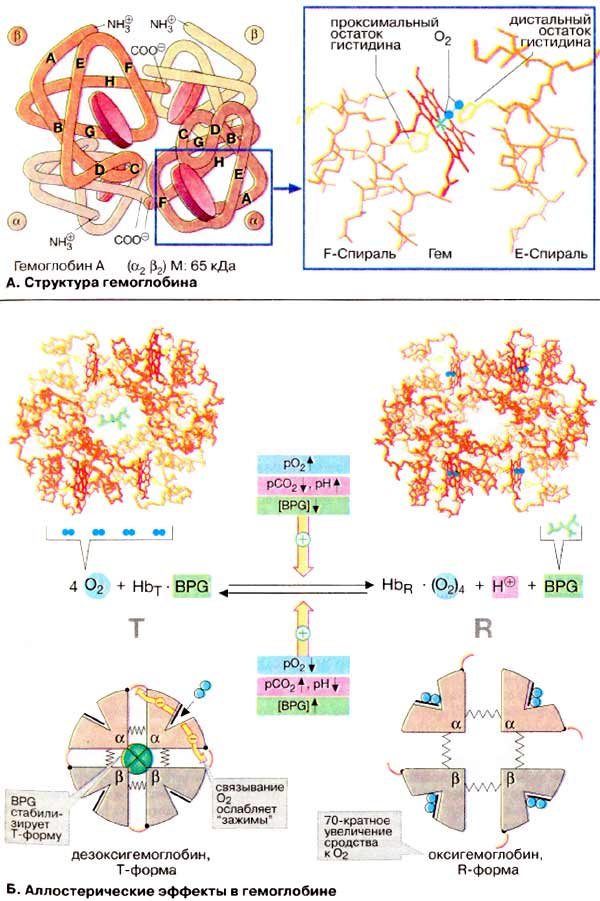
À. Ñòðóêòóðà
ãåìîãëîáèíà
Ãåìîãëîáèí âçðîñëîãî îðãàíèçìà
(HbA, ñì. íèæå) ÿâëÿåòñÿ òåòðàìåðîì, ñîñòîÿùèì èç äâóõ α- è äâóõ
β-ñóáüåäèíèö ñ ìîëåêóëÿðíûìè ìàññàìè ïðèìåðíî 16 êÄà. α- è β-öåïè îòëè÷àþòñÿ
àìèíîêèñëîòíîé ïîñëåäîâàòåëüíîñòüþ, íî èìåþò ñõîäíóþ êîíôîðìàöèþ. Ïðèìåðíî 80%
àìèíîêèñëîòíûõ îñòàòêîâ ãëîáèíà îáðàçóþò α-ñïèðàëè, îáîçíà÷åííûå áóêâàìè
À-Í (ñì. ñõåìó). Êàæäàÿ ñóáúåäèíèöà íåñåò ãðóïïó ãåìà (ôîðìóëó ñì. íà ðèñ.
197) ñ èîíîì äâóõâàëåíòíîãî æåëåçà â öåíòðå. Ïðè ñâÿçûâàíèè
O2ñ àòîìîì æåëåçà â ãåìå (îêñèãåíàöèÿ Hb) è îòùåïëåíèè
O2 (äåçîêñèãåíàöèÿ) ñòåïåíü îêèñëåíèÿ àòîìà æåëåçà íå
ìåíÿåòñÿ. Îêèñëåíèå Fe2+ äî Fe3+ â ãåìå íîñèò ñëó÷àéíûé
õàðàêòåð. Îêèñëåííàÿ ôîðìà ãåìîãëîáèíà, ìåòãåìîãëîáèí, íå ñïîñîáíà
ïåðåíîñèòü O2. Äîëÿ ìåòãåìîãëîáèíà ïîääåðæèâàåòñÿ ôåðìåíòàìè íà
íèçêîì óðîâíå è ñîñòàâëÿåò ïîýòîìó îáû÷íî òîëüêî 1-2%.
×åòûðå èç øåñòè êîîðäèíàöèîííûõ ñâÿçåé
àòîìà æåëåçà â ãåìîãëîáèíå çàíÿòû àòîìàìè àçîòà ïèððîëüíûõ êîëåö, ïÿòàÿ
îñòàòêîì ãèñòèäèíà ãëîáèíà (ïðîêñèìàëüíûé îñòàòîê ãèñòèäèíà), à øåñòàÿ
ìîëåêóëîé êèñëîðîäà â îêñèãåìîãëîáèíå è, ñîîòâåòñòâåííî, Í2Î â
äåçîêñèãåìîãëîáèíå.
Á. Àëëîñòåðè÷åñêèå ýôôåêòû â
ãåìîãëîáèíå
Àíàëîãè÷íî àñïàðòàò-êàðáàìîèëòðàíñôåðàçå
(ñì. ñ. 118) Hb ìîæåò íàõîäèòüñÿ â äâóõ ñîñòîÿíèÿõ (êîíôîðìàöèÿõ):
îáîçíà÷àåìûõ êàê Ò- è R-ôîðìû ñîîòâåòñòâåííî. Ò-Ôîðìà (íàïðÿæåííàÿ îò
àíãë. tense) îáëàäàåò ñóùåñòâåííî áîëåå íèçêèì ñðîäñòâîì ê O2
ïî ñðàâíåíèþ ñ R-ôîðìîé (íà ñõåìå ñïðàâà). Ñâÿçûâàíèå O2 ñ îäíîé èç
ñóáúåäèíèö Ò-ôîðìû ïðèâîäèò ê ëîêàëüíûì êîíôîðìàöèîííûì èçìåíåíèÿì, êîòîðûå
îñëàáëÿþò ñâÿçü ìåæäó ñóáúåäèíèöàìè. Ñ âîçðàñòàíèåì ïàðöèàëüíîãî äàâëåíèÿ
O2 óâåëè÷èâàåòñÿ äîëÿ ìîëåêóë Hb â âûñîêîàôôèííîé R-ôîðìå (îò àíãë.
relaxed). Áëàãîäàðÿ êîîïåðàòèâíûì âçàèìîäåéñòâèÿì ìåæäó ñóáúåäèíèöàìè ñ
ðîñòîì êîíöåíòðàöèè êèñëîðîäà ïîâûøàåòñÿ ñðîäñòâî Hb ê O2, â
ðåçóëüòàòå ÷åãî êðèâàÿ íàñûùåíèÿ èìååò ñèãìîèäàëüíûé âèä (ñì. ñ
276).
Íà ðàâíîâåñèå ìåæäó Ò- è R-ôîðìàìè
âëèÿþò ðàçëè÷íûå àëëîñòåðè÷åñêèå ýôôåêòîðû, ðåãóëèðóþùèå ñâÿçûâàíèå
O2 ãåìîãëîáèíîì (æåëòûå ñòðåëêè). Ê íàèáîëåå âàæíûì ýôôåêòîðàì
îòíîñÿòñÿ CO2, Í+ è 2,3-äèôîñôîãëèöåðàò [ÄÔÃ (BPG)]
(ñì. ñ. 276).
Äîïîëíèòåëüíàÿ
èíôîðìàöèÿ
Hb âçðîñëîãî îðãàíèçìà ñîñòîèò, êàê
óïîìÿíóòî âûøå, èç äâóõ α- è äâóõ β-öåïåé (α2β2). Íàðÿäó ñ
ýòîé îñíîâíîé ôîðìîé (HbA1) â êðîâè ïðèñóòñòâóþò
íåçíà÷èòåëüíûå êîëè÷åñòâà âòîðîé ôîðìû ñ áîëåå âûñîêèì ñðîäñòâîì ê
O2, ó âòîðîé β-öåïè çàìåíåíû δ-öåïÿ-ìè (HbA2,
α2δ2). Äâå äðóãèå ôîðìû Hb âñòðå÷àþòñÿ òîëüêî â
ýìáðèîíàëüíîì ïåðèîäå ðàçâèòèÿ. Â ïåðâûå òðè ìåñÿöà îáðàçóþòñÿ ýìáðèîíàëüíûå
ãåìîãëîáèíû ñîñòàâà ξ2ε2 è α2γ2.
Çàòåì âïëîòü äî ðîæäåíèÿ äîìèíèðóåò ôåòàëüíûé ãåìîãëîáèí (HbF,
α2δ2), êîòîðûé ïîñòåïåííî çàìåíÿåòñÿ íà ïåðâîì ìåñÿöå
æèçíè íà HbÀ. Ýìáðèîíàëüíûé è ôåòàëüíûé ãåìîãëîáèíû îáëàäàþò áîëåå âûñîêèì
ñðîäñòâîì ê Î2 ïî ñðàâíåíèþ ñ HbÀ, òàê êàê îíè äîëæíû ïåðåíîñèòü
êèñëîðîä èç ñèñòåìû ìàòåðèíñêîãî êðîâîîáðàùåíèÿ.
Аллостерические свойства гемоглобина обусловлены взаимодействием его а- и р субъединиц. Жесткость Т-формы (напряженной) четвертичной структуры определяется образованием солевых связей между субъединицами, что обусловливает низкое сродство к кислороду, в R-форме эти меж-субъединичные связи отсутствуют и сродство к кислороду высокое. При оксигенировании атом железа перемещается в плоскость гема и подтягивает за собой проксимальный гистидин. При этом перемещении начинают расщепляться солевые связи и происходит сдвиг равновесия от Т-формы к R-форме. Присоединение к гемоглобину четвертой молекулы О 2 происходит значительно легче, чем присоединение первой, так как требует разрыва меньшего числа солевых связей. БФГ связывается с положи- [c.85]
Фосфорилирование фермента не отражается на ферментативной активности при pH 8,0. Однако фосфорилирование белка оказывает влияние на аллостерические свойства фермента повышается чувствительность к ингибированию АТФ и цитратом, но снижается чувствительность к активирующему действию АМФ и фруктозо-2,6-дифосфата. Предполагают, что фосфорилирование индуцирует конформацион-ные изменения, способствующие смещению равновесия между двумя формами фермента активной и неактивной. При связывании АТФ в ингибиторном центре также происходит смещение равновесия в сторону неактивной конформационной формы фосфофруктокиназы. [c.238]
Аллостерические свойства белка, способность его изменять активность под влиянием метаболитов, очень убедительно свидетельствуют о том, что уже в молекуле белка заложены основные механизмы, позволяющие осуществлять регулирование на более высоком уровне,— белок словно предназначен для того, чтобы служить средством для построения более сложных систем регуляции. [c.188]
Аллостерические свойства фосфофруктокиназы [c.240]
Для изучения аллостерических свойств фермента используют реакционную смесь с низким значением pH (указаны конечные концентра- [c.240]
Использование метаболитов, меченных дало возможность проследить их судьбу в интактных организмах и, следовательно, понять физиологическую роль тех биохимических последовательностей, в которых эти метаболиты участвуют. Однако, как будет видно из последующих рассуждений, интерпретация результатов, полученных при использовании радиоактивных изотопов, сопряжена с определенными трудностями. Во-первых, как мы видели, одно и то же соединение может принимать участие сразу в нескольких метаболических процессах, а во-вторых, благодаря аллостерическим свойствам ферментов метаболиты, участвующие в одном ка-ком-нибудь процессе, могут изменять скорости реакций другого процесса. Помимо активного центра, к которому присоединяется субстрат, Б молекуле фермента может иметься другой участок, способный присоединяться к другому метаболиту, не являющемуся субстратом. Дальнейшим превращениям присоединившийся метаболит подвергаться не будет, однако в результате его присоединения может измениться конфигурация молекулы фермента, что в свою очередь может изменить скорость катализируемой реакции. Это обстоятельство нельзя упускать из виду при изучении распределения радиоактивности после добавления меченого метаболита к сложной ферментной системе. Такие трудности, возникающие при использовании радиоактивных изотопов, рассмотрим на более подробном примере изучения некоторых систем, проведенного Г. Кребсом [29]. [c.21]
Сигмоидальная зависимость между скоростью реакции и кон-дентрацией субстрата, 2. Тот же фермент в присутст зии положительного эффектора (активатора). 3. Тот же фермент в присутствии отрицательного эффектора (ингибитора). Пунктирная кривая соответствует кинетической кривой Михаэлиса — Мен-теи для фермента, не обладающего аллостерическими свойствам и. [c.58]
Свойства индивидуальных гемоглобинов неразрывно связаны с их четвертичной, равно как и вторичной и третичной, структурами. Наиболее распространенные гемоглобины имеют следующую тетра-мерную структуру НЬА (нормальный гемоглобин взрослого человека)—а Р НЬР (фетальный гемоглобин)—агУг НЬ8 (гемоглобин при серповидноклеточной анемии)—НЬАг (минорный гемоглобин взрослого человека)—а б . Четвертичная структура наделяет гемоглобин дополнительными важными особенностями (отсутствующими у миоглобина), которые способствуют выполнению гемоглобином его уникальной биологической функции и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от треч. аллос—другой, стерос— место, пространство), и на его примере можно лучше понять свойства других аллостерических белков. [c.56]
Дальнейший анализ аллостерических свойств ферментов привел к выводу, что они могут обладать значительно большим, чем один, числом каталитических центров. Это означает, что к молекуле фермента может присоединиться п молекул субстрата (п > 1). Изменив стехиометрию реакции фермента с субстратом, получаем цепочку [c.64]
Рекомбинантные ферменты, обладающие аллостерическими свойствами, могут быть использованы для создания новых био-Сенсоров. В частности, попытки проведения модификаций такого рода были предприняты в отношении щелочной фосфатазы [184]. Пептидные эпитопы, специфичные для ВИЧ типа I и вируса гепатита С, были встроены в полипептидную цепь щелочной фосфатазы, после чего исследовали влияние антител к этим эпи-Тонам на активность рекомбинантных ферментов. Установлено, что антитела снижали на 20% активность гибридных ферментов. Полученных на основе щелочной фосфатазы дикого типа, однако [c.381]
Приведенные примеры иллюстрируют первые шаги, сделанные на пути конструирования ферментов с аллостерическими свойствами. Полученные результаты показывают потенциальную плодотворность данного направления исследований. Однако для наиболее полного воплощения этих идей в жизнь при конструировании таких полипептидов необходимо учитывать пространственные особенности взаимодействия объединяемых каталитических доменов в гибридных белках, а это невозможно без понимания связей между первичной и пространственной структурами изучаемых полипептидов, что, впрочем, относится и ко всей области рационального дизайна белковых молекул. Интенсивные структурные исследования белков с высоким разрешением и молекулярное моделирование в конце концов позволят решать такого рода проблемы. [c.382]
В настоящее время не вызывает сомнения, что решающая роль в механизме кооперативной регуляции активности принадлежит конформационной подвижности белков. Поскольку иммобилизация иногда существенно ограничивает ее, то кооперативные и аллостерические свойства олигомерных ферментов в иммобилизованном состояния часто отличаются от свойств этих ферментов в гомогенном растворе. При этом иногда уменьшается или даже совсем исчезает 8-образный характер зависимости скорости реакции от концентрации субстрата или аллостери-ческого лиганда. Эти зависимости могут трансформироваться в сигмоидальные, которые характерны для ферментов, действующих в соответствии с кинетическим уравнением Михаэлиса — Ментен. [c.117]
П о л я н о в с к и й о. Л. (1971) Четвертичная структура и аллостерические свойства ферментов. В кн. Биологическая химия, Изд-во ВИНИТИ, М., 6—56. [c.92]
Модель Кошланда и др. является более общей и, вероятно, лучше описывает аллостерические свойства некоторых белков, чем модель Моно и др., хотя интерпретация экспериментальных данных в этом случае часто бывает несколько более сложной. [c.259]
Изменена четвертичная структура. Некоторые мутации, затрагивающие участки области контактов, приводят к потере аллостерических свойств. В результате нарушается сродство таких гемоглобинов к О2. [c.99]
Более того, реконструированный фермент обладает такими же аллостерическими свойствами, как и нативный фермент, [c.266]
Известно больщое число ферментов со причин отклонения от кинетики Михаэлиса— Ментен может быть связана с аллостерическими свойствами фермента. Для регуляторных ферментов кривая зависимости скорости реакции от концентрации субстрата часто имеет сигмоидальную форму. При наличии 5-образности резкое увеличение активности происходит в узкой области концентрации субстрата, что может иметь важное значение для функционирования фермента в клетке. В аллостерической регуляции ферментативной активности принимают участие не только [c.214]
Встречается и обратная ситуация, когда 5-образная кривая в присутствии аллостерического эффектора превращается в гиперболическую. Например, пируваткиназа скелетных мышц характеризуется кинетикой Михаэлиса, но в присутствии аллостерического ингибитора (фенилаланина) кривая зависимости скорости реакции от концентрации субстрата становится 5-образной, при этом сродство фермента к субстрату (фосфоенолпирувату) уменьшается. Изменение кинетических свойств под действием аллостерических эффекторов обусловлено конформационной перестройкой молекулы белка. С помощью сшивающих реагентов или каких-либо других воздействий на структуру белка можно наблюдать потерю чувствительности фермента к аллосте-рическим эффекторам. Для выявления аллостерических свойств иногда необходимо изменить условия определения активности сместить pH реакционной среды в кислую или щелочную область от рН-оптимума или исследовать влияние эффектора при ненасыщенной концентрации субстрата. [c.215]
С явлением аллостеризма, с кооперативными свойствами олигомерных белков, играющих регуляторную роль, приходится, по-видимому, встречаться во многих биологических процессах. Есть основания думать, что аллостерическими свойствами обладают функциональные белки мембран и сократительные белкм. Аллостеризм представляет собой важнейший механизм обратной связи на молекулярном уровне. [c.461]
По-видимому, фермент чувствителен как к аминокислоте, так и к структуре тРНК как целого. Мы еще очень мало об этом знаем. Не исключено, что фермент обладает аллостерическими свойствами (см. 7.5). [c.592]
Константа Михаэлиса Аллостерические свойства Субстрат и кофактор Внутриклеточная локализация Влияние гормонов Гексокиназа, пируваткиназа, глутаминаза, креатинкиназа Гексокиназа, пируваткиназа, аспартаткиназа Альдолаза, изоцитратдегидрогеназа Аргиназа, малатдегидрогеназа Пируваткиназа, гексокиназа [c.83]
Знание аллостерических свойств фосфофруктокиназы позволяет сделать следующий вывод если аэробно раступще дрожжевые клетки или [c.493]
Интересно, что аллостерическими свойствами обладают и не только ферментные белки, но и белки, выполняющие иные функции, например гемоглобин это обстоятельство указывает на универсальность аллостеризма как важнейшего средства регулирования. Регулирования деятельности той или иной цепочки ферментов по описанному принципу недостаточно для того, чтобы клетка получала все необходимые ей белки с надлежащей скоростью и в нужных относительных количествах. [c.188]
Фосфофрукто киназа занимает ключевое место в гликолитиче-ском цикле и участвует во многих контрольных механизмах. Большинство работ было направлено на выяснение именно этой роли фермента, например на изучение его аллостерических свойств [96]. Последнее не относится к теме данной главы. [c.683]
Различные структурные (Повреждения молекул клетки могут привести к разнообразным функциональным нарушениям, составляющим последнюю, биологическую, стадию действия излучения. Ферменты в этом случае утрачивают каталитические свойства, субстратную специфичность, чувствительность к соответствующим активаторам и ингибиторам или аллостерические свойства. Различные типы инактивации имеют неодинаковые последствия для клеточного гомеостаза одни ферменты оказываются исключенными из цепи метаболических реакций, другие нарабатывают токсические продукты, третьи Дерестают регулироваться соответствующими эффекторами [c.129]
Одна серия экспериментов, выполненная в лаборатории Кошленда (Brown, Koshland, 1975), основана на исследовании способности F -фрагмента к фиксации комплемента в результате связывания антителом антигена. В этих опытах использовали IgM-антитела против бета-лактозида. Сам по себе этот гаптен не индуцировал комплементсвязывающую активность. Только после присоединения к неспецифическому белковому носителю (РНКаза с одним гаптеном на моль) он приобрел способность вызывать такую активность. Поскольку такой антиген был моновалентен, то он не мог обусловить агрегацию или поперечную сшивку молекул IgM—антител, что, как известно, может явиться причиной активации системы комплемента. Другое объяснение, а именно, что функционирование определенных участков F -фрагментов зависит от конформационных изменений вследствие связывания антигена в активном центре, является более вероятным. Это объяснение предполагает наличие аллостерических свойств у иммуноглобулинов. [c.31]
Оз, которое нечувствительно к изменению pH, концентрации СОз и содержанию БФГ. Изолированные р-цепи легко образуют тетрамер к. назьгеаемый гемоглобином Н. Подобно а-цепи и миоглобину, р полностью лишен аллостерических свойств. Отсюда следует, что аллостерические свойства гемоглобина возникают в результате взаимодействия субъединиц. Функциональная единица гемоглобина-это тетрамер, состоящий из полипептидных цепей двух типов. [c.75]
Для функционирования гемоглобина в качестве эффективного переносчика кислорода необходимо сохранение всех его аллостерических свойств. Целостность участка, связывающего гем, и правильная укладка субъединиц гемоглобина-условие необходимое, но отнюдь не достаточное для полноценного функционирования. Важная роль принадлежит аминокислотным остаткам, локализованным в области контактов между субъединицами, так как некоторые из этих остатков передают информацию от одной субъединицы к другой. Контакты между одноименными субъединицами гемоглобина немногочисленны и по своей природе полярны, тогда как контакты между разноименными субъединицами обширны и в основном неполярны. Существуют два типа контактов между а- и Р-цепями, обозначаемые соответственно а Р и ахРз- Как уже отмечалось, а 1Р2-контакт играет, по-видимому, ключевую роль в передаче аллостерических взаимодействий,-судя по тому, что именно в этой области наблюдается значительное перемещение атомов при оксигенировании гемоглобина. Об этом свидетельствует и тот факт, что почти все гемогло-вины с заменами в области а1Р2 онтактов проявляют пониженную кооперативность. Более того, обычно и сродство этих гемоглобинов к кислороду отличается от нормы. [c.100]
Обнаружение того факта, что в митохондриях происходит образование оксалоацетата из пирувата, привело Мертона Аттера (Merton Utter) к открытию в 1960 г. пируват-карбоксилазы. Этот фермент представляет особый интерес из-за его каталитических и аллостерических свойств. Пируват-кар-боксилаза содержит ковалентно присоединенную простетическую группу, биотин, который функционирует в качестве переносчика активированного СО2- [c.107]
Биофизика Т.1 (1997) — [
c.64
]
