Анемия фанкони у детей

Анемия Фанкони – это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения – пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
Общие сведения
Синонимичные названия анемии Фанкони – врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие – 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
Анемия Фанкони
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена – 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга – неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом – злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
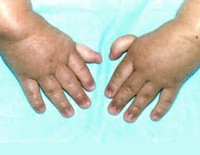
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования – лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних – панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень – 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ клеток. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% – в аллели FANCC, в 10% – в генах FANCG. Частота мутаций в других парах – 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток – в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ. Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции – до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста – эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты – донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.

Впервые столкнувшись с диагнозом «анемия Фанкони», любой человек задастся вполне логичным вопросом – что это такое и как эта патология проявляется. Анемия Фанкони – это генетическая болезнь, которая встречается очень редко. При этом человек страдает от нарушения кровообращения, выражающееся в снижении численности всех клеток крови.
Впервые о заболевании стало известно в 1927 году благодаря швейцарскому педиатру Гвидо Фанкони. Он описал историю болезни трех мальчиков из одной семьи, которые страдали панцитопенией, также у них были обнаружены определенные отклонения в физическом развитии.
Анемия Фанкони диагностируется редко, примерно у пяти человек из 1 миллиона в год. Чаще всего от нее страдают жители Южной Африки. Подавляющее число заболевших являются мальчиками.
Содержание:
- Причины анемии Фанкони у детей
- Симптомы анемии Фанкони у детей
- Диагностика
- Лечение
Причины анемии Фанкони у детей
Этиология анемии Фанкони сводится к генетическим аномалиям. Наследуется данная мутация генов по аутосомно-рецессивному пути. Если оба родителя являются носителями мутированного гена, то вероятность рождения у них больного ребенка приравнивается к 25%. В редких случаях анемия Фанкони может передаваться мальчикам только от матери.
Современной науке известно 15 генов, дефекты которых могут приводить к развитию болезни. Один из них располагается на Х-хромосоме, а остальные на аутосомах. Они кодируют белки, которые необходимы для репарации ДНК.
В результате чего в организме больного происходят следующие изменения:
Структура стволовых клеток нарушается.
Хромосомы становятся ломкими.
Все три ростка кроветворения в костном мозге страдают и не в состоянии выполнять свою функцию.
Клетки крови созревают долго.
Взрослые эритроциты погибают раньше положенного времени.
Симптомы анемии Фанкони у детей

Впервые болезнь проявляет себя в возрасте 4-10 лет, при рождении анемия Фанкони диагностируется редко.
К ее ранним симптомам относят:
Кровотечения, которые развиваются спонтанно.
Появление подкожных гематом.
Бледность кожи, бледность слизистых оболочек.
Повышенная утомляемость, вялость.
Ребенок болеет чаще своих сверстников, так как его иммунная система не работает в полную силу. Возможно развитие лимфаденопатии.
Большинство людей, страдающих анемией Фанкони, имеют врожденные дефекты развития. Они диагностируются примерно у 75% больных.
К ним относят:
Гиперпигментация кожных покровов с появлением характерных бронзово-коричневых пятен и пятен «кофе с молоком». К изменению цвета кожи приводит чрезмерное отложение меланина в базальном слое эпидермиса.
Плохое состояние зубов и ногтей.
Низкий рост.
Маленькая голова.
Косолапость, врожденный вывих бедра, отсутствие пальцев на руках, либо их укорочение, слабое развитие лучевой кости, шейное ребро.
Нарушения в умственном развитии.
Косоглазие, птоз.
Недоразвитие глаз (одного или двух).
Глухота.
Гипоплазия половых органов, монорхизм, аномальное расположение мочеиспускательного канала.
Патологии развития почек: наличие двух лоханок или мочеточников, недоразвитие органов, формирование почки в виде подковы, наличие кист в почках.
Пороки сердца.
Перечисленные нарушения развития могут присутствовать не всегда и не в полном объеме, даже если от анемии Фанкони страдают члены одной семьи. Чем старше становится человек, тем сильнее нарушаются кроветворные функции костного мозга.
В период от 15 до 25 лет у больных сохраняется высокий риск развития раковых патологий:
Лейкоз.
Карцинома языка.
Опухоли пищевода.
Опухоли печени.
Диагностика

Диагностика анемии Фанкони находится в компетенции специалистов. Самостоятельно выставить диагноз не удастся. Заболевание может встречаться у людей, которые не имеют врожденных пороков развития и проявляться только во взрослом возрасте. Поэтому помимо внешних симптомов, следует тщательно изучить семейный анамнез.
Проведение общего анализа крови на ранних этапах развития болезни будет давать картину тромбоцитопении и лейкопении. По мере прогрессирования патологии увеличивается уровень фетального гемоглобина на фоне снижения всех клеток крови (панцитопения).
Для подтверждения диагноза проводят тест с диэпоксибутаном или митомицином С. Также выявляют эффект накопления мононуклеарных клеток периферической крови в фазе G2/М. Подтвердить патологию позволяет установление мутированных генов.
Обследование пациентов предполагает выполнение миелограммы (изучение клеток костного мозга с помощью пункции).
Лечение

Лечение анемии Фанкони базируется на проведении трансплантации стволовых клеток, назначении андрогенов и выполнении заместительной терапии.
Если уровень ферритина в крови превышает 1000 нг/мл, то проводят хелаторную терапию. При снижении численности нейтрофилов менее 500 кл/мл, назначают андрогены (оксиметалон, метандростенолон) и гемопоэтические факторы роста. Эффект от проводимого лечения можно будет заметить не ранее, чем через месяц от его начала. Выраженная гипоксия требует переливания тромбоцитарной и/или эритроцитарной массы. В некоторых случаях удаляют селезенку.
Если ребенку не выполнялась трансплантация костного мозга, то ему ставят прививки неживыми вакцинами, а также выполняют пробу Манту.
Осложняет течение болезни наличие злокачественных новообразований. Это делает терапию сложной и зачастую малоэффективной, особенно при необходимости проведения лучевой терапии. Клетки больного отличаются повышенной чувствительностью к такому воздействию, что обуславливает высокую токсичность и вероятность летального исхода.
Средняя продолжительность жизни людей с анемией Фанкони составляет 30 лет, хотя все зависит от того, насколько глубоко поврежден костный мозг.
Больной должен состоять на учете у гематолога, что позволяет осуществлять мониторинг его здоровья, на ранних стадиях обнаруживать и лечить раковые новообразования, геморрагические осложнения и инфекции.
Общие принципы ведения больных с анемией Фанкони:
Щадящий режим жизни.
Избегание контактов с канцерогенами, например, с краской для волос, органическими растворителями и пр.
Защита от переохлаждения.
Своевременное лечение вирусных и бактериальных инфекций.
Качественное питание.
Один раз в год больной должен осматриваться узкими специалистами (кардиолог, нефролог, офтальмолог и пр.). Посещать гематолога потребуется 1 раз в 1-3 месяца или даже чаще.
Миелограмму выполняют 1 раз в год, а 1 раз в полгода проводят УЗИ внутренних органов.
В некоторых случаях дети переводятся на домашнее обучение, их ограничивают в физических нагрузках.
Ребенок с анемией Фанкони признается инвалидом детства. Во взрослом возрасте человек должен пройти МРЭК для получения инвалидности.
Единственным методом, который дает возможность избавиться от анемии Фанкони – это пересадка костного мозга. Однако эта процедура сопряжена с рядом трудностей. Достаточно сложно подобрать донора, идеальным носителем костного мозга для пересадки является однояйцевый близнец. Пересадка требует проведения лучевой или химиотерапии, что может спровоцировать серьезные осложнения, вплоть до летального исхода.
Меры по профилактике анемии Фанкони сводятся к выполнению генетических исследований на этапе планирования беременности.
Без лечения 80% больных погибают спустя 2 года после постановки диагноза. Через 4 года эта цифра приравнивается к 100%. Поэтому терапия детей с анемией Фанкони является жизненной необходимостью.
Автор статьи: Соколова Прасковья Федоровна | Педиатр
Образование:
Диплом по специальности «лечебное дело» получен в Волгоградском государственном медицинском университете. Тут же получен сертификат специалиста в 2014 г.
Наши авторы
Что такое анемия Фанкони?
Анемия Фанкони (сокр. АФ) — редкое генетическое заболевание в категории синдромов наследственной недостаточности костного мозга. Половина пациентов диагностируется до 10 лет, а около 10% заболевания диагностируются уже во взрослой жизни.
Больные пациенты страдают врожденными дефектами, такими как небольшой рост, ненормально большие пальцы и/или лучевые кости, пигментация кожи, маленькая голова, маленькие глаза, аномальные структуры почек, а также аномалии сердца и скелета.
Нарушение часто связано с прогрессирующим дефицитом всей продукции костного мозга клеток крови — эритроцитов, лейкоцитов и тромбоцитов. Пострадавшие люди имеют повышенный риск развития рака кроветворных клеток в костном мозге, называемого острым миелоидным лейкозом (ОМЛ), или опухолей головы, шеи, кожи, желудочно-кишечного тракта или половых путей.
Анемия Фанкони встречается одинаково у мужчин и женщин, и во всех этнических группах. Обычно он наследуется как аутосомно-рецессивное генетическое заболевание, но также сообщалось о Х-сцепленном наследовании.
Существует несколько подтипов АФ, которые являются результатом наследования двух генных мутаций в каждом из по меньшей мере 18 различных генов. Большинство подтипов имеют характерные симптомы и признаки. Анемия Фанкони — это не то же самое, что синдром Фанкони, редкое нарушение функции почек.
Признаки и симптомы
Симптомы анемии Фанкони варьируются от человека к человеку. Выявленные симптомы включают различные физические отклонения, недостаточность костного мозга и повышенный риск развития злокачественных новообразований. Физические отклонения обычно проявляются в раннем детстве, но в редких случаях диагнозы ставятся во взрослом возрасте. Проблемы с производством крови часто развиваются в возрасте 6-8 лет.
В большинстве случаев пораженный костный мозг встречается у большинства больных, хотя прогрессирование и возраст возникновения различаются. Пациенты, которые живут в зрелом возрасте, могут развить рак головы и шеи, гинекологический и/или желудочно-кишечный рак в гораздо более раннем возрасте, чем население в целом, независимо от того, были ли у них более ранние проблемы с кровью.
— Физические аномалии.
По крайней мере 60% людей, страдающих АФ, рождаются как минимум с одной физической аномалией. Аномалия могут включать любое из следующего:
- низкий рост;
- аномалии большого пальца и руки: лишние пальцы, деформация или отсутствие больших пальцев или не полностью развитый или отсутствие одной из костей предплечья;
- аномалии скелета бедер, позвоночника или ребер;
- структурные проблемы с почками;
- пигментация кожи;
- маленькая голова;
- маленькие, скрещенные или широко расставленные глаза;
- низкая масса тела при рождении;
- желудочно-кишечные проблемы;
- маленькие репродуктивные органы у мужчин;
- дефекты в тканях, разделяющих камеры сердца.
Люди с анемией могут испытывать:
- усталость;
- повышенную потребность во сне;
- слабость;
- головокружение;
- раздражительность;
- головные боли;
- бледный цвет кожи;
- затрудненное дыхание;
- сердечные симптомы.
Могут быть чрезмерные кровоподтеки после минимальной травмы и спонтанные кровотечения из слизистых оболочек, особенно десен и носа.
— Недостаточность костного мозга.
Костный мозг — губчатое вещество, находящийся в центре длинных костей тела. Костный мозг производит специализированные клетки (гемопоэтические стволовые клетки), которые растут и в конечном итоге развиваются в эритроциты (красные кровяные клетки), лейкоциты (белые кровяные клетки) и тромбоциты. Клетки попадают в кровоток, чтобы путешествовать по всему телу, выполняя свои специфические функции. Красные кровяные клетки доставляют кислород в организм, белые кровяные клетки помогают бороться с инфекциями, а тромбоциты позволяют организму образовывать сгустки, останавливая кровотечение.
Прогрессирующая недостаточность костного мозга обычно проявляется к 10 годам и обычно сопровождается низким уровнем тромбоцитов или низким уровнем лейкоцитов. К возрасту 40-50 лет предполагаемая частота недостаточности костного мозга как первого серьезного события составляет более 50%.
У пострадавших развивается низкий уровень всех клеточных элементов костного мозга — красных и белых кровяных клеток и тромбоцитов, что может привести к следующему:
- низкому уровню циркулирующих эритроцитов — анемия;
- низкому уровню лейкоцитов — лейкопения;
- низкому уровню нейтрофилов (тип лейкоцитов) — нейтропения;
- низкому уровню тромбоцитов — тромбоцитопения;
— Повышенный риск развития злокачественных новообразований.
Люди с АФ имеют более высокий риск развития определенных форм рака, включая острую миелоидную лейкемию и специфические солидные опухоли, чем население в целом.
Пострадавшие люди могут иметь чрезвычайно высокий риск развития рака, поражающего область головы и шеи, желудочно-кишечный тракт, пищевод или гинекологические области. Большинство из них представляют собой специфическую форму рака, известную как плоскоклеточный рак. У пациентов с АФ, у которых недостаточность костного мозга лечится мужскими гормонами (так называемыми «андрогенами»), повышен риск развития рака печени.
Примерно в 30 процентах случаев, связанных с раком, развитие злокачественной опухоли предшествует диагнозу АФ.
Причины анемии Фанкони
Хромосомы в клетках индивидуумов с анемией Фанкони не способны восстановить повреждение дезоксирибонуклеиновой кислоты (ДНК) и, таким образом, легко разрушаются и перестраиваются (нестабильность хромосом). ДНК является носителем генетического кода, а повреждение ДНК — обычное ежедневное явление. У большинства людей повреждение ДНК устраняется. Однако, у людей с АФ переломы и перестройки происходят чаще, и их тела медленны или не могут восстановить повреждения.
Мутации по крайней мере в 18 генах могут вызывать АФ. Белки, кодируемые этими генами, работают вместе по общему пути, называемому путем FA, который вступает в действие, когда происходит повреждение ДНК. Путь FA направляет определенные белки в область повреждения, так чтобы ДНК могло восстанавливаться и продолжать копироваться (реплицироваться). Восемь белков образуют комплекс, известный как комплекс ядра FA, который активирует два гена для образования белков, называемых FANCD2 и FANCI. Активация этих двух белков приводит белки репарации ДНК в область повреждения ДНК.
80-90% случаев заболевания происходят из-за мутаций в одном из трех генов, FANCA, FANCC и FANCG. Эти гены предоставляют инструкции для получения компонентов комплекса ядра FA. Мутации в любом из множества генов, связанных с основным комплексом FA, приведут к тому, что комплекс будет нефункциональным и нарушит весь путь FA. Нарушение этого пути приводит к накоплению повреждений ДНК, которые могут привести к аномальной гибели клеток или к их аномальному росту. Гибель клеток приводит к уменьшению количества клеток крови и физических нарушений, связанных с анемией Фанкони. Неконтролируемый рост клеток может привести к развитию острого миелоидного лейкоза или других видов рака.
Большинство случаев АФ наследуются по аутосомно-рецессивному типу. Рецессивные генетические нарушения возникают, когда человек наследует две копии ненормального гена по одному признаку, по одной от каждого родителя. Если человек наследует один нормальный ген и один ген заболевания, человек будет носителем заболевания, но обычно не проявляет симптомов. Риск для двух родителей-носителей, которые оба передадут измененный ген и заразят ребенка, составляет 25% с каждой беременностью. Риск зачать ребенка, который является носителем как родители, составляет 50% с каждой беременностью. Вероятность для ребенка получить нормальные гены от обоих родителей составляет 25%. Риск одинаков для мужчин и женщин.
Родители, которые являются близкими родственниками (брат и сестра), имеют больше шансов, чем несвязанные родители, иметь один и тот же аномальный ген, что повышает риск рождения детей с рецессивным генетическим расстройством.
Мутации в следующих генах также вызывают АФ и наследуются по аутосомно-рецессивному типу: BRCA2, BRIP1, FANCB, FANCD2, FANCE, FANCF, FANCI, ERCC4, FANCL, FANCM, PALB2, RAD51C, SLX4 и UBE2T.
Ген FANCB расположен на Х-хромосоме и вызывает менее 1% всех случаев АФ. Этот ген наследуется как X-сцепленный рецессивный признак.
Х-связанные генетические расстройства — это состояния, вызванные ненормальным геном на Х-хромосоме и проявляющиеся в основном у мужчин. Женщины с измененным геном, присутствующим на одной из их Х-хромосом, являются носителями расстройства. Женщины-носители обычно не проявляют симптомов, поскольку у женщин есть две Х-хромосомы, и только одна несет измененный ген. У мужчин есть одна Х-хромосома, которая унаследована от матери, и если мужчина наследует Х-хромосому, которая содержит измененный ген, у него разовьется болезнь. Женщины-носители расстройства, связанного с Х, имеют 25% вероятность с каждой беременностью иметь дочь-носительницу, подобную себе, 25% вероятность иметь дочь, не являющуюся носителем, 25% вероятность иметь сына, пораженного этой болезнью, и 25% вероятность иметь незатронутого сына. Если мужчина с Х-сцепленным расстройством способен размножаться, он передаст измененный ген всем своим дочерям, которые будут носительницами. Мужчина не может передать свой X-связанный ген своим сыновьям, поскольку мужчины всегда передают свою Y-хромосому вместо своей X-хромосомы потомству мужского пола.
Мутации в гене RAD51 вызывают аутосомно-доминантный АФ. Доминантные генетические расстройства возникают, когда только одна копия ненормального гена необходима для того, чтобы вызвать конкретное заболевание. Аномальный ген может быть унаследован от любого из родителей или может быть результатом новой мутации (изменения гена) у пострадавшего человека. Риск передачи ненормального гена от пострадавшего родителя потомству составляет 50% для каждой беременности. Риск одинаков для мужчин и женщин. На сегодняшний день все больные люди с АФ вследствие мутации гена RAD51 имеют спонтанную (de novo) генетическую мутацию, которая происходит в яйцеклетке или сперматозоиде. В таких ситуациях расстройство не наследуется от родителей.
Затронутые группы населения
По оценкам, уровень заболеваемости анемией Фанкони составляет около 1 на 136 000 рождений. Заболевание более распространено среди евреев-ашкенази, цыган в Испании и чернокожих южноафриканцев.
Диагностика
Диагноз АФ ставится на основании тщательной клинической оценки, подробного анамнеза пациента, определения характерных признаков и различных специализированных тестов.
Окончательным тестом на АФ в настоящее время является тест на разрыв хромосом: некоторые клетки крови пациента обрабатывают в пробирке химическим веществом, которое сшивает ДНК. Нормальные клетки способны исправить большинство повреждений и не подвергаются серьезному воздействию, тогда как при заболевании клетки демонстрируют заметное разрушение хромосом. Для этого теста обычно используются два химических вещества: DEB (диэпоксибутан) и MMC (митомицин C). Эти тесты могут быть выполнены пренатально на клетках из ворсин хориона или из околоплодных вод.
Анализы крови могут быть выполнены, чтобы определить уровни красных и белых клеток крови и тромбоцитов. Рентгенологическое исследование может выявить наличие и степень пороков развития скелета и внутренних структурных аномалий.
Многие случаи анемии Фанкони вообще не диагностируются или не диагностируются своевременно. АФ следует заподозрить и проверить на наличие у любого ребенка, родившегося с аномалиями большого пальца и руки, описанными ранее. Любой, у кого развивается апластическая анемия в любом возрасте, должен пройти тест на АФ, даже если других дефектов нет. Любой пациент, у которого в раннем возрасте развивается плоскоклеточный рак головы и шеи, желудочно-кишечного тракта или гинекологической системы с или без употребления табака или алкоголя, должен пройти обследование на АФ. Многие пациенты с АФ не показывают никаких других отклонений. Необходимо провести тест на АФ, прежде чем рассматривать трансплантацию стволовых клеток на предмет апластической анемии или лечения рака, поскольку стандартные протоколы химиотерапии и облучения могут оказаться токсичными для пациентов с заболеванием.
Молекулярно-генетическое тестирование доступно для всех 18 генов, связанных с АФ. Тестирование комплементации обычно проводится первым, чтобы определить, какой ген мутирует. Затем можно провести анализ последовательности соответствующего гена, чтобы определить конкретную мутацию в этом гене. Если мутация не идентифицирована, клинически доступен анализ делеции/дупликации генов.
Целевой мутационный анализ доступен для обычной ашкеназской еврейской мутации FANCC.
— Клиническое исследование.
Чтобы определить степень заболевания у индивидуума с диагнозом АФ, при необходимости рекомендуется следующие исследования:
- Ультразвуковое исследование почек и мочевыводящих путей.
- Формальный тест слуха.
- Оценка развития (особенно важно для малышей и детей школьного возраста).
- Обращение к офтальмологу, отоларингологу, эндокринологу, хирургу руки, гинекологу (для женщин, как указано), гастроэнтерологу, урологу, дерматологу, ЛОР-хирургу, генетическому консультанту.
- Оценка гематологом, включая полный анализ крови, гемоглобина плода и аспирата костного мозга для морфологии клеток и исследования хромосом (цитогенетика), а также биопсию для определения клеточности.
- HLA-типирование отдельных лиц, братьев и сестер и родителей для рассмотрения трансплантации гемопоэтических стволовых клеток.
- Полное типирование крови.
- Химия крови (оценка состояния печени, почек, щитовидной железы, липидов и железа).
Лечение анемии Фанкони
Лечение анемии Фанкони направлено на конкретные симптомы, которые проявляются у каждого человека. Лечение может потребовать скоординированных усилий команды специалистов. Педиатрам, хирургам, кардиологам, почечным специалистам (нефрологам), урологам, гастроэнтерологам, специалистам, которые оценивают и лечат проблемы со слухом (аудиологам и отоларингологам), глазным специалистам и другим специалистам здравоохранения, возможно, потребуется систематически и всесторонне планировать лечение пострадавшего.
Рекомендации по лечению были согласованы на консенсусной конференции 2014 года (https://www.nhlbi.nih.gov/health/health-topics/topics/fanconi/).
- Введение андрогенов (мужской гормон): андрогены улучшают показатели крови примерно у 50% людей с АФ. Самый ранний ответ наблюдается в эритроцитах, при этом увеличение гемоглобина обычно происходит в течение первого или двух месяцев лечения. Ответы на количество белых клеток и количество тромбоцитов являются переменными. Реакции тромбоцитов, как правило, неполные и не могут быть замечены до нескольких месяцев терапии. Улучшение, как правило, самое большое для количества эритроцитов. Сопротивление терапии может развиваться со временем.
- Гематопоэтические факторы роста: гранулоцитарный колониестимулирующий фактор (G-CSF) может улучшать количество нейтрофилов у некоторых людей. Обычно используется только для поддержки при интеркуррентных заболеваниях.
- Гематопоэтическая трансплантация стволовых клеток (HSCT): единственная лечебная терапия для гематологических проявлений АФ. Донорские стволовые клетки могут быть получены из костного мозга, периферической крови или пуповинной крови.
- Лечение рака: Лечение злокачественных новообразов
