Анемия хронической болезни ахб
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Анемии хронической болезни (АХБ) по частоте занимают второе место после ЖДА. АХБ является частью так называемого гематологического стресс – синдрома, который можно определить, как гематологические реакции на повреждение тканей, вызванное инфекцией, воспалением, новообразованиями или травмой. Уровень влияния хронической болезни в настоящее время принято условно определять по ускорению СОЭ, повышению С-реактивного белка (СРБ), фактору некроза опухоли (ФНО). Повышенное значение СОЭ является косвенным признаком текущего воспалительного или иного патологического процесса и относится к параметрам АХБ. Показатели СРБ используют, как критерий влияния хронического заболевания на развитие анемии, так как он является основным из белков острой фазы воспаления (Первушин Ю. В. И др., 2007). Для доказательства наличия именно «опухолевой интоксикации» иногда применяют параметр ФНО-1α, который признан одним из главных провоспалительных цитокинов и имеет выраженный противоопухолевый эффект. Общими чертами АХБ являются: необратимость ее развития при указанных заболеваниях, зависимость ее тяжести от активности и распространенности основной болезни, упорство течения, гипо – и нормохромный характер анемии, чаще всего умеренное снижение Hb (80 – 100 г/л), отсутствие эффекта от антианемических средств и улучшение показателей крови при успешном лечении основного заболевания.
При АХБ развитие малокровия обусловлено преимущественным нарушением продукции эритроцитов в костном мозге и частичной невозможностью костного мозга компенсировать усиление разрушения эритроцитов в периферической крови.
Нарушение продукции эритроцитов обусловлено перераспределением железа в организме, проявляющееся снижением количества железа необходимого для синтеза гема в эритробластах при достаточном или избыточном содержании железа в депо. При хронических заболеваниях происходит активация системы мононуклеарных фагоцитов (макрофагов), при которой усиливается их фагоцитарная активность и блокируется способность к передаче железа эритробластам. Повышение фагоцитарной активности макрофагов в отношении железа, вероятно обусловлено действием интерлейкина-1 и ФНО.
Другой механизм снижения продукции эритроцитов в костном мозге связан со снижением уровня ЭПО, который не соответствует выраженности анемии.
Анемия при хронических заболеваниях развивается обычно через две недели активного течения процесса и носит гипо – и нормохромный характер при снижении сывороточного железа и ОЖСС и повышенном содержании ферритина сыворотки, отражающего увеличение запасов железа в депо. Концентрация трансферрина в сыворотке и число ретикулоцитов нормальные или несколько сниженные, тогда как уровни сывороточных рецепторов к трансферрину нормальные или несколько повышены. Содержание сывороточного ферритина более 100 мкг/л является достоверным показателем, характеризующим АХБ.
Основные сложности в дифференциальной диагностике ЖДА и АХБ возникают при уровне ФС 30 – 100 мкг/л. Сопоставимая распространенность АХБ и ЖДА и нередко гипохромный характер обеих анемий обуславливают их внешнее сходство. В отличие от ЖДА, АХБ имеют наиболее выраженное снижение гемоглобина за счет снижения количества эритроцитов, менее значительно сниженные показатели MCV и MCH, нормальное или сниженное количество ретикулоцитов.
Анемии хронических заболеваний наиболее часто наблюдаются при: хронических инфекциях, коллагенозах и диссеминированных злокачественных новообразованиях.
Критерии АХБ:
1. Лабораторные критерии АХБ:
– Hb < 120 г/л;
– гипо-нормохромный характер анемии: МСН ≤ 32 пг, МСV ≤ 100 фл, ЦП ≤ 1,0;
– повышение ФС > 30 мкг/л, НТЖ > 20%;
– неадекватно низкая продукция ЭПО степени тяжести анемии: О/П log ЭПО < 0,9 (метод определения адекватности ЭПО в России внедрен сотрудниками института детской гематологии проф. Румянцевым А.Г., проф. Демиховым В.Г. см. рисунок);
– увеличение гепцидина выше референсных значений. Наибольший вклад в исследование этого белка внес проф. Демихов В.Г., к.м.н. Левина А.А.
2. Причины развития АХБ:
Наличие доказанного хронического воспалительного заболевания, системного заболевания, инфекции, гиперпластического процесса, доброкачественной опухоли.
Лечение АХБ
У больных с анемией, развившейся без клинически выраженной кровопотери, с доказанными хроническими воспалительными заболеваниями, гиперпластическими процессами, доброкачественными опухолями женской репродуктивной системы при наличии неадекватно низкой продукция ЭПО степени тяжести анемии (О/П log ЭПО < 0,9) показано проведение терапии по протоколу АХБ.
Рисунок. Зависимость между концентрацией Нb (г/л) и уровнем сывороточного ЭПО (МЕ/л) (логарифмическая шкала) у больных ЖДА (пунктирная линия) и АХБ (сплошная линия).
Протокол лечения АХБ
Показания к включению в протокол – присутствие всех параметров 1 – 3:
1. Нb < 110 г/л;
2. наличие критериев диагноза АХБ, О/П log ЭПО < 0,9;
3. наличие слабости, головокружения.
Противопоказания к включению в протокол:
1. другие причины анемии (недостаток железа, кровотечение, недостаток питания и гемолиз);
2. неконтролируемая артериальная гипертензия;
3. предшествующие нарушения мозгового и / или коронарного кровообращения, тромбозы.
Терапевтический режим:
1. Использовать стандартные дозы (эритропоэтин альфа или бета) (1000 – 2000 МЕ 3 раза в неделю подкожно);
2. Проводить на фоне приема пероральных препаратов железа (100 мг железа II) 2 раза в день.
3. Контроль эритроцитарных показателей 1 раз в неделю, ФС раз в месяц.
4. Проводить 4 недели с последующей оценкой эффективности лечения и коррекцией дозы.
5. Целевая концентрация Нb = 120 г/л
Оценка эффективности лечения:
Эффективность лечения анемии оценивать каждые 4 недели после начала лечения по следующим параметрам:
1. прирост Hb за время лечения (> 10 г/л через 4 недели);
2. улучшение субъективного состояния больных до и после лечения.
Использование трансфузий эритроцитарной массы при лечении анемии хронического заболевания.
Трансфузии эритроцитарной массы показаны анемиях, сопровождающие хронические заболевания желудочно-кишечного тракта и других органов и систем, интоксикации при отравлениях, ожогах, гнойной инфекции и др.Заместительную терапию эритроцитарной
Что такое анемия хронического заболевания?
Анемия хронического заболевания, также называемая анемией хронического воспаления, представляет собой состояние, которое может быть связано со многими различными протекающими в организме человека заболеваниями, включая хронические болезни, такие как рак, определенные инфекционные процессы, аутоиммунные и воспалительные заболевания, такие как ревматоидный артрит или волчанка.
Анемия характеризуется низким уровнем циркулирующих эритроцитов или гемоглобина, части эритроцитов, которая несет кислород. Анемия хронического заболевания обычно представляет собой легкое или умеренное состояние. В легких случаях анемия не проявляется какими-либо симптомами или вызывает лишь усталость, бледность кожи и головокружение. Основные механизмы, которые вызывают анемию хронического заболевания, сложны и не до конца понятны медицине.
Признаки и симптомы

Анемия хронического заболевания варьирует по степени тяжести от одного человека к другому. В большинстве случаев анемия обычно бывает легкой или умеренной. У пострадавших людей могут развиться различные симптомы, такие как:
- усталость;
- бледность кожи;
- головокружение;
- затрудненное дыхание (одышка);
- учащенное сердцебиение (тахикардия);
- раздражительность;
- боль в груди и проч. признаки.
Эти симптомы могут возникнуть у любого человека, который имеет сопоставимую степень анемии. В большинстве случаев симптомы, связанные с основным заболеванием, обычно имеют прецедент над симптомами легкой или умеренной анемии.
В редких случаях анемия хронического заболевания может быть тяжелой и вызывать более серьезные осложнения.
Причины

Причина анемии хронического заболевания может варьироваться. Обычно участвуют одновременно несколько процессов. Анемия может быть вызвана небольшим сокращением нормальной выживаемости эритроцитов. Кроме того, может быть нарушена продукция эритроцитов (эритропоэз) или эритропоэтина (гормона, стимулирующего выработку эритроцитов). Эритроциты несут кислород к телу. Точная причина анемии хронического заболевания может зависеть от основного состояния, протекающего в организме больного. Например, при раке, раковые клетки могут выделять определенные вещества, которые повреждают или разрушают незрелые эритроциты. В некоторых случаях раковые клетки или инфекционные заболевания могут проникать в костный мозг, мягкий губчатый материал, обнаруживаемый в длинных костях, где образуются клетки крови.
Исследователи также узнали, что люди с анемией хронического заболевания имеют дисбаланс в распределении железа в организме и, как следствие, не могут эффективно использовать железо для создания новых клеток крови, несмотря на достаточное или повышенное содержание железа в тканях. Железо является критическим минералом, который содержится во всех клетках организма и необходим для нормального функционирования и роста организма.
Железо встречается во многих видах пищи, включая красное мясо, птицу, яйца и овощи. Уровни железа должны оставаться в определенном диапазоне в организме, иначе они могут вызвать анемию (из-за низкого функционального уровня железа) или повреждение пораженных органов (из-за аномально высоких уровней железа в определенных тканях).
Железо необходимо для производства гемоглобина, части эритроцита, который несет кислород. Ключевой находкой при анемии хронического заболевания является повышенное усвоение и удержание железа в определенных клетках, что приводит к уменьшению количества функционального железа, доступного для производства гемоглобина. Недостаток функционального железа препятствует развитию гемоглобина, который, в свою очередь, уменьшает количество кислорода, доставляемого по всему организму.
Исследователи полагают, что иммунная система, которая постоянно активна у людей с хроническими заболеваниями, производит вещества, которые влияют на выработку, хранение и транспортировку железа в организме. Клетки в иммунной системе продуцируют цитокины, специализированные белки, которые стимулируют или ингибируют функцию других клеток иммунной системы.
Гепсидин, гормон, вырабатываемый в печени, который помогает регулировать метаболизм и транспорт железа в организме, играет значительную роль в развитии анемии хронического заболевания. Исследователи полагают, что специфический цитокин, известный как интерлейкин-6 (IL-6), стимулирует выработку гепсидина в большинстве случаев, хотя гепсидин может также продуцироваться в ответ на воспаление путями, которые не включают IL-6. Избыток гепсидина приводит к тому, что внутри клеток задерживается слишком много железа, что снижает количество железа, доступного для производства гемоглобина, что приводит к анемии.
Большинство исследователей считают, что гепсидин является ключевым фактором, влияющим на развитие анемии при хронических заболеваниях.
Затронутые группы населения
Анемия хронического заболевания поражает мужчин и женщин в равной пропорции. Люди любого возраста, у которых есть хроническое, воспалительное состояние, могут потенциально болеть данным расстройством. Точная частота анемии хронического заболевания неизвестна, и некоторые исследователи считают, что она занижена или часто остается нераспознанной. Считается, что анемия хронического заболевания является второй по частоте причиной анемии после железодефицитной анемии.
Схожие расстройства
Железодефицитная анемия является распространенным состоянием, при котором люди имеют недостаточный уровень железа в организме и не могут производить достаточное количество красных кровяных клеток для переноса кислорода через организм. Железодефицитная анемия может вызывать различные симптомы, включая усталость, слабость, бледность кожи, одышку, головные боли и головокружение.
Дополнительные симптомы, которые могут возникнуть у людей с железодефицитной анемией, включают холодные руки или ноги, раздражительность, нерегулярное сердцебиение и повышенную восприимчивость к развивающимся инфекциям. Железодефицитная анемия вызвана недостаточным уровнем железа в организме, что может происходить из-за кровопотери, диеты с низким содержанием железа, или неспособностью желудочно-кишечного тракта поглощать достаточное количество железа.
Анемия, наблюдаемая при хроническом заболевании почек, обычно вызывается дефицитом эритропоэтина в результате повреждения клеток почек. Однако у некоторых пациентов с заболеванием почек также возникают воспаления или инфекции, и анемия хронического заболевания может быть частью их анемии.
Диагностика
Диагноз анемии хронического заболевания ставится на основе выявления характерных симптомов, подробного анамнеза пациента, тщательной клинической оценки и различных специализированных тестов. Такие тесты могут измерять уровни определенных веществ в организме, включая уровни гемоглобина, уровни железа в сыворотке, общую способность связывания железа, общее количество эритроцитов или нормальный или повышенный уровень ферритина в крови. Ферритин — это белок, который связывается с железом и используется в качестве индикатора запасов железа в организме в плазме крови. Другой анализ, который может быть проведен, измеряет насыщение трансферрина. Трансферрин — это белок, который участвует в транспорте железа из кишечника в кровоток.
Стандартные методы лечения
Лечение анемии хронического заболевания направлено на основное заболевание. Если лечение основного заболевания является успешным, анемия обычно улучшается или полностью проходит без непосредственного лечения.
Усилия по лечению анемии путем коррекции дисбаланса железа в организме с помощью таких методов лечения, как пероральные добавки железа или витамины, в целом оказались неэффективными.
На самом деле, такие усилия могут оказать негативное влияние на общее состояние здоровья. Например, прием добавок железа является спорным моментом, потому что некоторые заболевания, такие как рак, используют железо для роста и распространения клеток, а некоторые инфекции используют железо в качестве питания.
Необходимы дополнительные исследования, чтобы понять сложные механизмы, которые в конечном итоге приводят к анемии хронических заболеваний, и какую роль, если таковые имеются, играют традиционные методы лечения анемии и дисбаланса железа в лечении больных людей.
Исследовательская терапия
В редких случаях, связанных с тяжелой анемией, может потребоваться переливание крови или лечение препаратами, стимулирующими выработку эритропоэтина (гормона, стимулирующего выработку эритроцитов).
Тем не менее, в некоторых исследованиях люди, прибегающие к этому методу лечения, показывали хуже результаты, чем те, кто не принимал эти препараты. Ученным необходимы дополнительные исследования для определения долгосрочной безопасности и эффективности такой терапии для лечения людей с анемией хронического заболевания.
Прогноз анемии хронического заболевания
Исход этого заболевания будет в значительной степени зависеть от тяжести заболевания, его первопричины, а также от того, насколько хорошо больной ответит на лечение.
Обычно, когда анемия возникает с основным заболеванием, оно связано с:
- менее благоприятным исходом основного состояния;
- долгим пребыванием в больнице;
- плохим качеством жизни;
- когнитивными (мозговыми) нарушениями;
- сердечной недостаточностью;
- увеличением заболеваемости другими инфекционными патологиями.
Это может привести к усилению симптомов основного состояния и даже ускорить прогрессирование заболевания.
В тех случаях, когда анемия корректируется с точностью до определенных уровней, можно улучшить качество жизни и уровни энергии.
— Рак.
У больных раком анемия связана с плохой выживаемостью, так относительный риск смерти у больных раком с анемией составляет 65%. Это также связано с повышенной утомляемостью, которая может привести к снижению способности работать и выполнять повседневную деятельность и способствовать социальной изоляции.
— Хроническое заболевание почек.
Пациенты с хроническим заболеванием почек, у которых есть анемия страдают:
- снижением качества жизни;
- когнитивными нарушениями;
- нарушением сна;
- прогрессированием заболевания;
- увеличением сердечно-сосудистых заболеваний;
- снижением толерантности к физической нагрузке, стенокардией и сердечной недостаточностью;
- более слабой функцией органов после операции по пересадке почки;
- увеличением смертности.
— ВИЧ/СПИД.
Анемия у пациентов с ВИЧ/СПИДом связана с:
- более быстрым развитием болезни от ВИЧа до СПИДа;
- снижение выживаемости, так что риск смерти может увеличиватся до 70%;
- повышенной потребностью в частых переливаниях крови;
- повышенной утомляемостью;
- плохим качеством жизни.
— Сердечно—сосудистые заболевания.
У пациентов с сердечной недостаточностью анемия связана со снижением показателей качества жизни, что является прогностическим фактором для пациентов, нуждающихся в повторной госпитализации, и связана с увеличением смертности. У пациентов, перенесших инфаркт миокарда (сердечный приступ), наличие анемии является фактором риска смерти. Аналогично, у пациентов, перенесших шунтирование коронарной артерии, анемия связана с возникновением осложнений.
— Пожилые люди.
У пожилых людей анемия связана с более быстрым снижением физических функций. Это связано с:
- повышенным риском падений;
- слабостью, истощением мышц и неподвижностью;
- сердечно-сосудистыми и неврологическими нарушениями;
- депрессией и слабоумием;
- госпитализацией;
- зависимостью от долгосрочного ухода или институционализации;
- повышенной смертностью.
Медицина / Патология / Патология (статья)
Анемия хронических заболеваний
Статья |
22-10-2018, 18:32
|
 АнемияАнемия хронических заболеваний занимает второе место среди всех видов анемий, после железодефицитной анемии. Эта патология распространена среди пациентов с острой или хронической активацией иммунитета вследствие разных инфекционных, аутоиммунных и злокачественных патологий.
АнемияАнемия хронических заболеваний занимает второе место среди всех видов анемий, после железодефицитной анемии. Эта патология распространена среди пациентов с острой или хронической активацией иммунитета вследствие разных инфекционных, аутоиммунных и злокачественных патологий.
Анемия хронических заболеваний (АХЗ) была выделена в отдельную нозологическую единицу в 1952 году после публикации Кертврайта (G.E. Cartwright) и Винтроба (M.M. Wintrobe). Некоторые специалисты считают не совсем корректным термин «анемия хронических заболеваний» и предлагают использовать термин «анемия воспаления». Такие разногласия вызваны тем, что этот вид анемии может развиваться не только при хронических, но и при острых воспалительных патологиях (снижение уровня гемоглобина в крови обнаруживается менее чем через 14 дней – это умеренная анемия с уровнем гемоглобина 90-130 г/л, гематокрита – 30-40%). Тем не менее, чтобы диагностировать анемию хронических заболеваний, необходимо наличие длительно текущего заболевания (инфекционного, аутоиммунного или онкологического).
Анемия хронических заболеваний – иммунорегулируемое состояние. Важными аспектами патогенеза является изменения в гомеостазе железа, нарушение продукции эритропоэтина, угнетение пролиферации эритроидных клеток-предшественников и продолжительность жизни эритроцитов. Ранее ученые предполагали наличие гормонов, участвующих в регуляции гомеостаза железа и обеспечивающих связь между процессами усвоения, рециклирования и депонирования этого микроэлемента. Но открытие гепцидина позволило специалистам значительно расширить понимание патогенеза анемии хронических заболеваний (см статью «Эритропоэз: Гемоглобин и Эритроциты»).
Так, в случае дефицита гепцидина в организме, может возникать серьезная перегрузка железом, что рассматривается рядом специалистов как один из основных патогенетических механизмов гемохроматоза. Продукция гепцидина печенью стимулируется воспалением и инфекционным процессом. Ученые выяснили, что ряд цитокинов (например, интерлейкин-6) при хронических заболеваниях, индуцирует синтез гепцидина в клетках печени, и повышение уровня гепцидина ингибирует процесс усвоения железа в желудочно-кишечном тракте и реутилизацию железа из макрофагов ретикулоэндотелиальной системы (см рисунок 1)
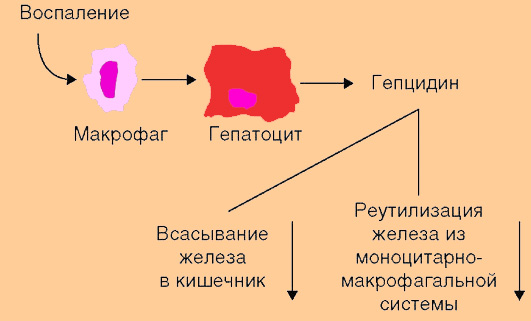
Рисунок 1. Роль гепцидина в регуляции гомеостаза при воспалительном процессе
Анемия и гипоксия ингибируют процесс образования гепцидина в печени, в результате чего снижается угнетающее влияние гепцидина на процесс усвоения железа в кишечнике и реутилизацию железа из макрофагов ретикулоэндотелиальной системы.
Сегодня специалисты отдают гепцидину главную роль в центральном механизме развития анемии хронических заболеваний. Принципиальным отличием анемии хронических заболеваний от железодефицитной анемии (ЖДА) считается то, что анемия хронических заболеваний является мультифакторной патологией, тогда как железодефицитная анемия вызвана абсолютным дефицитом железа в организме (см статью «Железодефицитная анемия»).
Именно комплекс факторов занимает ведущую роль в развитии анемии хронических заболеваний. К основным факторам относят:
- Нарушения гомеостаза железа
- Угнетение эритропоэза
- Ингибирование синтеза эритропоэтина
Благодаря современным технологиям, используемых в изучении патофизиологии анемии хронических заболеваний, специалисты разрабатывают новые средства и методы лечения. Большой интерес в терапии анемии хронических заболеваний представляют препараты антагонисты гепцидина, применение которых дает возможность восстановить угнетение процесса реутилизации железа из клеток ретикулоэндотелиальной системы, а также гормоны (препараты рекомбинантного эритропоэтина человека; ЭСА – эритропоэтин-стимулирующих агентов) и цитокины, которые стимулируют эритропоэз.
Диагностика
При постановке диагноза важно дифференцировать железодефицитную анемию и анемию хронических заболеваний, диагностика которой довольно сложная. На практике часто встречаются случаи сочетания анемии хронических заболеваний и железодефицитной анемии. Как и при железодефицитной анемии, анемия хронических заболеваний характеризуется снижением уровня железа в крови, что отражает абсолютный дефицит железа при железодефицитной анемии и гипоферремию на воне воспалительного процесса при анемии хронических заболеваний, вызванную нарушением реутилизации железа из клеток ретикулоэндотелиальной системы. Поэтому в основу дифференциальной диагностики этих состояний не может быть положено только анализ уровня железа в крови.
Уровень ферритина является основным маркером запасов железа в организме. Поэтому анализ на содержание ферритина – самый надежный критерий дефицита железа в организме. Но ферритин также является одним из острофазовых белков, поэтому при воспалительном процессе его уровень повышается, что затрудняет диагностику дефицита железа у больных с разными воспалениями или онкологическими патологиями (например, у пациентов с раком толстой кишки на фоне кровотечений или язвенным колитом). В этом случае рекомендуется проводить анализ на уровень сывороточного трансферринового рецептора.
Концентрация трансферринового рецептора в крови при дефиците железа в организме повышается и остается в пределах нормы при анемии хронических заболеваний или в случаях анемии смешанного генеза (ЖДА + АХЗ). Концентрация провоспалительных цитокинов в крови при анемии хронических заболеваний значительно повышается и не изменяется при железодефицитной анемии.
В отличие от анемии хронических заболеваний, анемия смешанного генеза (АХЗ + ЖДА) характеризуется повышением уровня микроцитов и значительно низким уровнем гемоглобина. Поэтому анализ концентрации гипохромных эритроцитов и уровня гемоглобина в эритроцитах, проводимый в современных лабораториях, считается надежным методом определения железодефицитного эритропоэза у больных АХБ.
В теории на дифференциальную диагностику анемии хронических заболеваний и железодефицитной анемии может влиять адекватность продукции эритропоэтина в зависимости от степени тяжести анемии. Так, при анемии хронических заболеваний характерно недостаточное образование эритропоэтина, которое не соответствует степени тяжести анемии. Оценка адекватности продукции эритропоэтина проводится на основании определения отношения логарифма, определяемого (О) уровня эритропоэтина к предполагаемому (П) уровню эритропоэтина, который определяется в группе пациентов с железодефицитной анемией – О / П log ЭПО. Продукция эритропоэтина считают неадекватно низкой в отношении степени анемии при О/П log ЭПО < 0,9.
Лечение
Рациональная терапия анемии хронических заболеваний основана на двух принципах:
- Анемия представляет опасность для организма, поскольку задействует компенсаторные механизмы с целью устранения развивающейся гипоксии (например, увеличивается сердечный выброс и т.д.)
- Анемия хронических заболеваний ассоциируется с ухудшением прогноза сопутствующих патологий
Так, у больных хронической почечной недостаточностью на гемодиализе или страдающих онкологическими заболеваниями, получающих химиотерапию, коррекция анемии с повышением уровня гемоглобина способствует значительному улучшению качества жизни. Тем не менее, в определенных случаях при анемии хронических заболеваний стремление повысить уровень гемоглобина с помощью терапии может быть небезопасно и вызвать ухудшение прогноза сопутствующей патологии.
Если есть возможность, лечение основной патологии является методом выбора терапии анемии хронических заболеваний. Эффективное и адекватное лечение основной патологии способствует быстрому повышению уровня гемоглобина в крови. Если отсутствует возможность эффективно лечить основную патология, следует применять другие доступные методы коррекции анемии (например, гемотрансфузия, эритропоэз-стимулирующие средства (ЭСА-терапия), терапия препаратами железа и др).
Гемотрансфузия (переливание донорской крови) широко применяется в клинической практике как эффективный и быстрый метод коррекции анемии. Ферротерапия (лечение препаратами железа) при лечении пациентов с анемией хронических заболеваний имеет ограниченное применение, поскольку при АХЗ усвоение железа в желудочно-кишечном тракте может быть затруднено. Поэтому, если возникает необходимость применить ферротерапию, предпочтение следует отдавать препаратам для внутривенного введения. Ранее врачи ограничивали применение ферротерапии, если пациент с анемией хронических заболеваний получает лечение эритропоэз-стимулирующими средствами (рекомбинантный эритропоэтин человека). Относительно недавно медики считали, что ферротерапия может вызвать избыточное образование высокотоксичных свободных радикалов, способных повреждать эндотелий сосудов.
Но в последнее время ученые провели исследования, которые показали, что терапия препаратами железа при анемии хронических заболеваний может быть полезной. Так, препараты железа способны ингибировать образование фактора некроза опухоли альфа (TNF), тем самым снижать активность воспаления при ревматоидном артрите. А у больных хроническими воспалительными заболеваниями кишечника (болезнь Крона и др) парентеральное применение препаратов железа с целью коррекции анемии приводит к быстрому ответу в виде повышения уровня гемоглобина в крови.
Таким образом, если при анемии хронических заболеваний подтвержден абсолютный дефицит железа, нужно назначать препараты железа. Также лечение препаратами железа абсолютно показана всем пациентам с анемией хронических заболеваний, не отвечающим на терапию эритропоэз-стимулирующими препаратами из-за функционального дефицита железа (в этом случае дополнительное железо утилизируется в основном клетками эритрона, повышая таким образом эффективность терапии эритропоэтином).
Если у пациента с анемией хронических заболеваний обнаружен экстремально высокий уровень эритропоэтина в крови, ферротерапию проводить не рекомендуется (следует применять только препараты железа для внутривенного введения).
Сегодня доказано положительное влияние ЭСА-терапии с целью коррекции анемии хронических заболеваний у больных, страдающих хронической патологией почек, гепатитом C (получающих противовирусную терапию), ревматоидным артритом, раком (получающих химиотерапию), ВИЧ-инфицированных (получающих лечение). Исследования показали, что у пациентов с миелодиспластическим синдромом эффективность ЭСА-терапии составляет примерно 25-40%, у пациентов с множественной миеломой – 80%, хронической патологией почек и ревматоидным артритом – до 95%. Плохой ответ на ЭСА-терапию связан в основном с сопутствующим дефицитом железа и высоким уровнем провоспалительных цитокинов.
Целевой уровень гемоглобина у больных с анемией хронических заболеваний, получающих ЭСА-терапию, составляет 110 г/л. Стремление повысить уровень гемоглобина до более высоких показателей может вызвать неблагоприятные клинические последствия.
В наши дни остается недооцененной роль коррекции анемии хронических заболеваний в клинической практике. Тем не менее, своевременное обнаружение и соответствующая терапия анемии хронических заболеваний способствует улучшению исхода хронических патологий и повышению качества жизни пациентов.
