Анемия и инфаркте миокарда
Ишемическая болезнь сердца (ИБС) – патология, в основе которой лежит поражение миокарда, обусловленное недостаточным его кровоснабжением. Атеросклеротическое сужение коронарных артерий является патогенетической основой ИБС, но для развития ишемии миокарда требуется еще дополнительный фактор, ведущий к нарушению баланса пропускной способности коронарных артерий и потребности миокарда в кислороде.
Чаще всего это увеличение работы ЛЖ (тахикардия, повышение систолического АД) или недостаточность коронарного кровотока (тромбообразование в венечных артериях, спазм). Реже как факторы, способствующие развитию или прогрессированию ИБС, рассматриваются снижение перфузионного давления (ДАД) или нарушение кислород-транспортной функции крови и т. д.
Для наглядности приводим выписки из историй болезни пациентов, у которых эти факторы играли роль «запускающего механизма». Мнение о том, что штаны принято носить только мужчинам, а женщины должны быть утонченные и элегантные, отдавая предпочтение юбкам и платьям, в нынешнее время абсолютно не актуально.
Клинический случай 1
Больной Ш., 84 года, был госпитализирован в мае 2013 г. с жалобами на давящие боли за грудиной при небольшой физической нагрузке и в покое.
Более 30 лет регистрируются высокие цифры АД (до 200/120 мм рт. ст.), сахарный диабет 2-го типа.
4 мес. назад перенес острый инфаркт миокарда без зубца Q боковой стенки левого желудочка. При коронарографии: передняя межжелудочковая ветвь (ПМЖВ) левой коронарной артерии (ЛКА) стенозирована в проксимальной трети на 50%, в дистальной трети — последовательные стенозы 30–50%; огибающая артерия (ОА) стенозирована в средней трети на 70%, правая коронарная артерия (ПКА) субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Выполнено стентирование средней трети ОА. Реканализацию ПКА выполнить не удалось.
Обращено внимание на наличие гипохромной анемии легкой степени (гемоглобин -106 г/л). Проведенное обследование возможного источника кровотечения не выявило. Выписан в удовлетворительном состоянии с рекомендацией приема ацетилсалициловой кислоты и клопидогрела, сахароснижающей терапии, препаратов железа.
Дома рекомендованные препараты принимал нерегулярно, врача не посещал.
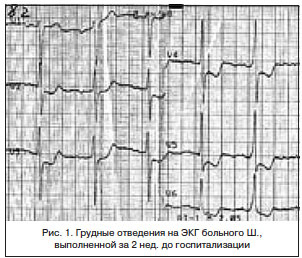
Около 2 мес. назад отметил нарастание слабости. Стали беспокоить редкие приступы загрудинных болей. На ЭКГ от 10.05.13 г.: на фоне синусового ритма с ЧСС 75 уд./мин — выраженная депрессия сегмента ST в отведениях V2-6 (рис. 1). От предложенной госпитализации отказался.
Последние 2 нед. участились приступы загрудинных болей давящего характера, они стали возникать при минимальной физической нагрузке и в покое, сублингвальный прием нитроглицерина оказывал кратковременное действие, появилось чувство нехватки воздуха. Обратился в поликлинику, откуда был доставлен в ЦКБ с диагнозом «ИБС, прогрессирующая стенокардия».
При поступлении: кожные покровы бледные. Отеков нет. ЧД — 18 в 1 мин. Дыхание жесткое. Пульс — 72, АД — 140/70 мм рт. ст. на обеих руках. Систолический шум в точке Боткина и на верхушке, проводящийся в левую подмышечную область.
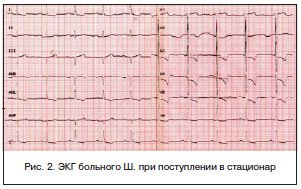
ЭКГ при поступлении (рис. 2): синусовый ритм с ЧСС 59 уд./мин, замедление атриовентрикулярной проводимости (PQ — 0,24 с). Замедление проводимости по левому предсердию и желудочку. Гипертрофия левого желудочка. Нарушение реполяризации в V2-5.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 240 г). Утолщение межжелудочковой перегородки (МЖП), более выраженное в базальной части (1,6–1,8 см), без признаков обструкции выходного отдела ЛЖ. Толщина ЗСЛЖ — 1,5 см. Сократительная способность миокарда ЛЖ удовлетворительная (ФВ по Тейхольцу — 63%), КСР — 3,6 см, КДР — 5,5 см, ЛП — 5,1 см. Зон нарушенной кинетики не выявлено. Изменение диастолической функции ЛЖ по первому типу.
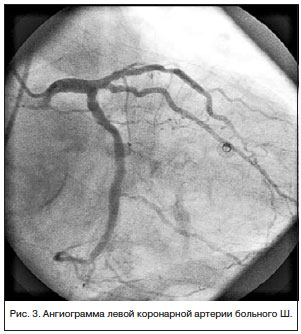
В экстренном порядке выполнена коронароангиография (КАГ) (рис. 3): ствол ЛКА не изменен. ПМЖВ стенозирована на границе передней и средней третей на 50%, на протяжении дистальной трети — последовательные стенозы 30–60%. 1ДВ — анатомически некрупная, стенозирована в устье на 80%, окклюзирована в средней трети, дистальная часть слабо контрастируется по интерартериальным коллатералям. ВТК стенозирована в устье до 50%. ОВ анатомически крупная, проходима на всем протяжении, ранее имплантированные стенты — без стенотических изменений. ПКА субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Сбалансированный тип коронарного кровоснабжения.
Учитывая отсутствие динамики стенозов-КА по сравнению с КАГ от января 2013 г., чрескожное коронарное вмешательство не проводилось.
В анализе крови: гемоглобин — 61 г/л, эритроциты — 2,30×10*12, ЦП — 0,8, гематокрит — 18,5, лейкоциты — 7,7×10*9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
В анализе мочи: удельный вес — 1020, белок — 0,15, лейкоциты — 0–5 в поле зрения, эритроциты — 100–150 в поле зрения.
Дополнительный целенаправленный расспрос позволил выяснить, что на протяжении последних 4 мес. неоднократно были эпизоды выделения темно-красной мочи, иногда длившиеся по несколько дней (макрогематурия?).
Убедительных данных, говорящих об остром очаговом поражении миокарда, на момент госпитализации не получено. Учитывая наличие анемии тяжелой степени, произведена трансфузия отмытых эритроцитов (1150 мл за 2 сут) с положительным эффектом: уровень гемоглобина повысился до 100 г/л, число эритроцитов — до 3,59×10*12, гематокрит — до 29,4.
На ЭКГ через 1 сут после последней гемотранфузии отмечается нормализация конечной части желудочковых комплексов в грудных отведениях (в V4 — зубец Т слабоотрицательный).
Самочувствие пациента значительно улучшилось: в течение последующих 3 сут при расширении двигательного режима до уровня физических нагрузок, соответствующих 3 функциональному классу, боли в грудной клетке не возникали, выраженность одышки существенно уменьшилась, объем нагрузок ограничивался главным образом мышечной утомляемостью. Эпизоды макрогематурии не повторялись. В удовлетворительном состоянии больной переведен для дообследования в урологическое отделение.
Клинический случай 2
Больной К., 50 лет, госпитализирован в стационар в декабре 2014 г. с клиникой прогрессирования стенокардии напряжения, одышки, возникающих при минимальной физической нагрузке, в покое, с нарастанием общей слабости в течение последнего месяца.
В анамнезе: АГ с максимально известными значениями АД 200/100 мм рт. ст. давностью более 15 лет; регулярно принимает антигипертензивные препараты, однако контроль АД нерегулярный. В 2002 г. перенес ОИМ, в этом же году выполнено аортокоронарное шунтирование (АКШ) ПМЖА, ПКА, ОА. В 2009 г. развилась клиника прогрессирующей стенокардии, в связи с чем выполнено стентирование шунта к ОВ ЛКА. В мае 2014 г. — повторный ОИМ задней стенки левого желудочка, проводился системный тромболизис, чрескожное коронарное вмешательство с реканализацией и стентированием АКШ к ОА. После выписки и до настоящей госпитализации — состояние стабильное.
Сопутствующие заболевания: сахарный диабет 2-го типа, мочекаменная болезнь, хронический геморрой, железодефицитная анемия легкой степени регистрируется с 2009 г. (препараты железа не принимал).
При поступлении: кожные покровы бледные, сухие. ЧД — 18 уд./мин. Дыхание жесткое, небольшое количество свистящих хрипов на выдохе. Тоны сердца глухие. ЧСС -76 уд./мин. АД — 150/90 мм рт. ст. на обеих руках.
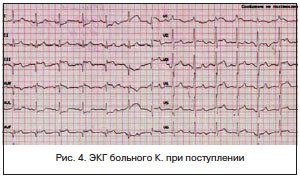
ЭКГ зарегистрирована на фоне болевого приступа (рис. 4): ритм синусовый, ЧСС — 88 уд./мин, смещение сегмента ST вверх от изолинии в отведениях III, aVF, V1. В отведениях I и aVL смещение сегмента ST книзу от изолинии. Зубец Q длительностью 0,04 с во II, III, aVF отведениях.

ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 213 г, МЖП — 1,5 см, ЗСЛЖ — 1,2 см). Дилатация левого предсердия (5,3×6,1 см). Нарушение диастолической функции левого желудочка по первому типу. Гипокинез диафрагмального, заднебазального и заднебоковых сегментов. ФВ — 54% по Тейхольцу.
В общем анализе крови: гемоглобин — 70 г/л, эритроциты — 4,29×10*12, гематокрит -23,5, ЦП — 0,48, гипохромия, анизоцитоз, пойкилоцитоз (овалоциты, мишеневидные эритроциты), лейкоциты — 5,9×10*9. Сывороточное железо — 1,9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
Таким образом, убедительных данных, свидетельствующих об остром очаговом поражении миокарда, на момент госпитализации не получено. Высказано предположение, что причиной прогрессирования стенокардии являлась тяжелая железодефицитная анемия, вероятнее всего, постгеморрагическая. Проведена трансфузия эритроцитной взвеси 630 мл за первые сутки, начато парентеральное введение препаратов железа.
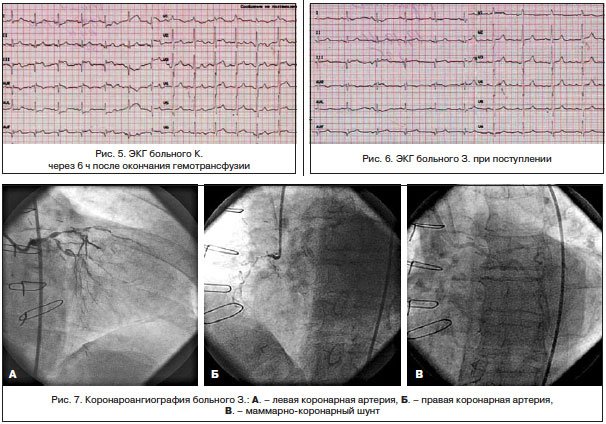
Трансфузионную терапию перенес хорошо. Ангинозные боли не рецидивировали. На ЭКГ, зарегистрированной после гемотрансфузии (рис. 5): ЧСС — 62 уд./мин. Сегмент ST вернулся к изолинии.
В анализе крови спустя 1 сут: уровень гемоглобина возрос до 105 г/л, число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, гипохромия, анизоцитоз сохраняются. Лейкоциты — 8×10*9.
В течение 3 сут пациент находился в ОРИТ, антиангинальной терапии не требовалось, т. к. приступы стенокардии не рецидивировали.
Проводился поиск возможного источника кровопотери, онкопоиск: при колоноскопии выявлен хронический комбинированный геморрой 3 ст. Другой патологии, которая могла бы объяснить наличие анемии, не найдено.
Проводилось постепенное расширение двигательного режима. Физические нагрузки, соответствующие уровню 3 функционального класса, приступов стенокардии и ЭКГ-признаков ишемии миокарда не вызывают.
Через 12 дней в стабильном состоянии пациент выписан для дальнейшего лечения в амбулаторных условиях. Хирургом рекомендовано выполнение в плановом порядке дезартеризации геморроидальных узлов под ультразвуковым контролем.
Клинический случай 3
Больной З., 82 года, госпитализирован в стационар с жалобами на дискомфорт за грудиной, нехватку воздуха, возникающие без четкой связи с физической нагрузкой, длительностью до 4–5 мин, накануне был затяжной приступ длительностью более 1 ч, выраженную слабость, потливость. Настоящее ухудшение состояния отмечает в течение последних 3 дней на фоне появившейся гипотонии.
В течение 2 нед. до госпитализации принимал по поводу дорсалгии нестероидные противовоспалительные препараты (НПВП) (кеторолак). 4 дня назад отметил появление учащенного жидкого стула темной окраски, необычно низкое АД — 80/40 мм рт. ст.
В 1995 г. перенес ОИМ нижней стенки ЛЖ. В этом же году выполнено маммарно-коронарное шунтирование ПМЖА, АКШ ЗБВ ОА и ПКА. В 2003 г. — линейное аортобедренное шунтирование синтетическим протезом слева. Ранний послеоперационный период осложнился развитием повторного ОИМ нижней стенки ЛЖ.
С 2009 г. — пароксизмы мерцательной тахиаритмии.
Постоянно принимает бисопролол — 2,5 мг/сут, периндоприл — 5 мг/сут, аторвастатин — 20 мг/сут, варфарин — 5 мг/сут. Контроль МНО не проводился более года.
При поступлении: кожные покровы и видимые слизистые бледные. Число дыханий — 20 в 1 мин. Дыхание ослабленное, жесткое. Тоны сердца глухие, ритмичные. ЧСС — 76 уд./мин. АД — 110/70 мм рт. ст.
Лабораторные данные: гемоглобин — 91 г/л, эритроциты — 3,93×10*12, гематокрит — 33,0, ЦП — 0,84, лейкоциты — 10,2–10,6×10*9, тромбоциты — 223×10*9, анизоцитоз, анизохромия.
Кардиоспецифические ферменты: КФК — 268 при поступлении, через 10 ч — 319, КФК МВ — 30 при поступлении, через 10 ч — 42, тропонин Т при поступлении — 177, через 10 ч — 538.
Сывороточное железо — 13 мкмоль, белки транспорта железа в границах нормы. Коагулограмма: АЧТВ — нет коагуляции, МНО — нет коагуляции, фибриноген — 3,3 г/л, Д-димер — 1147.
ЭКГ (рис. 6) при поступлении: синусовый ритм, АВ-блокада I ст., рубцовые изменения нижней стенки ЛЖ, смещение сегмента ST во II, III и avF отведениях, высокий R — в V1-2. Архив ЭКГ не предоставлен.
ЭхоКГ: склероз и кальциноз стенок аорты, кольца и створок АК. ММЛЖ — 204 г, толщина МЖП — 1,0 см, ЗСЛЖ — 1,0 см. Дилатация левых отделов сердца (ЛП — 4,5×5,5 см, левый желудочек: КСО — 92, КДО — 171). Относительная недостаточность МК II степени. Гипокинез среднего заднего и заднебокового сегментов ЛЖ. Снижение глобальной сократительной способности миокарда ЛЖ (ФВ по Тейхольцу — 47%). Диастолическая дисфункция левого желудочка первого типа.
С учетом жалоб, анамнеза, лабораторно-инструментальных данных у больного диагностирован повторный ОИМ диафрагмальной и заднебазальной локализации.
Не исключалось состоявшееся желудочно-кишечное кровотечение на фоне приема НПВП и орального антикоагулянта, в связи с чем экстренно выполнена ЭГДС: эндоскопические признаки хронического эзофагита, язва нижней трети пищевода Forrest II C. Острая язва желудка Forrest II B (без признаков продолжающегося кровотечения). Язва привратника Forrest I B (с признаками продолжающегося кровотечения). После эндоскопического инъекционного гемостаза кровотечение остановлено.
Причиной ОИМ, вероятно, явилась гипотония и анемия на фоне желудочно-кишечного кровотечения. Начата консервативная гемостатическая, противоязвенная терапия. От проведения КАГ с возможным чрескожным коронарным вмешательством решено воздержаться до стабилизации состояния.
На фоне лечения цифры АД стабилизировались на уровне 120/85 мм рт. ст., уровень гемоглобина повысился до 110 г/л, возросло число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, лейкоциты — 8×10*9, гипохромия, анизоцитоз сохраняются.
Уровень активности КФК снизился до 113 ед, МВ КФК — до 12,7, тропонина Т — до 225.
ЭГДС через 2 сут: язва нижней трети пищевода Forrest III, острая язва желудка Forrest III, язва привратника Forrest II С (отсутствие признаков кровотечения, появление в области дна фибрина).
На 3-й день пребывания в стационаре возобновились кратковременные приступы сжимающих болей за грудиной (2 приступа: во время приема пищи и при попытке сесть в кровати).
По экстренным показаниям выполнена коронароангиография (рис. 7): ствол ЛКА стенозирован на протяжении передней и средней трети до 70%, субокклюзирован в дистальной трети с переходом на устья ОВ и ПМЖВ; ПМЖВ субокклюзирована в устье, стенозирована в передней трети на 80%, окклюзирована в средней трети, дистальная часть контрастируется по функционирующему маммарно-коронарному шунту. ОВ субокклюзирована в устье, стенозирована в передней трети на 80%; ПКА субокклюзирована на протяжении передней и средней трети, окклюзирована на границе средней и дистальной третей, дистальная часть контрастируется по межартериальным анастомозам.
Правый тип коронарного кровоснабжения.
Маммарно-коронарный шунт из правой маммарной артерии в дистальной трети ПМЖВ проходим. Шунты к ОА и ПКА не визуализируются.
Попытка реканализации стенозированных артерий — без успеха в связи с выраженным кальцинозом.
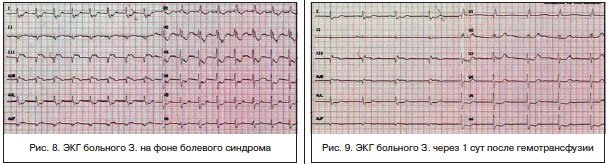
В течение последующих суток — состояние с отрицательной динамикой: в виде учащения кратковременных приступов стенокардии, сопровождающихся выраженными ЭКГ-признаками ишемии миокарда (рис. 8). Отмечено снижение гемоглобина со 110 до 87 г/л, гематокрита — до 26,0.
Кардиоспецифические ферменты в пределах нормальных значений. ЭхоКГ: размер левых отделов сердца прежний, новых участков нарушения движений стенок ЛЖ не выявлено.
Гастроскопия: активное кровотечение из острого дефекта слизистой кардиоэзофагеального перехода (Forrest I). Эндоскопическая остановка кровотечения.
После переливания 600 мл эритроцитной взвеси состояние с положительной динамикой: ангинозные боли и ЭКГ-признаки ишемии миокарда не рецидивируют (рис. 9), восстановление уровня гемоглобина (110 г/л), эритроцитов (3,85×10*12), гематокрита -33,7.
При контрольной ЭГДС через 10 дней положительная динамика — уменьшение в размерах язвенных дефектов без признаков кровотечения.
На фоне терапии ингибиторами протонной помпы, β-блокаторами, клопидогрелом 75 мг/сут показатели красной крови стабильны, двигательный режим расширен и по уровню нагрузок соответствует 3 ФК.
ХМЭКГ: ритм синусовый, ЧСС (за сут/днем/ночью): 78/77/78 уд/мин, максимальная ЧСС — 99 уд/мин, минимальная — 64 уд/мин. Отмечается появление депрессии сегмента ST при увеличении ЧСС свыше 90 уд/мин.
Приведенные случаи демонстрируют возможность проявления коронарной недостаточности на фоне снижения кислород-транспортной способности крови как у пациентов с тяжелым, так и умеренным поражением коронарного русла. Устранение анемии во всех трех случаях способствовало повышению коронарного резерва и стабилизации состояния.
Российский кардиологический журнал
»» №1 2006
ОПРЕДЕЛЕНИЕ ЗНАЧЕНИЯ АНЕМИИ В ПРОГНОЗЕ РЕЦИДИВА ОСТРОГО ИНФАРКТА МИОКАРДА
Калюта Т.Ю., Токарев В.П., Каримов Р.Н., Шварц Ю.Г.
Саратовский государственный медицинский университетРезюме
Исследование
предпринято с целью изучить, является ли анемия независимым предиктором
рецидивирующего течения острого инфаркта миокарда, и попытаться объяснить
полученные результаты, используя метод многомерной статистики – «анализ соответствий». Обследован 171 пациент
(средний возраст – 64,2±10 года) с острым инфарктом миокарда. Все пациенты получали
тромболитическую терапию – в исследование не включались больные с
кровотечениями в анамнезе и тяжелыми сопутствующими заболеваниями. Определялось
количество эритроцитов и уровень гемоглобина в капиллярной крови при
поступлении. Учитывались пожилой возраст, класс сердечной недостаточности по
Killip, длительность коронарного анамнеза, наличие перенесенных инфарктов,
инсультов, сахарного диабета, артериальной гипертонии, мерцательной аритмии,
гипертрофии и дилатации левого желудочкапо данным эхокардиографии. Наблюдение
велось в среднем 21 день, фиксировались постинфарктная стенокардия и рецидивы
инфаркта. Для многофакторного анализа использовались логистическая регрессия и
анализ соответствий. Постинфарктная стенокардия без последующего реинфаркта
отмечалась у 62 больных. Рецидив инфаркта – у 19 больных, у которых анемия
выявлялась чаще (47,4%) по сравнению с подгруппой пациентов без рецидивирующей
стенокардии и реинфаркта (25%; p=0.002). По данным однофакторного анализа и
логистической регрессии не выявлено достоверной взаимосвязи анемического
синдрома с постинфарктной стенокардией. В отношении реинфаркта анемия была
независимым предиктором (р=0,03; Odds ratio – 3,11; 95 % CL 1,07 ; 9,0). Роль
анемии подтверждалась и «анализом соответствий», в результате которого было
выявлено, что больные с реинфарктом и постинфарктной стенокардией существенно
различаются между собой и отличаются от других пациентов по совокупности
исходных характеристик. Таким образом, анемический синдром может быть
независимым предиктором рецидива острого инфаркта миокарда. Анализ соответствий
обладает существенной ценностью при анализе многомерной информации у больных с
острым инфарктом миокарда.Ключевые слова: острый инфаркт миокарда, анемия,
гемоглобин, постинфарктная стенокардия, реинфаркт, анализ соответствий.Abstract
The aim of the study was to determine whether
anemia is an independent predictor for recurrent myocardial infarction (MI),
and to interpret the results obtained, using multiple statistics method –
correlation analysis. In total, 171 patients (mean age 64,2±10 years) with
acute MI were examined. All participants received thrombolytic therapy.
Patients with bleeding in anamnesis or sever comorbidities were excluded from
the study. Red blood cell and hemoglobin levels in capillary blood were measured
at admission. The following parameters were registered: elderly age, heart
failure class by Killip, coronary anamnesis duration, MI, stroke, diabetes
mellitus, arterial hypertension, atrial fibrillation in anamnesis, left
ventricular hypertrophy and dilatation atechocardiography. Mean follow-up
period lasted for 21 days; post-MI angina and recurrent MI were registered. In
multiple analysis, logistic regression and correlation analysis were performed.
Post-MI angina without progression into recurrent MI was observed in 62
patients. Recurrent MI was registered in 19 participants; in this group, anemia
was observed more often (47,4%) than in individuals without recurrent angina or
MI (25%; p=0,002). According to univariate analysis and logistic regression
results, there was no significant correlation between anemic syndrome and post-MI
angina. Anemia was an independent predictor of recurrent MI (р=0,03; odds ratio 3,11- 95% CI 1,07-9,0).
Anemia prognostic role was confirmed by correlation analysis: patients with
post-MI angina and recurrent MI substantially differed from each other, as well
as from other patients, by baseline characteristics. Therefore, anemic syndrome
could be regarded as an independent predictor of recurrent MI. Correlation
analysis is effective inassessing multiple information on acute MI
patients.Keywords:
Acute myocardial
infarction, anemia, hemoglobin, post-infarction angina, recurrent myocardial
infarction, correlation analysis.
