Анемия рефрактерная к лечению

Заболевания крови составляют многочисленную и разнообразную группу синдромов, формирующихся при нарушениях качественного и количественного состава крови. Все они систематизируются, исходя из поражения какого-либо компонента крови. Гематологические заболевания делят на три основные группы:
- патологии, характеризующиеся снижением уровня гемоглобина;
- гемобластозы;
- гемостазиопатии.
Рефрактерная анемия – одна из разновидностей малокровия, отличающаяся нарушением созревания клеток красного ростка.
Миелодиспластический синдром – это что?
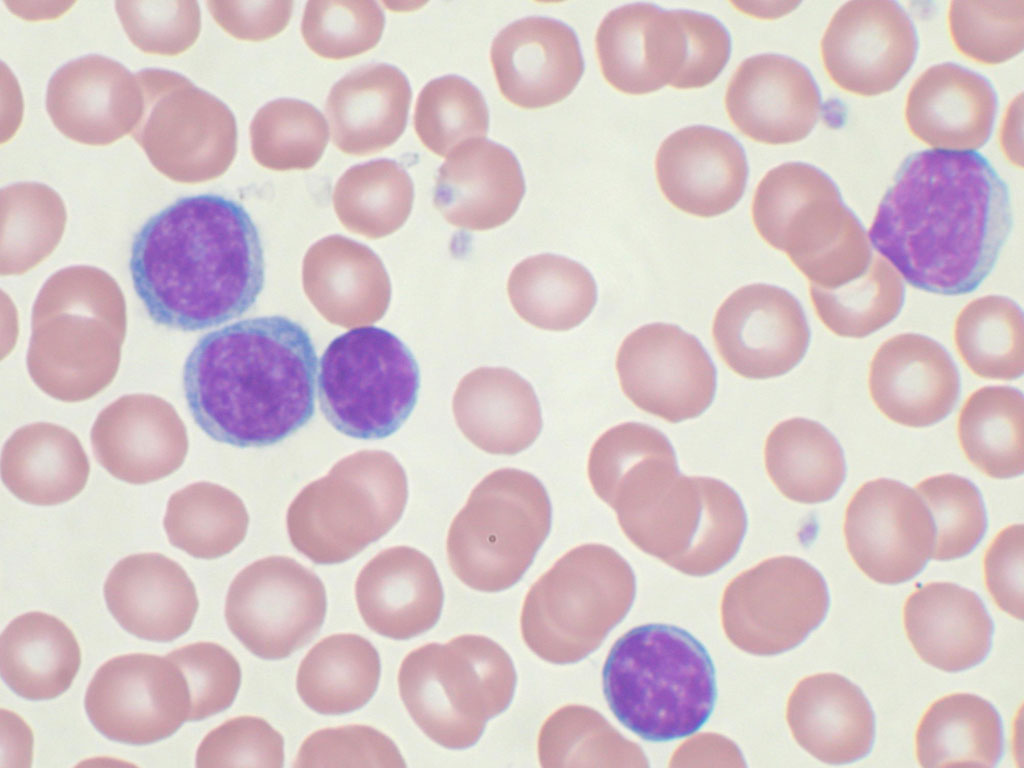
Группу заболеваний и состояний с нарушением процесса образования эритроцитов, моноцитов, тромбоцитов, гранулоцитов в миелоидной ткани (миелоидное кроветворение) с высокой вероятностью развития опухолевого поражения кроветворной системы в медицине именуют миелодиспластическим синдромом (МДС).
Клинические признаки в этом случае такие же как при анемии, состоянии, отличающимся снижением уровня нейтрофильных гранулоцитов в крови и тромбоцитопении. Заболевание чаще встречается у людей после 60 лет, причем мужчины подвержены ему больше, чем женщины. Однако в последнее время наблюдается «омоложение» болезни. Гематологи считают, что причина кроется в ухудшении экологической обстановки.
Одно из заболеваний группы миелодиспластического синдрома – рефракторная анемия. Данная патология, как и все остальные, объединенные МДС, относится к гематологическим заболеваниям, характеризующимися цитопенией (снижением уровня определенного вида клеток в крови) и патологическими изменениями костного мозга.
Классификация миелодиспластического синдрома
В международную классификацию болезней были внесены некоторые изменения, которые коснулись и гематологических заболеваний. Систематизация схожа с предложенной ранее ВОЗ, но отличается от FAB количеством вариантов определения заболеваний:
- D46.0 – рефрактерная анемия без сидеробластов.
- D46.1 – РА с кольцевыми сидеробластами. Незрелые кровяные клетки в крови не обнаруживаются.
- D46.2 – рефракторная анемия с избытком бластов 1. В анализе крови цитопения, превышение уровня моноцитов, тельца Ауэра отсутствуют.
- D46.3 – рефракторная анемия (РА) со множеством бластов с трансформацией.
- D46.4 – РА неуточненная.
- D46.5 – рефракторная цитопения со многолинейной дисплазией.
- D46.6 – миелодиспластический синдром, ассоциированный с делецией 5q.
- D46.7 – другие миелодиспластические синдромы.
- D46.9 – миелодиспластический синдром неуточненный.
Особенности рефрактерной анемии
Refractorius в переводе с латыни означает “невосприимчивый”, “трудноизлечимый”. Заболевание относится к гематологическим и характеризуется нарушением развития эритроцитного ростка в крови, продуцируемого костным мозгом. При синдроме рефрактерной анемии сначала снижается содержание эритроцитов в крови, а потом и остальных клеток, поражается орган кроветворной системы, отвечающий за гемопоэз.
Основная опасность патологии заключается в том, что она не поддается лечению, основанному на применении железосодержащих препаратов. Данный вид анемии часто протекает практически бессимптомно и выявляется при диагностике других патологий. Болезнь быстро прогрессирует и ведет к развитию острого лейкоза.
Рефракторная анемия с избытком бластов
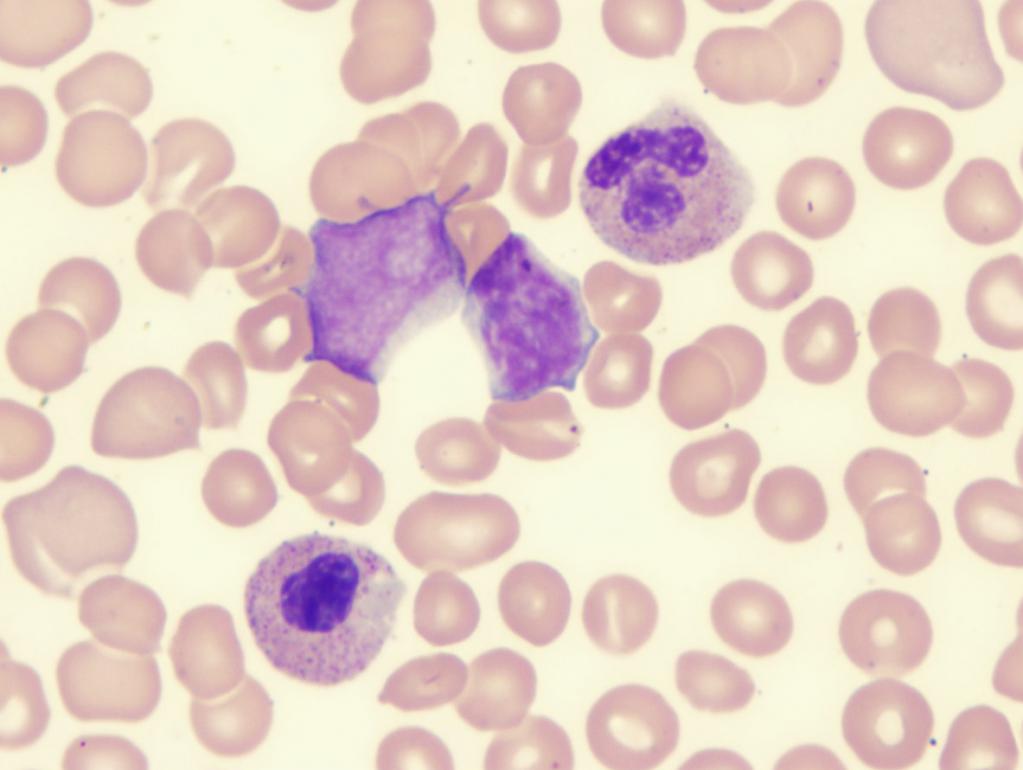
Исходя из статистических данных, людей с подобным диагнозом около 1 015 000. Заболевание чаще всего встречается у мужчин 75-80 лет, а у женщин в возрасте 73-79 лет. Патологию делят на два типа:
- РАИБ-1 – характеризуется цитопенией, увеличением числа моноцитов в крови. Палочковидные красные белковые включения в цитоплазме моноцитов (тельца Ауэра) не обнаруживаются. В костном мозге наблюдается дисплазия одной клеточной линии, бластов (незрелые кровяные клетки) около 5-19 %.
- РАИБ с трансформацией – анализ крови показывает повышенное содержание моноцитов, выявляются тельца Ауэра. Содержание бластов около 30 %. В костном мозге обнаруживаются дисплазии сразу нескольких клеточных линий. Подобная картина способствует развитию острого миелолейкоза.
Смертность от данной патологии составляет около 11 %.
Причины возникновения патологии
Точные причины развития заболевания до сих пор не выявлены. Разделяют два типа синдрома, и по каждому из них установлены факторы риска.
Первичный (идеопатический) выявляется в почти 90 % случаев. Факторы риска:
- Курение.
- Превышенный уровень радиации.
- Проживание в неблагоприятной экологической зоне.
- Регулярное вдыхание паров бензина, органических растворителей, пестицидов.
- Врожденный нейрофиброматоз Реклингхаузена (развитие опухолей из нервной ткани).
- Наследственная анемия Фанкони.
- Синдром Дауна.
Вторичный тип рефрактерной анемии (МДС) наблюдается в 20 % случаев, может развиваться в любом возрасте. Основные причины развития:
- Химиотерапия или радиотерапия.
- Долговременное применение некоторых групп лекарственных средств: циклофосфаты, антрациклины, ингибиторы топоизомеразы, подофиллотоксины.
Вторичный вариант отличается высокой резистентностью к терапии и большой вероятностью формирования острого лейкоза и, как следствие, неблагоприятным прогнозом.
По каким признакам определить заболевание?

Часто патология развивается без каких-либо симптомов, что мешает начать лечение на ранних этапах и в мягких формах. Как правило, диагностируется рефрактерная анемия в тяжелой степени при плановом обследовании пациента.
Но выявить заболевание на ранних этапах все же можно. Первые его признаки имеют много общего с проявлениями, возникающими при патологиях печени, аутоиммунных заболеваниях и любой другой анемии. К ним относятся:
- Бледность, прозрачность кожи, в особенности на лице.
- Чрезмерное утолщение рогового слоя эпидермиса на локтях и коленях.
- Образование гематом, которые долго проходят.
- Постоянные трещины на слизистой рта.
- Ломкость ногтей.
- Изменение обоняния и вкуса: пристрастие к резким запахам, желание есть землю, мел.
- Быстрая утомляемость.
- Частые ОРВИ с тяжелым течением.
При обнаружении подобных симптомов следует обратиться к врачу.
Клинические проявления тяжелой степени патологии

Клиническая картина анемии состоит из двух фаз: хроническая гемодепрессия и тяжелая (финальная) стадия.
При гемодепрессии наблюдаются следующие проявления:
- Значительное повышение температуры, лихорадка.
- Резкий упадок сил.
- Общее плохое самочувствие.
- Снижение веса.
- Увеличение внутренних органов: селезенки, печени.
- Увеличение и болезненность лимфатических узлов.
Подобные состояния затяжные, с периодами ремиссии.
Симптомы тяжелой степени рефрактерной анемии (миелодиспластический синдром) такие же, как при остром лейкозе. Болезнь развивается стремительно. Одной из ее особенностей является обнаружение бластов в анализе крови. Заболевание сопровождается следующими симптомами:
- Гематомы, даже при незначительных ушибах.
- Кровоточивость десен.
- Гингивит.
- Бинокулярное смещение глазного яблока.
- Упорные повторные воспалительные процессы в носоглотке.
- Нагноение царапин, небольших ран.
- Боли в области позвоночника.
У пациентов пожилого возраста возникают вторичные заболевания, чаще поражается сердечно-сосудистая система. Пациенты испытывают боли при ходьбе в нижних конечностях.
Диагностические мероприятия
При первых подозрительных симптомах необходимо обратиться к доктору. Диагноз “миелодиспластический синдром” или “рефрактерная анемия с избытком бластов” ставится только после прохождения ряда лабораторных исследований. Они включают:
- Клинический анализ периферической крови.
- Цитологические исследования аспирата костного мозга.
- Трепанобиопсия заключается во взятии биоматериала из костного мозга путем прокола большеберцовой кости.
- Цитогенетический тест. Анализ выявляет хромосомные нарушения, является обязательным.
В зависимости от клинической картины заболевания могут быть назначены дополнительные диагностические мероприятия:
- УЗИ брюшной полости.
- Эзофагогастродуоденоскопия желудочно-кишечного тракта.
- Анализ на специфические онкомаркеры.
Методы терапии
Выбор способа лечения рефрактерной анемии обусловлен выраженностью клинических проявлений и результатами лабораторных исследований. Схемы терапии довольно сложны и определяются врачом. Пациенты с небольшим количеством бластов находятся в группе низкого риска. Они получают заместительное и поддерживающее лечение и могут вести практически обычный образ жизни. Приблизительная схема лечения такова:
- В стационарных условиях осуществляется наблюдение. Основная задача: поддержка нормального уровня гемоглобина и недопущение развития анемического синдрома. Пациенту делают переливание эритроцитарной донорской массы.
- При тяжелой анемии назначают лекарственные препараты, способствующие восстановлению железосодержащего белка: «Эксиджад», «Десферол».
- Для предотвращения иммунной агрессии против костного мозга применяют «Леналидомид» с антимоноцитарным глобулином и «Циклоспорином».
- При выявлении инфекционных заболеваний назначают антибактериальные препараты в зависимости от возбудителя и его резистентности.
- При необходимости, проводят пересадку костного мозга.
Прогнозирование
Прогноз рефрактерной анемии (миелодиспластический синдром) зависит от клинической картины, ответной реакции организма на терапию, своевременности обращения за медицинской помощью. Исход заболевания обусловлен выраженностью дефицита определенных клеток, наличие и профиль хромосомных отклонений, количество бластов и их тенденцию к развитию в крови и костном мозге.
Профилактика

Ввиду того что сущность, обстоятельства и механизмы развития патологии до конца еще не исследованы, то и действенные профилактические методы назвать практически невозможно. Врачи советуют придерживаться следующих рекомендаций по сохранению здоровья:
- Правильно сбалансировано питаться.
- Включать в рацион продукты с высоким содержанием железа.
- Чаще совершать прогулки на свежем воздухе.
- Отказаться от вредных привычек, в частности курения.
- При работе с пестицидами или органическими растворителями применять средства защиты.
Рефракторная анемия – опасное гематологическое заболевание, переходящее в онкологию. Чтобы избежать тяжелых стадий заболевания и серьезных последствий, необходимо регулярно проводить плановый осмотр. При обнаружении патологии необходимо полностью пройти курс терапии, многим пациентам это помогло не только улучшить, но и продлить жизнь.
Источник

Рефрактерная анемия относится к одному из самых опасных видов заболеваний крови. В большинстве случаев на фоне патологии развивается острый лейкоз, спасти от которого человека не всегда возможно. Элементы крови при заболевании из костного мозга в кровоток поступают в незрелой форме, из-за чего их нормальное функционирование оказывается невозможным.
Что такое рефракторная анемия

Анемия в мазке крови
Заболевание относится к приобретённым патологиям костного мозга из группы гетерогенных. Кроветворная функция в организме нарушается не только в количественных показателях, но и в качественных. Патология отличается стойкостью к терапевтическому воздействию, которое эффективно против иных видов патологии. Заболевание диагностируется с равной частотой у женщин и мужчин.
При рефрактерной анемии происходит нарушение в выработке ферментных элементов в костном мозге, из-за чего концентрация эритроцитов значительно снижается. При заболевании отмечается резкое падение гемоглобина и понижение количества не только эритроцитов, а также и тромбоцитов и лейкоцитов. Изменения, которые происходят в костном мозге, необратимые. Особая опасность патологии заключается в том, что в течение длительного времени заметной для больного симптоматики не возникает, и о наличии болезни становится известно только в момент острого лейкоза.
Симптомы

Могут иметь место частые беспричинные обмороки
Симптоматика возникает, когда заболевание уже достаточно сильно развито. Первичные симптомы, такие как единичные точечные кровоизлияния под кожей, появление синяков от незначительных ударов и бледность, редко замечаются больным. Когда состояние становится тяжёлым, развиваются следующие признаки болезни:
- слабость, приводящая к непереносимости физических нагрузок,
- частые обмороки, которые происходят без видимых на то причин,
- сильные головокружения,
- регулярные обильные кровотечения из дёсен и носа,
- сильная бледность,
- подверженность инфекционным заболеванием и грибковым поражениям,
- образование синяков даже от простого нажима,
- одышка,
- быстрое исхудание,
- сильные боли в области тазобедренного сустава,
- выраженная дрожь в теле,
- нарушения дыхания,
- боли неопределённого характера,
- нервозность,
- сильная потливость,
- высыпания на коже.
При развитии симптоматики состояние больного ухудшается стремительно, и обойтись без обращения за врачебной помощью в такой ситуации нельзя.
Причины возникновения

Причиной анемии может стать длительный контакт с пестицидами
По причине появления заболевание разделяется на две группы — первичную и вторичную. Первичное нарушение диагностируется у пожилых людей, и причина его развития остаётся пока неизвестной. Вторичная форма нарушения развивается в любом возрасте на фоне длительного проведения радиотерапии или химиотерапии при раке; а также на фоне следующих факторов, вызывающих нарушения в работе костного мозга:
- нахождение в регионе с повышенным радиационным фоном;
- длительное воздействие неблагоприятной экологии;
- длительный и частый контакт с пестицидами, бензином и химическими растворителями;
- наследственные болезни крови;
- длительный приём ряда лекарственных препаратов.
Заболевание в некоторых случаях развивается на фоне приёма противоопухолевых средств, которые могут разрушать не только патологические клетки, но и здоровые. В результате этого нарушается состояние системы кроветворения, из-за чего картина крови резко ухудшается, в значительной степени усугубляя состояние больного.
Диагностика

Жалобы и анамнез дополняются лабораторными тестами
Предположительный диагноз обычно ставится на основании анамнеза и жалоб пациента. Далее для его подтверждения проводится лабораторная диагностика, при которой осуществляются общий анализ крови и исследование тканей костного мозга, полученных при пункции. Также требуется физикальное исследование для оценки тяжести состояния больного.
При изучении тканей костного мозга оценивается их клеточность, соотношение ростков кроветворения, наличие атипичных клеток. Именно данное исследование является основной мерой для диагностики патологии.
Лечение рефрактерной анемии

При выявлении признаков анемии пациенты подлежат лечению
Терапия при заболевании направлена на снижение интенсивности его проявлений, так как вылечить болезнь невозможно. Также при лечении ставится задача не допустить развитие осложнения, которым является острый лейкоз. При выборе терапии учитывается причина появления нарушения, возраст больного и наличие прочих патологий. Основное поддерживающее лечение сводится к следующему:
- внутривенное вливание дефицитных компонентов из состава крови;
- гормональные препараты, стимулирующие образование ростков кроветворения;
- корректировка прочих патологий;
- использование иммуносупрессорных препаратов.
У молодых пациентов при высоком риске появления острого лейкоза проводится курс химиотерапии. Полное выздоровление больного возможно только после операции по пересадке костного мозга, но эффективность метода не 100%.
Осложнения и прогноз

Своевременное лечение помогает достигнуть благоприятных прогнозов
Основное осложнение заболевания — развитие острого лейкоза. Прогноз для больных зависит от стадии патологии и эффективности поддерживающей терапии. При хорошем прогнозе продолжительность жизни составляет до 11 лет, в то время как при плохом больной редко проживает более 6 месяцев. Заболевание относится к категории злокачественных болезней крови.
Профилактика
Эффективные методы профилактики заболевания не разработаны. Единственное, что рекомендуют врачи для снижения риска появления проблем с системой кроветворения, это поддержка иммунитета, полноценное питание и отказ от вредных привычек. Также важно не допускать присутствия факторов, способствующих развитию патологии, и при первых же признаках нарушения обращаться за врачебной помощью.
Источник
Миелодиспластическим синдромом называют группу гетерогенных клональных заболеваний крови, объединенных следующими признаками: неэффективный гемопоэз, периферическая цитопения, дисплазия в одном или более ростке кроветворения с высоким потенциалом трансформации в острый миелоидный лейкоз.
 Миелодиспластический синдром развивается из-за нарушений в красном костном мозге
Миелодиспластический синдром развивается из-за нарушений в красном костном мозге
Недостаточное кроветворение проявляется анемией, повышенной кровоточивостью и подверженностью инфекциям. Миелодиспластический синдром (МДС) встречается у людей любого возраста, в том числе и детского, но в большей степени ему подвержены люди после 60 лет.
По МКБ-10 миелодиспластическим синдромам присваивается код D46.
Причины
Клетки крови синтезируются и созревают главным образом в костном мозге (этот процесс называется миелопоэзом, а ткань, в которой он происходит, называется миелоидной), затем, выполнив свою функцию и состарившись, уничтожаются селезенкой, а на их место приходят новые. При миелодиспластическом синдроме костный мозг теряет способность к воспроизводству клеток крови (всех – эритроцитов, лейкоцитов, тромбоцитов или только некоторых) в необходимом организму количестве, в кровь попадают незрелые клетки (бласты), в результате чего она хуже выполняет свои функции. Это проявляется характерной для МДС симптоматикой. Примерно в 30% случаев процесс миелопоэза становится со временем полностью бесконтрольным, количество бластных форм кровяных клеток увеличивается, вытесняя нормальные, зрелые клетки. Когда количество бластов в крови превышает 20% (ранее пороговым значением было 30%), ставится диагноз острого миелоидного лейкоза.
В зависимости от того, известна ли причина нарушения функции костного мозга, или нет, МДС делится на первичный, или идиопатический, и вторичный. Вторичный возникает в результате угнетения костномозговой функции после химиотерапевтического или лучевого воздействия. Такое воздействие обычно является частью противоопухолевой терапии, т. е. проводится по поводу какого-либо вида рака. В этом случае МДС можно рассматривать как осложнение.
Первичный, или идиопатический МДС возникает спонтанно, без какой-либо предшествующей патологии и по неизвестной причине. Возможно, предрасполагающим фактором является генетический, поскольку при некоторых видах синдрома обнаруживаются хромосомные изменения.
Факторами, способствующими развитию МДС, являются:
- курение;
- контакт с канцерогенными химическими веществами (пестициды, гербициды, бензол);
- воздействие ионизирующей радиации;
- пожилой возраст.
Формы заболевания
Как уже указывалось выше, МДС делится на два вида, первичный и вторичный.
Чаще встречается первичный МДС (около 80% всех случаев), большинство заболевших – пожилые люди (65-75 лет). Вторичным МДС также в основном страдают пожилые люди, по той причине, что и злокачественные опухоли, а значит, и их осложнения, у них встречаются чаще. Вторичный МДС хуже поддается терапии и связан с худшим прогнозом.
Кроме того, МДС делится на клинические типы в зависимости от типа бластных клеток, их количества и наличия хромосомных изменений, эта классификация предложена Всемирной Организацией Здравоохранения (ВОЗ). Согласно классификации ВОЗ, выделяют следующие формы МДС:
- рефрактерная (т. е. устойчивая к классической терапии) анемия;
- рефрактерная цитопения с мультилинейной дисплазией;
- МДС с изолированной делецией 5q;
- МДС неклассифицируемый;
- рефрактерная анемия с кольцевидными сидеробластами;
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами;
- рефрактерная анемия с избытком бластов-1;
- рефрактерная анемия с избытком бластов-2.
Стадии заболевания
В протекании МДС выделяют три стадии, которые, однако, не всегда клинически четко отличаются между собой, различия определяются лабораторно. Это стадия анемии, стадия трансформации (промежуточная между анемией и острым лейкозом), и острый миелоидный лейкоз. Не все исследователи согласны с определением острого миелоидного лейкоза как стадии миелодиспластического синдрома, поскольку он относится к миелопролиферативным нарушениям (т. е. тем, которые характеризуются бесконтрольным клеточным ростом), тем самым не полностью соответствуя характеристикам МДС.
Симптомы
Основные симптомы МДС связаны с проявлениями анемии. Пациенты предъявляют жалобы на повышенную утомляемость, приступы головокружения, одышку при физической нагрузке, которая ранее переносилась легко. Анемия связана с нарушением продукции эритроцитов, следствием чего является низкий уровень гемоглобина в крови.
В некоторых случаях развивается геморрагический синдром, который характеризуется повышенной кровоточивостью. Пациент начинает замечать, что даже незначительные поверхностные повреждения вызывают длительно не останавливающееся кровотечение, может появиться кровоточивость десен, частые и спонтанные носовые кровотечения, петехии на коже и слизистых оболочках, а также множественные гематомы (синяки) либо без связи с какой-либо запоминающейся пациенту травмы, либо после незначительного ушиба или даже надавливания. Геморрагический синдром связан с нарушениями тромбоцитопоэза.
У больных с МДС также обнаруживается подверженность инфекционным болезням. Они часто болеют простудными заболеваниями, кожными бактериальными и грибковыми инфекциями. Такое состояние обусловлено нейтропенией (недостаточностью нейтрофилов).
Кроме того, признаками МДС могут быть:
- беспричинное повышение температуры, часто до высоких значений (38 °С и выше);
- снижение веса, уменьшение аппетита;
- гепатомегалия;
- спленомегалия;
- болевой синдром.
В ряде случаев МДС ничем себя не проявляет и обнаруживается случайно во время лабораторного исследования крови по другому поводу.
Диагностика
Основной метод диагностики МДС – лабораторный. При подозрении на миелодисплазию проводятся:
- Клинический анализ крови. При этом обнаруживается анемия (макроцитарная), ретикулоцитопения, лейкопения, нейтропения, при синдроме 5q – тромбоцитоз. Примерно у половины пациентов выявляется панцитопения.
- Биопсия костного мозга. Цитоз обычно в норме или увеличен, но примерно у 10% пациентов он снижен (гипопластический вариант МДС), есть признаки нарушенного гемопоэза одного или нескольких ростков кроветворения, может обнаруживаться повышенное содержание бластных форм, патологических сидеробластов (эритроциты, содержащие отложения железа). Для идентификации аномальных фенотипов проводят исследование иммунофенотипа костномозговых клеток, это позволяет проводить дифференциальную диагностику МДС и неклональных цитопений, что важно для прогноза.
- Цитогенетический анализ. У 40–70 % пациентов обнаруживаются клональные цитогенетические аномалии, особенно часто наблюдается делеция (моносомия) 7 хромосомы (7q), которая является прогностически неблагоприятной.
- Определение уровня железа и феритина в сыворотке. Уровни повышены.
- Определение эндогенного эриропоэтина (при <500 МЕ/л эритропоэз-стимулирующие агенты обычно обеспечивают хороший терапевтический ответ).
В 95% случаев диагноз ставится на основании цитологического и гистологического анализа костного мозга.
 Диагностика МДС проводится лабораторными методами
Диагностика МДС проводится лабораторными методами
Читайте также:
13 причин субфебрильной температуры
6 свидетельствующих о болезнях изменений глаз
Донорство органов в России: 8 особенностей, о которых нужно знать
Диагностические критерии
Для определения МДС разработаны специальные критерии, т. е. условия, при соблюдении которых ставится данный диагноз. Диагностические критерии следующие:
- 1-, 2- или 3-ростковыя периферическая (т. е. обнаруживаемая в периферической крови) цитопения;
- дисплазия: признаки нарушения гемопоэза не менее 10% клеток не менее одного кроветворного ростка;
- характерные цитогенетические изменения (наличие патологического клона).
Цитопения должна быть стабильной и наблюдаться в течение не менее шести месяцев, однако если обнаруживается специфический кариотип, или ей сопутствует дисплазия не менее двух ростков кроветворения, достаточно двух месяцев.
Для постановки диагноза должны быть исключены другие заболевания, сопровождающиеся клеточной дисплазией и цитопенией.
При выявлении цитопении без других признаков МДС диагностируют идиопатическую цитопению, значение которой не установлено; при выявлении дисплазии без цитопении – идиопатическую дисплазию, значение которой не установлено. При этом требуется постоянное наблюдение пациента с повторным исследованием костного мозга через 6 месяцев, поскольку оба этих диагноза способны прогрессировать до МДС и острого миелоидного лейкоза (или другого миелопролиферативного заболевания).
Дифференциальная диагностика
МДС дифференцируется со следующими заболеваниями:
- анемии (прежде всего, мегалобластическая, сидеробластическая и апластическая);
- острый миелоидный лейкоз;
- лейкопения с нейтропенией;
- первичная иммунная тромбоцитопения;
- клональный гемопоэз с неопределенным потенциалом;
- первичный миелофиброз;
- ВИЧ;
- тяжелая интоксикация различной этиологии.
Лечение
В 1997 году была разработана специальная шкала, называемая шкалой IPSS (International Scoring Prognostic System, Международная шкала оценки прогноза), разделяющая пациентов на группы риска. В соответствии с определенной группой риска выбирается лечебная тактика, и, что следует из названия, оценивается прогноз.
Баллы присваиваются с учетом трех факторов:
- количество бластных форм;
- количество пораженных кроветворных ростков;
- цитогенетическая категория.
Сумма баллов позволяет отнести пациента к той или иной группе риска:
Метод лечения зависит от категории риска, состояния и возраста пациента. При бессимптомном течении МДС пациентам, относящимся к группе низкого или промежуточного риска, терапия может не назначаться, требуется лишь динамическое наблюдение.
Аллогенная трансплантация гемопоэтических стволовых клеток
Это единственный радикальный, т. е. позволяющий добиться выздоровления, метод лечения МДС. Он показан пациентам, отнесенным к группе со 2 промежуточным и высоким риском, а также пациентам с 1 промежуточным риском с повышенным процентом бластов или неблагоприятными цитогенетическими признаками. Возраст пациентов – преимущественно до 60 лет (этот критерий пересматривается в связи с усовершенствованием метода, в качестве кандидатов на трансплантацию рассматриваются пациенты и более старшего возраста). Аллогенная трансплантация предполагает наличие идентичного донора.
 Трансплантация стволовых клеток – радикальный метод лечения МДС
Трансплантация стволовых клеток – радикальный метод лечения МДС
Другие методы лечения
Кроме трансплантации стволовых клеток, могут применяться:
- Интенсивная индукционная терапия. Показана пациентам до 70 лет, относящимся к группе с высоким риском без неблагоприяных цитогенетических изменений в хорошем функциональном состоянии без сопутствующей патологии, с количеством бластов ≥10 %.
- Терапия Азатидином. Показана пациентам из групп со 2 промежуточным и высоким риском, не подходящим для аллогенной трансплантации гемопоэтических стволовых клеток, а также пациентам с симптоматикой из группы низкого и 1 промежуточного риска. Лечение проводится до прогрессирования заболевания или проявлений токсичности.
- Терапия Леналидомидом – показана при синдроме 5q–.
- Комбинированная иммуносупрессивная терапия (антимоноцитарный глобулин + Циклоспорин) показана пациентам моложе 60 лет с нормальным кариотипом и содержанием бластов <5 %, коротким периодом зависимости от переливания эритроцитарной массы (менее 6 месяцев) и наличием HLA-DR15, или наличием клона пароксизмальной ночной гемоглобинурии.
- Переливание эритроцитарной массы, тромбоцитов.
- Терапия гемопоэтическими ростовыми факторами (рекомбинантный эритропоэтин, EPO).
- Прием иммунодепрессивных препаратов (обычно по схеме антитимоцитарный глобулин + Циклоспорин).
- Низкодозная химиотерапия (обычно Децитабином или Цитарабином) – для пациентов из групп промежуточного и высокого риска при противопоказаниях к высокодозной химиотерапии.
Используются и другие режимы лечения.
Возможные осложнения и последствия
МДС является тяжелым заболеванием крови, которое у 30% пациентов трансформируется в острый миелоидный лейкоз.
Миелодиспластический синдром: прогноз
Прогноз зависит от того, к какой группе риска относится пациент. У пациентов из группы низкого риска средняя выживаемость составляет 6 лет после постановки диагноза. У пациентов из группы высокого риска – 6 месяцев и менее. Проведение аллогенной трансплантации гемопоэтических стволовых клеток способствует тому, что пятилетней выживаемости удается добиться у 40-50% пациентов. Правильно подобранное лечение способствует тому, что выживаемость у пациентов из высокой группы риска повышается до года.
Видео
Предлагаем к просмотру видеоролик по теме статьи.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
Источник
