Анемия с дефицитом пируваткиназы
Дефицит эритрoцитарной пируваткиназы (PK deficiency) – состояние, приводящее к гемолитической анемии, взаимосвязанное с нарушением метаболизма в эритроцитах, изменением формы эритроцитов и нарушением их функционирования.
Первое описание заболевания датируется началом 90-х годов у кота абиссинской породы. А в 2000 году доктор Урз Гигер (Pen University) уже разработал генетический тест.
Дефицит эритроцитарной пируваткиназы передается по аутосомно-рецессивному типу наследования. То есть животное может являться носителем дефектного гена (быть гетерозиготным по данному гену) без проявления клинических симптомов заболевания. Скрещивание при разведении двух носителей будет давать 25% котят с дефицитом.
Уже к 2012 году были проведены многочисленные исследования, которые выявили дефектный ген во многих породах кошек. Наиболее часто встречается у представителей абиссинской породы, египетской мау и бенгальской. Также дефицит пируваткиназы был зарегистрирован у таких пород кошек, как: домашняя короткошёрстная и полудлиношерстная, ла перм, саванна, сибирская кошка, сингапурская, сомалийская.
По последним данным проведенных исследований в Америке доказано, что дефицит эритроцитарной пируваткиназы выявлен у большого количества других пород, в частности, мейн-кун и норвежская лесная.
Пируваткиназа – этот фермент, который катализирует превращение фосфоэнолпирувата в пируват и таким образом участвует в гликолитической реакции образования АТФ. При его дефиците развивается нестабильность эритроцитов, что в конечном итоге приводит к анемии. Данная патология в основном протекает неостро или же развивается постепенно, поэтому больное животное имеет возможность приспособиться к анемии и не демонстрировать характерные симптомы. По причине нечеткой клинической картины и вероятности проявления в любом возрасте без проведения генетических тестов это заболевание можно неправильно диагностировать.
Клинические признаки могут очень сильно варьироваться: от снижения аппетита с потерей веса до состояния серьезной летаргии. У некоторых животных может наблюдаться увеличение объема живота по причине увеличения размеров селезенки (спленoмегалия), бледность слизистых оболочек, повышение частоты сердечных сокращений (тахикардия). В редких случаях развивается желтушность, атрофия мышц. Данную патологию тяжело выявить по причине непостоянного проявления клинических симптомов. Организм больного животного чаще успевает возмещать некоторые проявления анемии, и, как результат, сложные случаи выявляются у возрастных животных. Диагностируются случаи проявления острого течения заболевания, в результате которого развивается тяжелая анемия.
При посещении ветеринарной клиники Вам нужно будет подробно рассказать врачу о здоровье своего питомца с начала проявления симптомов и про их характер. Затем ветеринарный врач произведет полное физиологическое обследование животного, а также забор анализов: полный биохимический и общий клинический анализы крови, анализ мочи (его желательно принести заблаговременно с собой).
Анализ крови может выявить увеличение числа тромбоцитов, а также белых кровяных клеток (лейкоцитоз), анемии с аномально большими, бледно-красными кровяными клетками, аномально сформированных эритроцитов, называемых пoйкилoцитами, и вариации цвета (пoлихромазия). Биохимические анализ крови чаще всего может показать избыток железа в крови (гиперферремия), незначительное рост уровня билирубина и незначительное повышение ферментов печени. По анализу мочи можно обнаружить повышение уровня билирубина.
Существует анализ ДНК на дефицит ПК, чтобы помочь владельцам и селекционерам идентифицировать кошек-носителей данного гена. В тесте используется материал, который несложно самостоятельно собрать у животных при помощи щёчных тампонов, во избежание инвазивного забора крови. Заводчики имеют возможность использовать данное тестирование животных во избежание скрещивания носителей между собой и проведения более тщательной селекционной работы.
Лечение.
Чаще всего ветеринарными специалистами применяется поддерживающая терапия.
При клиническом проявлении дефицита пируваткиназы острой анемией может быть рекомендовано проведение гематрансфузии. Существуют данные, что удаление селезенки (спленэктомия) может способствовать замедлению процесса разрушения эритроцитов.
Трансплантация костного мозга – единственное доступное лечение для кошек с дефицитом ПK. Однако это лечение дорого, потенциально опасно для жизни и не применяется в нашей стране.
Животные без лечения или с отсутствием ответа на лечение, как правило, умирают в возрасте до четырех лет в результате патологии костного мозга или печеночной недостаточности. У большинства из этих пациентов развивается тяжелая анемия и скопление жидкости в брюшной полости (асцит) во время терминальной стадии болезни.
Профилактикой является тестирование производителей и не допуск в разведение пораженных животных.
Если вы планируете покупать кошку из группы пород риска, всегда спрашивайте заводчика, были ли проведены тесты у производителей на дефицит ПК, и попросите посмотреть результаты.
При диагностировании у животного гомозиготного гена ПК-дефицита, рекомендуется обратиться к ветеринарному врачу для получения информации о прогрессировании заболевания и снижении тяжести течения болезни.
Источник
К настоящему
времени накопилось достаточное число
наблюдений, позволяющих должным образом
оценить этиологическую роль генетической
недостаточности пируваткиназы в развитии
семейной, наследственной гемолитической
анемии «несфероцитарного» типа.
Описания современных
авторов, в частности Bowman
с соавторами, наблюдавших
21 семейный
случай пируваткиназа-дефицитной анемии
в одном изоляте, дают основание
рассматривать эту анемию как проявление
ферментной аномалии эритроцитов,
при которой нарушается внутриэритроцитарный
гликолиз на последних этапах образования
3-фосфоглицериновой кислоты из
1,3-дифосфоглицериновой кислоты и
образование пировиноградной кислоты
из фосфоэнолпировиноградной кислоты,
катализируемых пируваткиназой. Резкое
снижение активности пируваткиназы в
эритроцитах больных «несфероцитарной»
гемолитической анемии
II типа (по
Selvin
и
Dacie) приводит
к нарушению образования аденозин-трифосфорной
кислоты (АТФ); непосредственный же
механизм гемолиза, как полагают
современные авторы, обусловлен нарушением
электролитного баланса K/Na
(в котором АТФ играет основную роль) с
задержкой натрия в эритроцитах, что
приводит к снижению их осмотической
стойкости и гемолизу (корригируемому
АТФ).
Дефицит пируваткиназы
обнаруживается и у родителей больных,
но в меньшей степени, не приводящей
к явлениям гемолиза. Последний проявляется
только у гомозигот по данному признаку.
Аутогемолиз в
связи с нарушенным синтезом АТФ в
эритроцитах описан в единичных случаях
и при других ферментных недостаточностях:
дефиците триозофосфатизомеразы
(Schneider
с соавторами,
1965),
наследуемом по аутосомно-рецессивному
типу и проявляющемуся у гомозигот;
дефиците 2,3-дифосфоглицеромутазы,
наследуемом по аутосомно-доминантному
типу (Bowdler,
Prankerd,
1964).
Описаны также
больные «несфероцитарной» гемолитической
анемией, связанной с дефицитом
аденозинтрифосфатазы (Harvald
с соавторами,
1964),
дегидрогеназы 6-фосфоглюконовой кислоты
(Л. И. Идельсон и Г. В. Ермильченко,
1967).
Диагноз
энзимопенической («несфероцитарной»)
гемолитической анемии ставится на
основании клинико-гематологической
картины болезни и данных специальных
лабораторных проб, выявляющих
недостаточность ферментных систем
эритроцитов. Опорными пунктами в
дифференциальной диагностике с врожденной
гемолитической болезнью Минковского—Шоффара
служит макропланоцитоз при нормальной
или незначительно сниженной
осмотической резистентности эритроцитов.
Неизменно
отрицательная проба Кумбса и признаки
врожденного страдания позволяют легко
отличить данное заболевание от
приобретенной аутоиммунной
гемолитической анемии.
Прогноз.
Предсказание серьезно, особенно в период
гемолитических кризов.
Лечение.
Патогенетической терапии не существует.
В период гемолитических кризов
рекомендуется комплексная терапия
антианемическими препаратами (железо,
витамин B12)
и переливаниями эритроцитной массы.
Спленэктомия в большинстве случаев при
врожденной «несфероцитарной»
гемолитической анемии оказывалась
безрезультатной. Лишь в некоторых
случаях был получен частичный эффект.
По данным Ю. И. Лорие (1961),
обобщившего опыт ЦОЛИПК (всего 9
случаев) а также нашей клиники
(3 случая),
спленэктомия дает относительно
благоприятный результат в более
легких случаях заболевания (анемия
I типа по
Selvin
и Dacie),
характеризующихся менее выраженным
макроцитозом (средний диаметр эритроцитов
7,44—7,8
мкм) и нерезким снижением осмотической
стойкости эритроцитов после суточной
инкубации. В более тяжелых случаях
анемии
(II тип по
Selvin
и
Dacie),
характеризующихся более выраженным
макропланоцитозом (средний диаметр
эритроцитов
8,5— 8,88 мкм)
и резким снижением осмотической стойкости
эритроцитов после суточной инкубации,
спленэктомия не эффективна и даже
опасна. Аналогичные результаты получены
Grouchy
с сотрудниками
(1960),
На основании
сказанного выше вопрос о показаниях к
спленэктомии следует решать в соответствии
с клиническими данными (анемия, частые
гемолитические кризы, спленомегалия
со вторичным «гиперспленизмом»
—
лейкотромбоцитопенией) и руководствуясь
«типажем» эритроцитов (определяемым
по данным эритроцитометрии и осмотической
стойкости эритроцитов после суточной
инкубации без глюкозы и с добавлением
глюкозы). Решающее значение в прогнозе
операции, ее возможной эффективности
в данных случаях приобретают методы
радиоизотопной индикации при помощи
Cr51
и изучения приживаемости донорских
эритроцитов. В случае обнаружения
преобладающей секвестрации эритроцитов
в селезенке и сокращения сроков циркуляции
донорских эритроцитов (что может
указывать на существование
внеэритроцитарных факторов гемолиза)
можно рассчитывать на успех спленэктомии.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
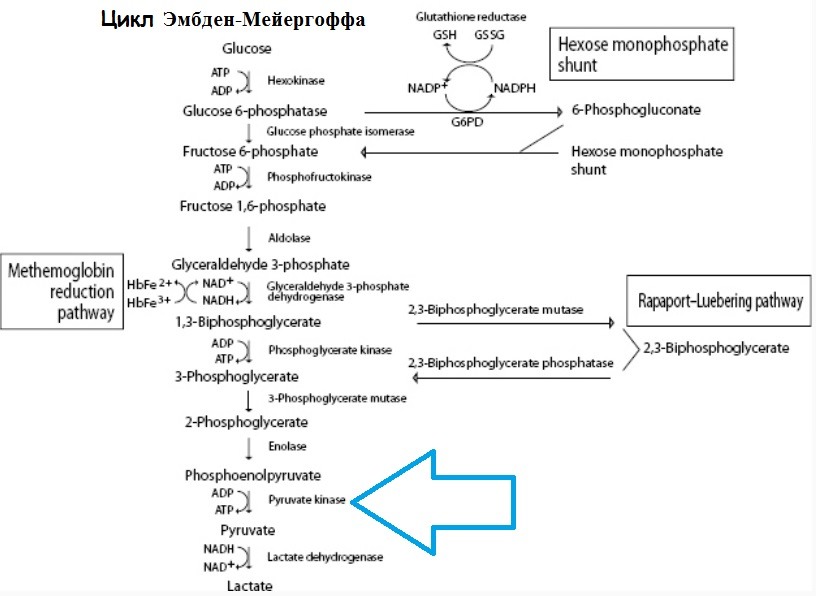
Недостаток пируваткиназы в эритроцитах – история изучения, причины, патофизиологияНедостаток пируваткиназы в эритроцитах заболевание, передающееся по наслеству. Оно характеризуется сокращением или исчезновением этого фермента из эритроцитов, в результате чего отмечается снижение способности сахарного обмена и концентрации АТФ, равно как и развитие хронической гемолитической анемии различной тяжести. В 1950 году были организованы исследования так называемых «несфероцитных врожденных гемолитических анемий». К тому же периоду был введен в практику тест аутогемолиза, заключающийся в 48-часовой инкубации, при 37°С дефибринированных в стерильных условиях эритроцитов в присутствии глюкозы или без нее и оценке самопроизвольного гемолиза. Применение этого теста в исследовании несфероцитной врожденной гемолитической анемии привело к выделению следующих двух групп: В отдельных случаях в этой второй категории отмечены частичная неспособность эритроцитов метаболизировать глюкозу до стадии лактата, также значительное накопление промежуточных метаболитов, в основном 2,3-дифосфоглицерата. В 1961 г. было установлено, что причину этого явления составляет отсутствие, в эритроцитах данных лиц, пируваткиназы, катализующей преобразование фосфоэнолпирувата в щавелевоуксусную кислоту. Со временем были описаны многие случаи врожденной гемолитической анемии за счет недостатка этого фермента, который хотя далеко не так часто встречается как дефицит Г-6-ФД, тем не менее находится на втором месте по частоте всех эритроэнзимопатий. Цикл Эмбден-Мейергоффа эритроцитов – последствия недостатка пируваткиназы Причины (этиология) недостатка пируваткиназы в эритроцитахПри дефиците пируваткиназы в эритроцитах в основе клинических нарушений находится генетическое поражение, которое проявляется либо сокращенным синтезом нормальных молекул, либо синтезом молекул неполноценной эффективности. Дефицит передается по наследству детям обоего пола, как рецессивная аутосомальная черта. Исследование пируваткиназы в иных клетках или тканях (лейкоцитах, мышцах, печени) выявило присутствие в них этого фермента, в нормальной концентрации, у страдающих недостатком пируваткиназы в эритроцитах, а это наводит на мысль о наличии ряда специализированных генов, каждый из них управляя синтезом определенного вида пируваткиназы. У гомозиготных больных наблюдается хроническая гемолитическая анемия и спленомегалия, в то время как у гетерозиготов клиническое и гематологическое состояние в норме. Большей частью нарушение носит количественный характер, однако описан ряд изоэнзим с качественными изменениями активности, что подтверждает наличие сдвигов в структурных генах. Патофизиология недостатка пируваткиназы в эритроцитахЖизнь эритроцита зависит от эффективности метаболизации глюкозы до ступени лактата, что составляет источник энергии, необходимой для проведения нормальной активности. Недостаток пируваткиназы препятствует осуществлению важной каталитической фазы, вырабатывающей энергию. Некоторое время молодые эритроциты работают с запасами ферментов, которыми располагают при поступлении в кровообращение но с возрастом разрушение ферментов, которые не могут быть восстановлены из-за отсутствия ядерного аппарата, равно как и блокирование метаболизма на уровне фосфоэнолпирувата определяют сокращение продолжительности жизни эритроидных элементов. Процесс блокирования может оказаться результатом не только большого сокращения численности молекул фермента, но также кинети.ческих аномалий. Так, некоторые изоэнзимы, пируваткиназы проявляют малое сродство к фосфоэнолпирувату, а это еще больше понижает эффективность молекул (и без того в уменьшенном, по сравнению с нормой числа) в процессе разрушения этого субстрата. В настоящее время еще не вскрыты полностью процессы, обусловливающие гемолиз эритроцитов с недостатком пируваткиназы, вместе с тем наблюдения многих авторов свидетельствуют об отсутствии постоянного и удовлетворительного взаимоотношения интенсивности дефицита и клинических проявлений. – Также рекомендуем “Течение, осложнения и лечение недостатка пируваткиназы в эритроцитах” Оглавление темы “Анемии”:
|
Источник
- Анемия вследствие нарушений гликолитических ферментов
- Гемолитическая анемия вследствие дефицита гексокиназы, пируваткиназы и триозофосфатизомеразы
- Наследственная гемолитическая анемия 2-го типа
- Нарушение метаболизма нуклеотидов
Анемия вследствие нарушений гликолитических ферментов
Гликолиз в организме человека представляет собой универсальный путь получения энергии из поступающих углеводов, прокариот и эукариот, аэробных и анаэробных микроорганизмов. В анаэробных условиях гликолиз является единственным значимым источником получения энергии из углеводов. Гликолиз производит энергию в виде АТФ и НАДН (Никотинамидадениндинуклеотид). Последний представляет собой кофермент, который присутствует во всех живых клетках человека и других живых существ.
Гликолитический путь состоит из 10 стадий, в каждой из которых принимают участие специфические ферменты. Каждая молекула глюкозы метаболизируется, в результате чего производится две молекулы АТФ (аденозинтрифосфорной кислоты) и две молекулы НАДН.
Гликолиз проходит не изолировано от других метаболических путей. Молекулы глюкозы могут вступить в этот процесс не только в самом его начале. Например, продукт распада гликогена — глюкоза-6-фосфат, может войти в гликолитический путь на втором этапе. Глицеральдегида-3-фосфат, который получают путем фотосинтеза, так же представляет собой гликолитически промежуточное соединение, поэтому может быть направлен по анаболическому пути в гликолиз только тогда, когда необходима энергия.
Кроме того, промежуточные продукты могут быть произведены во время гликолиза даже при высоких энергетических уровнях — для использования в биосинтетических путях. Например, в период активного производства пирувата — продукта гликолиза, входящего в цикл лимонной кислоты, пируват служит в качестве субстрата в синтезе аминокислоты.
Любые нарушения в производстве ферментов довольно быстро (в течение нескольких недель) сказываются на самочувствии человека, составе его крови, состоянии эритроцитов. Передача и синтез энергии в организме должны проходить непрерывно, и если по каким-либо причинам эти процессы нарушаются, развивается анемия и другие сопутствующие симптомы и состояние. Нарушения углеводного обмена приводят к нарушению функции скелетных мышц, слабости, апатии, проблемам с суставами, пищеварением, ростом волос.
Врожденные нарушения ферментов приводят к рождению детей с различными дефектами или умственной отсталостью. Приобретенные же заболевания такого типа чаще всего развиваются в подростковом возрасте, оказывая прямое воздействие на силу мышц, их тонус, энергообеспечение. Такие больные не могут адекватно переносить нагрузку, быстро утомляются, испытывают боль в мышцах и другие симптомы.
Лечение гемолитической анемии
Поскольку любая анемия, в том числе и гемолитическая, связана с другим, более серьезным заболеванием, для определения лечения необходима точная диагностика. Основные методы лечения гемолитической анемии независимо от причины:
- прием глюкокортикостероидов;
- спленэктомия (удаление селезенки);
- прием иммунодепрессантов;
- отмывание (трансфузия) эритроцитов, проводится при гемолитических кризах;
- коррекция уровня железа (при избыточном уровне проводят десфераловый тест — определение уровня железа, выводящегося с мочой).
Гемолитическая анемия вследствие дефицита гексокиназы, пируваткиназы и триозофосфатизомеразы
Основные ферменты, ответственные за процесс гликолиза – это гексокиназа (или глюкокиназа), фосфофруктокиназа и пируваткиназа. Концентрация этих трех ферментов в клетке регулируется гормонами, которые влияют на темпы их функционирования. Пептидный гормон инсулин, секретируемый поджелудочной, дает ответ на увеличение уровня аминокислот в крови, а также стимулирует ответ ЖКТ на этот процесс. Общий эффект инсулина заключается в поддержании соответствующего уровня энергии, когда пища поступает в достаточном количестве.
Глюкагон — еще один пептидный гормон, секретируемый клетками поджелудочной железы. Его секреция стимулируется низким уровнем глюкозы в крови, а общий эффект противоположен действию инсулина. Инсулин активирует выработку глюкокиназы, фосфофруктокиназы и пируваткиназы, в то время как глюкагон подавляет их производство. Такие процессы могут проходить как в течение нескольких часов, так и в течение нескольких дней и обычно отражают, сыт человек или голоден.
Что делает фосфофруктокиназа?
Фосфофруктокиназа (ФФК) является важным ферментом практически всех живых клеток. Он выполняет определенную функцию в процессе гликолиза, а именно — превращение фруктозы-6-фосфата во фруктозу-1, 6-бисфосфат. Глюкоза поддерживает устойчивое количество АТФ, основного носителя энергии в живых клетках.
Фосфофруктокиназа является мультисубъединичным белком. В таких белках субъединицы могут вести себя кооперативно; то есть, активность одной субъединицы влияет на активность всех других субъединиц. Белки, которые демонстрируют такое поведение, известны под названием аллостерических белков. Особенно известным примером аллостерического белка является гемоглобин, который скорее является белком, транспортирующим кислород, чем ферментом.
Активность такого аллостерического фермента как ФФК может регулироваться связыванием с малой молекулой, которая действует как активатор или ингибитор. Поскольку субъединицы действуют совместно, активация одной субъединицы приводит к активации всех субъединиц, и ингибирование одной субъединицы приводит к ингибированию всех субъединиц.
Что делает гексокиназа?
Гексокиназа нужна для выполнения первого этапа гликолиза в большинстве тканей, в том числе в мышцах и мозге. Она имеет низкую толерантность к глюкозе, поэтому позволяет инициирование гликолиза даже когда уровень глюкозы в крови являются относительно низким. Гексокиназа важна для предотвращения потребления слишком большого количества клеточного АТФ, когда глюкоза поступает в организм в больших количествах.
Глюкокиназа, содержащаяся в печени и поджелудочной железе, требует гораздо более высокой концентрации глюкозы для максимальной активности.
Таким образом, эти органы становятся наиболее активными сразу после употребления пищи, богатой углеводами. Гексокиназа позволяет печени эффективно удалить избыток глюкозы и свести к минимуму уровень гипергликемии после приема пищи.
В печени действие глюкокиназы противостоит воздействию глюкозо-6-фосфатазы, которая гидролитически удаляет фосфат из цикла. Такие реакции требуют большого количества АТФ, но помогают печени нормально функционировать.
Что делает пируваткиназа?
Пируваткиназа — это третий фермент, принимающий участие в гликолизе. Пируваткиназа также связана с уровнем сахара в крови. Она необходима для гормональной регуляции гликолиза, обеспечения активного роста тканей и работы внутренних органов. Гормоны и ферменты, которые регулируют скорость гликолиза, определяют и метаболизм гликогена — вещества, которое накапливается в печени и расходуется во время физических нагрузок.
Что делает триозофосфатизомераза?
Триозофосфатизомераза (ТФИ или TIM) является ферментом, который катализирует процессы превращения различных фосфатсодержащих соединений. Этот фермент также важен для гликолиза эффективного производства энергии. ТФИ был найден практически в каждом живом организме, не только у млекопитающих, но и у насекомых, грибов, растений и бактерий. Тем не менее, некоторые бактерии, которые не принимают участие в гликолизе, например, уреаплазма, не имеет в составе достаточного количества ТФИ.
У человека недостаток ТФИ связаны с прогрессивными, тяжелыми неврологическими расстройствами. Это расстройство называется дефицитом изомеразного триозофасфата.
Состояние приводит к хронической гемолитической анемии, которая может быть и врожденной. И хотя существуют различные мутации, вызывающие это заболевание, наиболее задействована в этом мутация глутаминовой кислоты.
Триозофосфатизомераза является высокоэффективным ферментом, благодаря которому проведение реакции в организме проходит в миллиарды раз быстрее, чем это имело бы место в природе. Реакция происходит настолько быстро, что ТФИ часто называют идеальным катализатором.
Наследственная гемолитическая анемия 2-го типа
Гемолитическая анемия возникает, когда костный мозг не в состоянии заменить разрушающиеся красные кровяные клетки новыми.
Иммунная гемолитическая анемия возникает, когда иммунная система ошибочно воспринимает свои собственные красные кровяные клетки, как чужеродные вещества. Антитела затем начинают действовать против красных кровяных клеток. Эти антитела атакуют эритроциты и заставляют их разрушаться раньше положенного срока.
Эритроциты при гемолитической анемии разрушаются из-за:
- генетических дефектов (например, серповидно-клеточной анемии, талассемии и дефиците G6PD);
- воздействия некоторых химических веществ, наркотиков и токсинов;
- инфекций.
Другие причины:
- сгустки крови в мелких кровеносных сосудах;
- переливание крови от донора с типом крови, не соответствующим типу крови пациента.
Симптомы наследственной гемолитической анемии
При легкой форме симптомы отсутствуют. При наследственной форме недомогание начинается появляться уже в первые месяцы жизни или же в подростковом возрасте.
Основные симптомы:
- чувство слабости, усталости, вялость;
- новорожденные плохо едят, постоянно спят или много кричат;
- бледный цвет кожи;
- дыхательные нарушения;
- болезненность языка;
- синие ногти;
- сонливость, беспокойство, раздражительность.
Нарушение метаболизма нуклеотидов
Чем опасно нарушение метаболизма нуклеотидов и как оно проявляется? По сути это то же самое нарушение процесса выработки или взаимодействия ферментов между собой, которое влечет последствия в виде различных нарушений работы внутренних органов, состава крови, процессов метаболизма, усвоения питательных веществ и обеспечения клеток энергией.
Соединение АТФ, обеспечивающее клетки энергией, это тоже нуклеотид. Без нормального синтеза АТФ и других нуклеотидов организм человека не может нормально существовать и полноценно усваивать питательные вещества. Клетки не получают нужных соединений, следовательно, не справляются со своими функциями. Нарушение метаболизма нуклеотидов прежде всего сказывается на состоянии крови, поэтому любой вид анемии должен стать поводом для визита к доктору.
Как известно, анемия лишь сигнализирует о нарушении, а не является первопричиной серьезного заболевания.
Источники статьи:
https://www.ncbi.nlm.nih.gov/
https://cmgm.stanford.edu/
https://library.med.utah.edu/
https://www.nlm.nih.gov/
https://www.quora.com/
https://www.wiley.com/
https://www.wiley.com/
https://www.proteopedia.org/
По материалам:
U.S. Department of Health and Human Services, National Institutes of Health
https://library.med.utah.edu
National Center for Biotechnology Information, U.S. National Library of Medicine
https://cmgm.stanford.edu
https://www.wiley.com
https://www.proteopedia.org
Dr. Shashank Rai
Смотрите также:
У нас также читают:
Источник
