Белок гемоглобин имеет четвертичную структуру
Четвертичная структура — способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Специфичность четвертичной структуры белков проявляется в определенной конформационной автономии полипептидных фрагментов, входящих в состав макромолекулы белка. Вклад гидрофобных взаимодействий в стабилизацию третичной и четвертичной структуры белков весьма значителен: в случае третичной структуры на их долю приходится больше половины стабилизирующей силы.
Примеры и номенклатура[править | править код]
Примеры белков с четвертичной структурой включают гемоглобин, ДНК-полимеразу, ионные каналы. Номенклатура белков с четвертичной структурой также особая. Числа субъединиц в олигомерном комплексе описываются с помощью имен, которые заканчиваются на -мер (по-гречески «части, подразделения»).
Хотя комплексы выше, чем октамер, редко наблюдаются у большинства белков, существует несколько исключений: вирусный капсид; протеосомы (четыре кольца = 28 субъединиц), транскрипционный комплекс и сплайсосома. Рибосомы — крупнейшие молекулярные машины, состоящие из множества РНК и белковых молекул. В некоторых случаях белки образуют комплексы, которые затем собираются в еще большие комплексы. Четвертичная структура белков имеет отношение к существованию изоферментов. Особенно хорошо изучен в этом отношении благодаря исследованиям Каплана, Маркерта и их сотрудников фермент лактатдегидрогеназы; этот фермент был выделен из организма цыплёнка в двух основных формах, из которых одна характерна для скелетных мышц, а другая — для сердечной мышцы. Эти две формы заметно отличаются друг от друга как по аминокислотному составу, так и по некоторым физическим, иммунологическим и каталитическим свойствам.
Четвертичная структура белков варьируется очень широко. На некоторых электронных микрофотографиях ясно видны агрегаты белковых молекул, однако их тонкую структуру установить не удаётся.
Определение четвертичной структуры белка[править | править код]
Белки четвертичной структуры могут быть определены с использованием различных экспериментальных методов, которые требуют образца белка в различных экспериментальных условиях. Эксперименты часто обеспечивают оценку массы нативного белка и, вместе со знанием массы и/или стехиометрии субъединицы, позволяют предположить четвертичную структуру. Число субъединиц в белковом комплексе часто может быть определено путём измерения гидродинамического молекулярного объёма или массы комплекса. Некоторые методы биоинформатики были разработаны для прогнозирования признаков четвертичной структуры белков на основе информации об их последовательности.
Методы, которые измеряют массу интактного комплекса непосредственно[править | править код]
- Масс-спектрометрия;
- Электроспрей;
- Аналитическое ультрацентрифугирование;
Методы, которые измеряют размер интактного комплекса непосредственно[править | править код]
- Рэлеевское рассеяние
- Эксклюзионная хроматография
- Двойная интерферометрия поляризации
Ссылки[править | править код]
- [www.xumuk.ru/biologhim/023.html Четвертичная структура]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Под
четвертичной структурой подразумевают способ укладки в пространстве отдельных
полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной
или третичной структурой, и формирование единого в структурном и функциональном
отношениях макромолекулярно-го образования. Многие функциональные белки состоят
из нескольких полипептидных цепей, соединенных не главновалентными связями, а
неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной
структуры). Каждая отдельно взятая полипептидная цепь, получившая название
протомера, мономера или субъединицы, чаще всего не обладает биологической
активностью. Эту способность белок приобретает при определенном способе
пространственного объединения входящих в его состав протомеров, т.е. возникает
новое качество, не свойственное мономерному белку. Образовавшуюся молекулу
принято называть олигоме-ром (или мультимером). Олигомерные белки чаще
построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми
или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В
частности, молекула гемоглобина состоит из двух одинаковых α- и
двух β-полипептидных цепей, т.е. представляет собой тетрамер. На рис. 1.23
представлена структура молекулы гемоглобина, а на рис. 1.24 хорошо видно, что
молекула гемоглобина содержит четыре полипептидные цепи, каждая из
которых окружает группу гема – пигмента, придающего крови ее характерный красный
цвет (см. главу 2).
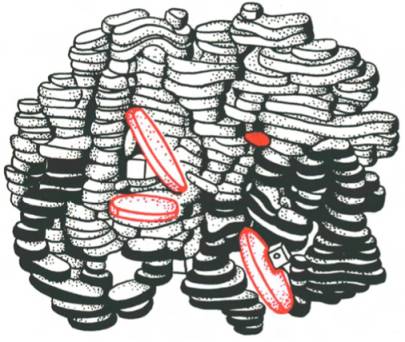
Рис. 1.23. Олигомерная
молекула гемоглобина (красные диски – группы гема).
В
определенных условиях (присутствие солей, 8М мочевины или резкие изменения рН)
молекула гемоглобина обратимо диссоциирует на две α-и
две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После
удаления солей или мочевины происходит автоматическая ассоциация исходной
молекулы гемоглобина (рис. 1.25).
Классическим
примером олигомерной молекулы, или надмолекулярной структуры, является вирус
табачной мозаики, представляющий собой гигантскую молекулу с мол. м. около
40•106. Он состоит из одной молекулы РНК (см.
главу 3) и 2130 белковых субъединиц, масса каждой из которых составляет 17500.
Длина вируса примерно 300 нм, ширина – около 17 нм. РНК вируса имеет
спиралеобразную форму. Вокруг РНК нанизаны белковые частицы, образующие
гигантскую надмолекулярную спиральную структуру, в которой насчитывается около
130 витков (рис. 1.26). Удивительной особенностью вируса является то, что после
разъединения соответствующими приемами (добавление детергента) РНК и белковых
субъединиц и последующего их смешивания (с предварительным удалением
детергента) наблюдаются полная регенерация четвертичной структуры,
восстановление всех физических параметров и биологических функций (инфектив-ная
способность вируса). Подобная точность процесса спонтанной самосборки вируса
обеспечивается, вероятнее всего, информацией, содержащейся в первичной структуре
молекулы РНК и белковых субъединиц. Таким образом, последовательность
аминокислот содержит в себе информацию, которая реализуется на всех уровнях
структурной организации белков.
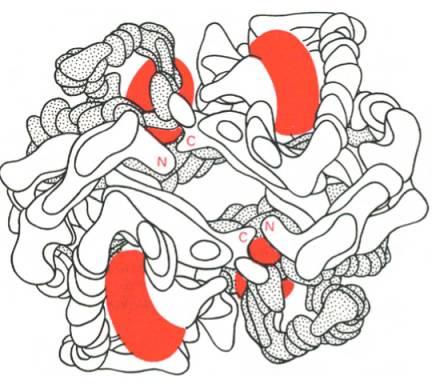
Рис. 1.24. Модель гемоглобина (по Перутцу).
α-Цепи
светлые; β-цепи темные; группы гема
красные.
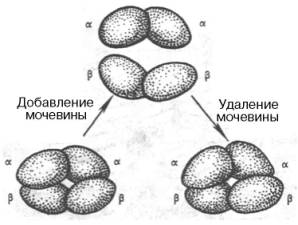
Рис. 1.25. Обратимая
диссоциация молекулы гемоглобина.
Многие
ферменты также обладают четвертичной структурой, например фосфорилаза а, состоящая из двух идентичных
субъединиц, в каждой из которых по две пептидные цепи. Вся молекула фосфорилазы
а, таким образом, представляет
собой тетрамер. Отдельные субъединицы чаще всего не обладают каталитической
активностью; вообще регуляторные ферменты (см. главу 4)
имеют четвертичную олигомерную структуру. Они наделены функцией обеспечения в
клетке требуемых скоростей химических реакций.
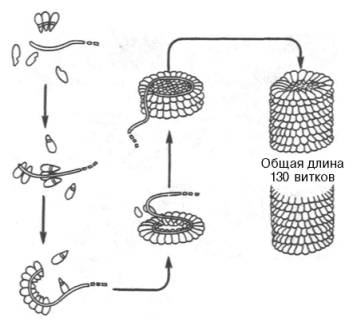
Рис. 1.26. Самосборка
вируса табачной мозаики.
Наиболее
изученным олигомерным ферментом является лактатдегидро-геназа (она катализирует
обратимое превращение пировиноградной кислоты в молочную), содержащая два типа
полипептидных цепей: Н – сердечный тип (от англ. heart –
сердце) и М – мышечный тип (от англ. muscle – мышца) – и
состоящая из 4 субъединиц. Этот фермент благодаря различным сочетаниям
субъединиц может существовать в 5 формах. Такие ферменты получили название
изоферментов, или, в соответствии с новой классификацией, множественных форм
ферментов (см. главу 4).
К настоящему
времени субъединичная структура обнаружена у нескольких сотен белков. Однако
только для немногих белков, в том числе для молекулы гемоглобина, методом
рентгеноструктурного анализа расшифрована четвертичная структура . Основными
силами, стабилизирующими четвертичную структуру, являются нековалентные связи
между контактными площадками протомеров, которые взаимодействуют друг с другом
по типу комплементарности – универсальному принципу,
свойственному живой природе. Структура белка после его синтеза в рибосоме может
частично подвергаться модификации (посттрансляционный процессинг): например,
при превращении предшественников ряда ферментов или гормонов (инсулин).
Таким
образом, имеются все основания для подтверждения мнения о существовании 4
уровней структурной организации белков. Более того, каждый индивидуальный белок
характеризуется уникальной структурой, обеспечивающей уникальность его функций.
Поэтому выяснение структуры разнообразных белков может служить ключом к
познанию природы живых систем и соответственно сущности жизни. На этом пути
научного поиска могут быть решены также многие проблемы наследственных
заболеваний человека, в основе которых лежат дефекты структуры и биосинтеза
белков.
Некоторые
исследователи склонны рассматривать, и не без основания, существование пятого
уровня структурной организации белков. Речь идет о полифункциональных
макромолекулярных комплексах, или ассоциатах из разных ферментов, получивших
название метаболических олигомеров, или метаболонов, и катализирующих весь путь
превращений субстрата (синте-тазы высших жирных кислот, пируватдегидрогеназный
комплекс, дыхательная цепь).
Еще по теме:
- Четвертичная структура белка – биохимический справочник

