Что такое оксигенация гемоглобина

Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
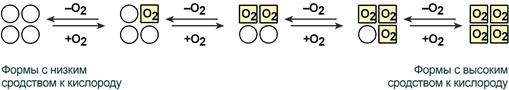
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
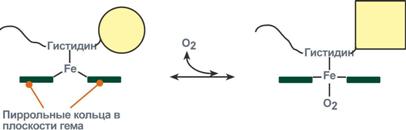
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
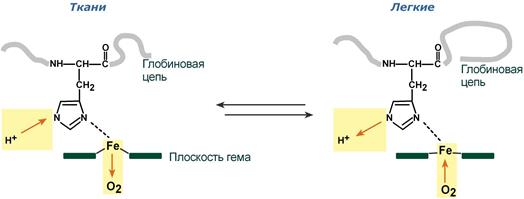
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
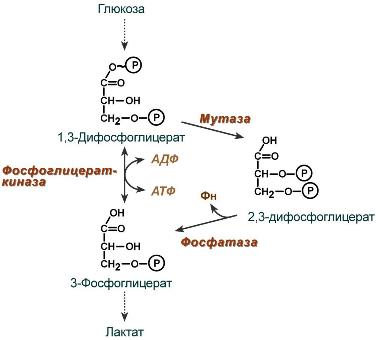
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
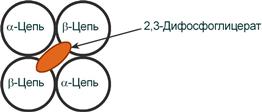
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Ответ на эти вопросы был получен после того, как выяснилось, что молекула дезоксигемоглобина при связывании кислорода претерпевает конформационные изменення. Первое указание на существование таких изменений относится к тому времени, когда было обнаружено, что кристаллы дезоксигемоглобина, выращенные в бескислородной атмосфере, разрушаются, как только вступают в контакт с кислородом. Это наблюдение наводило на мысль о том, что при связывании кислорода молекулы гемоглобина изменяются в своих размерах и уже не укладываются в кристаллическую решетку дезоксигемоглобина. Это предположение было полностью подтверждено результатами сравнительного рентгеноструктурного анализа, которые показали, что дезоксигемоглобин и оксигемоглобин имеют разные пространственные конформации (рис. 8-10 и 8-18). При оксигенации дезоксигемоглобина третичная структура и -цепей практически не изменяется, поскольку они остаются плотно пригнанными друг к другу и образуют димеры . Однако, как только кислород присоединяется к гемогруппам дезоксигемоглобина, половинки молекулы сохраняя свойственную им жесткую конформацию, изменяют свое положение относительно друг друга и теснее сближаются между собой. Иными словами, оксигенация гемоглобина вызывает изменение его четвертичной структуры, т.е. упаковки субъединиц. В результате молекула оксигемоглобина приобретает несколько более компактную структуру по сравнению с дезоксигемоглобином, и центральная полость уменьшается. Гемы двух Р-цепей сближаются друг с другом, а темы двух -цепей раздвигаются, что и приводит к сигмоидной форме кривой насыщения кислородом. Вследствие этих изменений аминокислотные остатки в и -цепях, связывающие ионы перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщеплепие ионов от протонированных групп; иначе говоря, при оксигенации гемоглобина протонированные группы приобретают свойства более сильных кислот, чем и объясняется эффект Бора. Таким образом, изменение четвертичной структуры гемоглобина в результате его оксигенации находится в прямой связи с существованием обратного соотношения между сродством гемоглобина к кислороду и его сродством к и ионам .
Наконец, еще одну особенность регуляторных свойств гемоглобина выявили Рейнгольд Бенеш и Руфь Бенеш, обнаружившие четвертый лиганд гемоглобина -дифосфоглицерат. Об этой интересной особенности рассказывается в дополнении 8-1.
Рис. 8-18. Схематическое изображение (в виде «стоп-кадров») изменений в четвертичной структуре гемоглобина, обусловленных перемещением пары субъединиц относительно неподвижной пары в процессе освобождения кислорода из оксигемоглобина, переходящего в форму дезоксигемоглобина.
Дополнение 8-1. Дифосфоглицерат и сродство гемоглобина к кислороду
Уже давно известно, что 2,3-дифосфоглицерат (рис. 1) присутствует в эритроцитах в довольно высоких концентрациях, однако функция этого соединения оставалась загадкой до тех пор, пока не было обнаружено, что он оказывает сильное влияние на сродство гемоглобина к кислороду. При добавлении 2,3-дифосфоглицерата (ДФГ) к раствору чистого гемоглобина сродство гемоглобина к кислороду значительно снижается.
Этот эффект обусловлен тем, что ДФГ сам связывается с дезоксигемоглобином. Следовательно, можно написать уравнение еще одной (четвертой по счету) реакции связывания гемоглобина с лигандом:
Таким образом, наблюдается обратная зависимость между двумя процессами – связыванием кислорода и ДФГ (присоединяющихся к разным участкам молекулы гемоглобина).
Рис. 1. А. Структура 2,3-дифосфоглицерата (ДФГ). Красным цветом выделены заряженные группы взаимодействующие с двумя Р-цепями. Б. Расположение молекулы ДФГ (выделена красным цветом) в центральной полости гемоглобина. Отрицательно заряженные группы ДФГ притягиваются к находящимся поблизости положительно заряженным R-группам -цепей (показаны жирными черными линиями).
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. После того как здоровый человек поднимется, скажем, на высоту 4000 м над уровнем моря, в течение первых нескольких часов концентрация ДФГ в его эритроцитах будет возрастать; при этом число молекул ДФГ, связанных с гемоглобином, увеличится, а сродство гемоглобина к кислороду снизится. На большой высоте парциальное давление кислорода значительно ниже, чем на уровне моря. Поэтому и в тканях парциальное давление кислорода снижается. Увеличение содержания ДФГ в эритроцитах при восхождении на большую высоту облегчает освобождение кислорода из гемоглобина в тканях. Изменения противоположного характера наблюдаются у людей, акклиматизировавшихся к условиям высокогорья, например у жителей Гималаев или Андов, когда они спускаются в долины.
Повышение концентрации ДФГ в эритроцитах наблюдается также у людей при гипоксии; это патологическое состояние возникает вследствие недостаточного снабжения тканей кислородом, что может быть обусловлено заболеваниями органов дыхания или нарушениями в системе кровообращения.
С каким участком молекулы гемоглобина связывается ДФГ? В молекуле гемоглобина имеется открытая центральная полость, или канал, который хорошо виден на рис. 8-10. Этот канал, выстланный многими положительно заряженными -группами, и служит местом связывания ДФГ, который присоединяется к дезоксигемоглобину и образует поперечную связь (солевой мостик) между двумя -субъединицами. При связывании гемоглобином кислорода ДФГ вытесняется из полости. Гемоглобин связывает только одну молекулу ДФГ (рис. 1); напомним, что он может связывать по четыре молекулы или и примерно четыре иона Н+.
Рис. 2. Влияние ДФГ на кривую насыщения гемоглобина кислородом.
При обычном выделении гемоглобина из крови он содержит довольно большое количество ДФГ, от которого трудно освободиться полностью. При полном удалении ДФГ из гемоглобина кривая связывания его с кислородом в значительной степени утрачивает свою сигмоидную форму и гемоглобин приобретает намного более высокое сродство к кислороду. После добавления избытка ДФГ к гемоглобину способность последнего к связыванию кислорода понижается (рис. 2). Таким образом, присутствие ДФГ весьма существенно для нормального освобождения кислорода из гемоглобина в тканях. В эритроцитах некоторых птиц содержится не ДФГ, а другое фосфатсодержащее соединение – инозитолгексафосфат, который даже еще более эффективно, чем ДФГ, снижает сродство гемоглобина к кислороду.
Гемоглобин можно рассматривать как молекулярную автоматическую систему управления, которая отзывается на изменение концентрации любого из его четырех лигандов, передает соответствующую информацию, преобразуя ее в конформационные изменения молекулы, и таким путем регулирует свое сродство к другим лигандам.
Рис. 8-19. Симметричная («все или ничего») и последовательная (индуцированное соответствие) модели кооперативного связывания кислорода гемоглобином. В обеих моделях субъединицы могут находиться в двух различных состояниях. Кружками обозначено состояние, в котором субъединицы имеют низкое сродство к кислороду, а квадратами состояние с высоким сродством к кислороду. А. Согласно симметричной модели («все или ничего»), гемоглобин может находиться только в двух формах: в одной из них все субъединицы имеют низкое сродство к кислороду, а в другой высокое. При отсутствии кислорода обе эти формы находятся в равновесии, но форма с низким сродством к кислороду доминирует. Если же кислород присутствует, то он связывается преимущественно с формой гемоглобина, имеющей высокое сродство; при этом равновесие сдвигается вправо и вероятность связывания с гемоглобином оставшегося кислорода увеличивается. В симметричной модели не предусматривается существования промежуточных форм по отношению к формам с низким и высоким сродством к кислороду. Б. В последовательной модели (модели индуцированного соответствия) имеется несколько промежуточных конформаций, последовательно приближающихся к форме с высоким сродством к кислороду. Связывание молекулы кислорода с одной из субъединиц, имеющей низкое сродство к кислороду, индуцирует переход этой субъединицы в форму с высоким сродством. Такой переход в свою очередь повышает вероятность того, что последовательное присоединение кислорода к другим субъединицам будет индуцировать их переход в форму с высоким сродством.
Считается, что связывание кислорода с одной или двумя субъединицами вызывает в них небольшие конформационные изменения, способствующие конформационным перестройкам пустых (не заполненных кислородом) субъединиц, в результате чего изменяется четвертичная структура всей молекулы; при этом ее сродство к кислороду повышается, а сродство к и ионам понижается. Наоборот, при освобождении кислорода четвертичная структура вновь принимает исходную форму, способствующую связыванию и ионов .
Были предложены различные теории для детального объяснения всех структурных изменений гемоглобина, наблюдаемых в процессе его оксигенаиии и дезоксигенации, а также происходящих при этом изменений в его способности к связыванию лигандов (рис. 8-19). Но каковы бы ни были детали всех этих изменений, ясно одно – гемоглобин может служить моделью автоматической регулирующей системы при рассмотрении других олигомерных белков. например ферментов, особенно тех из них, которые обладают как каталитической, так и регуляторной активностью. Многие белки, наделенные такими регуляторными свойствами, состоят из двух или большего числа пригнанных одна к другой полипептидных цепей, образующих характерную четвертичную структуру, способную изменяться при переходе белка из одного активного состояния в другое в процессе его функционирования.
© Автор: З. Нелли Владимировна, врач лабораторной диагностики НИИ трансфузиологии и медицинских биотехнологий, специально для СосудИнфо.ру (об авторах)
Красный пигмент крови человека, сложный железосодержащий белок (хромопротеин, состоящий из глобина и четырех гемов с двухвалентным железом в центре каждого) – гемоглобин (Hb), соединяясь с молекулярным кислородом (O2) в легких, образует оксигенированную форму – оксигемоглобин (HHbO2). Оксигемоглобин, приобретая уникальные свойства и обеспечивая дыхание, как одно из элементарных проявлений жизни, продолжает саму жизнь организма. Например, достаточно ввести окись углерода вместо кислорода или нарушить потребление О2 клетками при попадании цианидов (солей синильной кислоты), которые ингибируют ферментные системы тканевого дыхания, как тут же наступает гибель организма.
Дыхание, на первый взгляд, кажется совсем простым процессом. Между тем, оно основано на взаимодействии многих компонентов, составляющих гигантскую молекулу красного пигмента крови – хромопротеина гемоглобина, который, в свою очередь, отличается многообразием производных, где из их числа несомненный интерес вызывает оксигемоглобин. Итак, оксигемоглобин образуется в легких путем соединения сложного железосодержащего белка гемоглобина с кислородом, поступающим с вдыхаемым воздухом.
Образование и распад оксигемоглобина
В спокойном состоянии тканям человеческого тела достаточно около 0,2 л кислорода в одну минуту, но все меняется при физической нагрузке и чем она интенсивнее, тем больше необходимого для дыхания газа запрашивают ткани. Для удовлетворения их нужд потребность в кислороде может увеличиваться в 10 – 15 раз и составлять до 2, а то и 3 литров О2 в одну минуту. Однако газообразный кислород в данном количестве никак не сможет пробраться в ткани, поскольку он почти не растворим и в воде, и в плазме, то есть, этот элемент в ткани должен доставить какой-то белок, способный соединиться с ним и решить задачу транспорта.
Кровь, как биологическая среда, реализует свои функциональные обязанности по обеспечению дыхания за счет присутствия в ней сложного содержащего железо протеина – гемоглобина, физиологическая роль которого, как транспортного средства кислорода, базируется на способности Hb связывать и отдавать О2 в корреляции с концентрацией (парциальным давлением – P) данного газа в крови. Образование оксигемоглобина осуществляется в паренхиме легких, куда кислород прибывает при дыхании из воздуха окружающей среды.
Процесс образования HHbO2 происходит в доли секунды (0,01 с), поскольку кровь в легких задерживается всего-то на полсекунды. Схематично и коротко образование оксигемоглобина можно представить в следующем виде:
- Попадая в капиллярные сосуды легких, кровь обогащается кислородом, то есть, красный кровяной пигмент к своим 4 гемам присоединяет кислород – идет реакция окисления (оксигенации);
- Кислород связывается с гемами хромопротеина при помощи координационных связей феррума (железо – Fe) и, не изменяя в данном случае валентности последнего (в геме валентность железа всегда – II), переводит его (Hb) в несколько иное состояние;
- Гем железосодержащего протеина представляет собой активный центр, с его помощью хромопротеин в результате вышеуказанной реакции переходит в непрочный комплекс – оксигенированный гемоглобин (HHbO2), который, находясь в красных кровяных тельцах – эритроцитах, с током крови доставляется к клеткам тканей, чтобы через распад оксигемоглобина и выделения в процессе диссоциации кислорода, обеспечить их дыхание.
Таким образом, результатом реакции оксигенации становится образование оксигемоглобина, подкисление биологической жидкости, снижение ее щелочного резерва, то есть, ее умения связывать углекислоту (СО2), которое, разумеется, на тот момент снижается.
Железосодержащий протеин, насытившись в легочной паренхиме кислородом и приобретя оксигенированную форму, уносит О2 к тканям, в капиллярных сосудах которых его концентрация в крови резко понижена. Там происходит распад оксигемоглобина (диссоциация), кислород уходит на тканевое дыхание, гемоглобин забирает отработанный углекислый газ, превращаясь в другую физиологическую модель – карбогемоглобин (HHbCO2), и в этом качестве отправляется в главный орган дыхания, чтобы обменять CO2 на очередную порцию необходимого организму газа.
Кривая образования и распада (диссоциации) оксигемоглобина
Агентом, гарантирующим быстрое насыщение железосодержащего белка кислородом (образование оксигемоглобина), выступает высокое напряжение (парциальное давление) О2 в легочных альвеолах (порядка 100 мм рт. ст.).
Корреляцию между степенью насыщения красного кровяного пигмента кислородом и парциальным давлением O2 (PO2) выражают в виде S-образной кривой (сигмоиды), которую называют кривой диссоциации оксигемоглобина.
Свойственная красному кровяному пигменту S-образная (сигмоида) кривая диссоциации оксигемоглобина свидетельствует о том, что контактирование первой молекулы О2 с одним из гемов Hb открывает путь присоединению других молекул элемента остальными тремя гемами. Кривой насыщения железосодержащего белка кислородом принадлежит немалая физиологическая значимость – S-образная конфигурация позволяет крови обогатиться данным газом при изменениях концентрации кислорода в биологической жидкости в довольно обширных интервалах. К примеру, не следует ожидать таких особенных расстройств дыхательной функции крови, как выраженное кислородное голодание (гипоксия), при подъеме на высоту до 3,5 км над уровнем моря или во время перелета на самолете. Хотя PO2 во вдыхаемом воздухе сильно понизится, концентрация кислорода в крови будет находиться на достаточно высоком уровне, чтобы обеспечить насыщение Hb данным газом. На это указывает и отлогий график формирования и распада оксигемоглобина на верхнем его отрезке (верхний отрезок кривой свидетельствует о течении процесса насыщения О2 красного пигмента крови в легочной паренхиме и находится в пределах 75 – 98%).
Кривая диссоциации оксигемоглобина может быть разделена на 4 отрезка, каждому их которых соответствует определенный период образования оксигемоглобина (зависимость скорости насыщения хромопротеина кислородом от парциального давления газа в крови):
- 0 – 10 мм рт. ст. – гемоглобин не спешит насыщаться;
- 10 – 40 мм рт. ст. – оксигенация резко ускоряется (стремительный подъем кривой), доходя до 75%;
- 40 – 60 мм рт. ст. – оксигенация заметно замедляется, потихоньку добираясь до 90%;
- Значения PO2 пересекают отметку 60 мм рт. ст. – насыщение идет слабо (линия лениво ползет вверх). Однако кривая медленно продолжает стремиться к отметке 100%, но, так и не достигнув ее, останавливается на уровне 96 – 98%. Кстати, и такие показатели насыщения Hb кислородом отмечаются только у молодых и здоровых людей (PO2 артериальной крови ≈ 95 мм рт. ст., легочных капилляров – ≈ 100 мм рт. ст.). С возрастом дыхательные способности крови снижаются.
Несовпадение парциального давления кислорода артериальной крови и смеси газов в альвеолах легких трактуется:
- Некоторыми разногласиями между интенсивностью тока крови и вентилированием разных отделов главного органа дыхания – легких;
- Притоком незначительного объема крови из бронхиальных вен в венозные сосуды легких (шунтирование), где, как известно, течет артериальная кровь;
- Прибытием доли крови из коронарных вен в левый желудочек сердца посредством тебезиевых вен (вены Тебезия-Вьессена), в которых проходимость возможна в обоих направлениях.
Между тем, причины, вследствие которых кривая образования и диссоциации оксигемоглобина приобрела сигмоидную форму, пока остаются не до конца выясненными.
Смещение кривой диссоциации оксигемоглобина
Но кривая диссоциации оксигемоглобина, о которой идет речь выше, справедлива, если в организме все нормально. В других ситуациях график может сдвигаться в ту или иную сторону.
В числовом выражении сродство гемоглобина к кислороду обозначается величиной P50 – напряжение полунасыщения красного пигмента крови кислородом или иными словами: парциальное напряжение О2, при котором 50% Hb пребывает в форме оксигемоглобина (оптимальные условия: рН – 7,4, tº – 37ºC). Нормальные значения этого показателя в артериальной крови приближаются к величине 34,67 гПа (26 мм рт. ст.). Смещение графика вправо указывает на то, что способность красного кровяного пигмента соединяться с кислородом снижается, что, естественно, увеличивает значения P50. И, наоборот – смещение кривой влево говорит об увеличении сродства этого хромопротеина к кислороду (↓P50.).
Ходу сигмоиды помогают некоторые факторы, повышающие обогащение крови кислородом и таким образом участвующие в тканевом дыхании, поэтому названные вспомогательными:
- Повышение водородного показателя (pH) крови (эффект Бора), поскольку способность гемоглобина присоединять кислород связана с водородным показателем (pH) данной биологической среды (гемоглобин представляет одну из четырех буферных систем и влияет на регуляцию кислотно-основного баланса, поддерживая pH на нужном уровне: 7,36 – 7,4). Следовательно, чем выше водородный показатель, тем активнее ведет себя гемоглобин в отношении кислорода и наоборот – снижение pH отнимает возможности хромопротеина присоединять кислород, например: ↓pH до 7,2 заставит график отклоняться вправо (≈ на 15%), ↑pH до 7,6 передвинет кривую диссоциации оксигемоглобина влево (≈ на 15%);
- Отделение углекислого газа от карбогемоглобина в легких и выход СО2 с выдыхаемым воздухом (эффект Бора-Вериго) на фоне повышения водородного показателя создает условия для жадного насыщения гемоглобина кислородом (образование оксигемоглобина в легких);
- Возрастание уровня значимого для обмена фосфата – 2,3-дифосфоглицерата (2,3-ДФГ), содержание которого в крови меняется в зависимости от условий протекания обменных процессов;
- Снижение температуры в легких (в тканях она выше, нежели в легких) и чем ниже упадет tº, тем больше способностей присоединять кислород появляется у железосодержащего белка (при повышении температуры идет обратный эффект).
Уровень красного пигмента в крови, а также его способность присоединять кислород (кривая диссоциации оксигемоглобина) в некоторой степени подвержены возрастным колебаниям. Так, у младенцев, только-только известившим мир о своем появлении первым криком, количество гемоглобина заметно выше, что объясняется присутствием фетального гемоглобина, который, как известно, обладает повышенным сродством к кислороду. Красный пигмент крови стариков, напротив, постепенно снижает способности связывать кислород.
В заключение хочется заметить, что гемоглобин не только имеет сродство к кислороду и довольно легко соединяется с углекислым газом. Кроме физиологических соединений красного кровяного пигмента при определенных условиях возникают связи с другими газами, в частности – с угарным газом (CO) и оксидом азота (NO), причем соединение происходит также непринужденно
Высокое сродство Hb к угарному газу влечет образование карбоксигемоглобина (HHbCO), который препятствует соединению хромопротеина с кислородом, а в результате этого ткани остаются без O2. К чему это может привести – всем известно: при отравлении угарным газом высок риск смертельного исхода, если вовремя не помочь человеку.
При отравлении оксидом азота или парами нитробензола гемоглобин переходит в метгемоглобин (HHbOH) с изменением валентности железа (II → III). Метгемоглобин также не позволяет кислороду соединиться с гемоглобином, в итоге – наступает кислородное голодание тканей, создается угроза жизни организма.
Видео: о транспорте кислорода и углекислого газа гемоглобином
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос в форму ниже ответит один из ведущих авторов сайта.
В данный момент на вопросы отвечает: А. Олеся Валерьевна, к.м.н., преподаватель медицинского вуза
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.
