Циклоспорин при апластической анемии
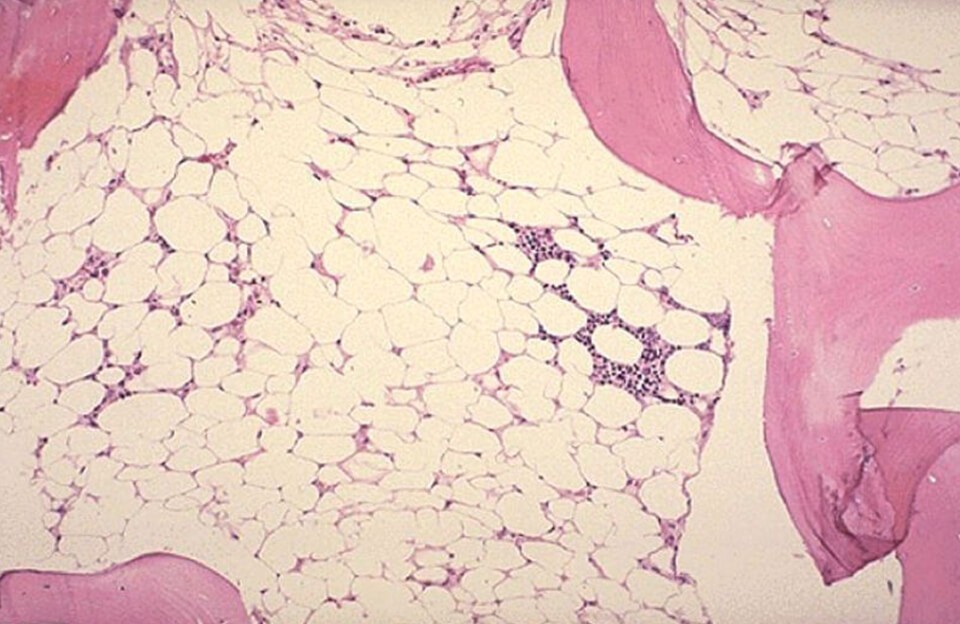
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри – физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом – выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О2 и СО2), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, – резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов – причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда – аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Низкая работоспособность;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Бледность кожи;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Дефицит тромбоцитов;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – < 0,5х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – < 0,2х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение – это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности – избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет – 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
АА — одно из самых тяжелых расстройств гемопоэза с летальностью, превышающей 80%.
Апластическая (гипопластическая) анемия долго рассматривалась как синдром, объединяющий патологические состояния костного мозга, протекающие с выраженной гипоплазией кроветворения.
По МКБ-10 D61 Другие апластические анемии.
Сегодня представляется целесообразным выделять самостоятельную нозологическую единицу — АА — и четко отличать ее от синдрома гипоплазии кроветворения, являющегося проявлением известных самостоятельных заболеваний костного мозга.
АА — заболевание, возникающее в результате повреждения стволовой клетки крови, следствием чего является глубокое угнетение гемопоэза.
АА разделяют на:
1) врожденные (генетически детерминированные), к ним относятся анемия Фанкони, синдром Блекфонда-Даймона и другие;
2) приобретенные.
В этой статье будут рассмотрены только приобретенные АА.
Эпидемиология.
АА — довольно редкое заболевание, его частота составляет 5 случаев на 1 млн населения в год.
АА встречается чаще у лиц молодого возраста, одинаково часто у мужчин и женщин.
Этиология.
Приобретенные АА: вторичные, возникающие под воздействием какого-либо фактора, и идиопатические.
Причины для развития вторичных АА:
1. Ионизирующее облучение.
2. Идиосинкразия к лекарственным препаратам (хлорамфеникол, нестероидные противовоспалительные, препараты золота, антиэпилептоидные препараты).
3. Регулярное воздействие цитостатиков или других токсичных веществ (бензол, иприт).
4. Вирусные инфекции (инфекционный мононуклеоз, вирусный гепатит, парвовирус, СПИД).
5. Иммунные болезни или состояния (эозинофильный фасциит, гипоиммуноглобулинемия, тимома, рак вилочковой железы, реакция «трансплантат против хозяина» (РТПХ), ПНГ, беременность).
Чаше причина АА остается невыясненной несмотря на самое тщательное обследование больного и анализ анамнестических данных.
В таких случаях говорят об идиопатической АА.
Патогенез.
Патогенетические механизмы АА окончательно пока не ясны.
В основе развития вторичных АА лежит непосредственное повреждающее действие токсических агентов на гемопоэтическую стволовую клетку (ГСК); в ряде случаев основным механизмом является иммунная реакция, направленная против ГСК, возможно, измененных в результате мутации. Дефект клеток стромального микроокружения в развитии АА в последние годы признается лишь немногими авторами.
Наследственный генетический дефект лежит в основе врожденных АА. Ведущую роль отводят дефекту стволовой клетки крови.
В пользу этого говорит связь АА с клональными заболеваниями костного мозга, такими как ПНГ, МДС и ОЛЛ.
При длительном течении АА у 57% больных отмечается развитие ПНГ, МДС и ОЛ. Особенность патогенеза АА в том, что реакция иммунной системы направлена против антигена (антигенов), появляющегося на цитоплазматической мембране стволовой клетки крови в результате мутации в ее генетическом аппарате.
Такая реакция иммунной системы близка по своей природе (если не тождественна) к реакциям противоопухолевого иммунитета.
Однако эта иммунная реакция является, с одной стороны, несостоятельной, поскольку не приводит к полной элиминации дефектной клетки, а с другой стороны ~ избыточной, так как блокирует развитие не только дефектной стволовой клетки, но и большинства нормальных стволовых клеток крови.
На возможное наличие предрасполагающего генетического дефекта, приводящего к развитию АА, указывает факт повышенной встречаемости у больных с АА антигена HLA—DR2, при этом частота обнаружения антигена DR у родителей больных была выше ожидаемой.
У детей с тяжелой АА обнаружили весьма существенное увеличение частоты антигена HLA-DPw3.
HLA DR15 ассоциируется с ПНГ и ответом на иммуносупрессивную терапию. HLA DRB 1501 — с ответом на циклоспорин А, рецидивами и зависимостью от терапии циклоспорином.
Таким образом, сегодня в понимании патогенеза АА главенствует представление о ключевой роли дефекта стволовой клетки крови, возникающего вследствие воздействия неизвестного пускового агента. Этот дефект близок по характеру или идентичен мутации клетки.
Клиническая картина АА зависит от степени аплазии костного мозга и цитопении и складывается из анемического, геморрагического синдромов, а также синдрома инфекционных осложнений.
Первые жалобы больного чаше всего связаны с развитием анемии — это повышенная утомляемость, слабость, головокружение, шум в ушах, плохая переносимость душных помещений.
Появление кровотечений (носовых, маточных, желудочно-кишечных), немотивированных «синяков» и петехий обычно сразу настораживает больных и вынуждает обращаться за медицинской помощью.
Жалобы, связанные с инфекционными осложнениями на фоне агранулоцитоза, у больных с АА практически ничем не отличаются от таковых при независимо протекающей бактериальной инфекции.
Довольно часто развиваются язвенно-некротические процессы в полости рта.
При осмотре у больного выявляются бледность кожи и видимых слизистых оболочек, признаки геморрагического диатеза в виде мелкоточечных петехий и небольших «синяков».
Обусловленная анемией недостаточность кровообращения в большом круге может приводить к появлению отеков, в первую очередь, на нижних конечностях, и к увеличению печени.
Различные воспалительные заболевания проявляются характерными для них физикальными признаками.
Диагностика.
Клиническая картина заболевания позволяет заподозрить поражение системы крови. Критерии диагностики АА. В периферической крови выявляются панцитопения (анемия, тромбоцитопения, лейкопения за счет нейтропении), ретикулоцитопения.
Анемия часто гиперхромная, макроцитарная.
При красно-клеточной аплазии может иметь место только анемия с ретикулоцитопенией.
Биопсия костного мозга (трепанбиопсия из гребня подвздошной кости) — гипоклеточный костный мозг с редукцией гемопоэтической ткани и замещением ее жировой тканью.
Патоморфология костного мозга.
Обнаруживается большое количество жировой ткани, содержание которой может достигать 90%. Среди доминирующей жировой ткани встречаются стромальные и лимфоидные элементы.
Гематогенные клетки представлены крайне скудно: в небольшом количестве встречаются эритроидные и гранулоцитарные предшественники. Мегакариоциты отсутствуют.
В зависимости от показателей периферической крови и костного мозга выделяют АА тяжелой и средней степени тяжести.
Для тяжелой АА характерны: клеточность костного мозга менее 30%; наличие любых двух показателей из трех нижеперечисленных — число нейтрофилов менее 0,5×10*9/л, число тромбоцитов менее 20х10*9/л, ретикулоциты менее 0,4; отсутствие признаков других гематологических заболеваний.
Пациенты с панцитопенией, не соответствующей критериям тяжелой АА, расцениваются как пациенты с АА средней степени тяжести.
Дифференциальная диагностика.
Из 100 случаев панцитопении диагноз АА подтверждается только у 19 пациентов.
В первую очередь дифференцировать АА необходимо от острого лейкоза — в отличие от последнего, при АА не увеличена селезенка.
Необходимо дифференцировать приобретенную АА от других заболеваний с панцитопенией:
• врожденных АА;
• миелодиспластического синдрома (МДС).
В ряде случаев дифференциальный диагноз представляет значительные трудности.
Критерием являются наличие гиперклеточного или нормоклеточного костного мозга с признаками дисплазии и отсутствие большого количества жировой ткани в костном мозге при МДС;
• хронического миелофиброза. В костном мозге коллагеновый или ретикулиновый фиброз, значительная спленомегалия;
• острого лейкоза. В костном мозге количество властных клеток больше 20%;
• мегалобластных анемий. В костном мозге мегалобластное кроветворение;
• заболеваний, протекающих со спленомегалией.
Лечение АА представляет собой очень сложную задачу.
Методом выбора для пациентов с АА тяжелой или средней степени тяжести, но зависимым от постоянных гемотрансфузий является аллогенная родственная трансплантация ГСК (ТГСК) от HLA-совместимого донора.
ТГСК у детей характеризуется хорошим приживлением трансплантата и низким риском развития хронической РТПХ, однако имеет место риск развития вторичных опухолей.
У взрослых пациентов моложе 50 лет, несмотря на значительно больший риск развития РТПХ и других осложнений, ТГСК также с успехом применяется в течение многих лет.
Общая 5-летняя выживаемость колеблется от 65 до 78%.
Результаты ТГСК от неродственных доноров при АА значительно хуже.
При отсутствии HLA-совместимого донора показана иммуносупрессивная терапия — антитимоцитарный глобулин (ATG) 40 мг/кг/день с 1 по 4 день с последующим приемом циклоспорина А в течение 6 мес в дозе 12 мг/кг/день.
Средние дозы кортикостероидов (1 мг/кг преднизолона или метилпреднизолона) в течение первых двух недель терапии с последующей редукцией дозы и отменой.
Ответ через 6 месяцев наблюдается у 70% пациентов.
Несмотря на успехи иммуносупрессивной терапии у многих больных имеет место рецидив, но он не связан с плохим прогнозом.
Часть пациентов не чувствительна к иммуносупрессивной терапии.
Некоторые пациенты отвечают на терапию андрогенами, терапию КСФ, высокими дозами циклофосфамида.
Показана спленэктомия.
Серьезной проблемой является развитие отсроченных по времени клональных гематологических заболеваний (ПНГ, МДС, ОМЛ).
Пациентам с АА средней степени тяжести в качестве первой линии показан антитимоцитарный глобулин (ATG) 40 мг/кг/день х 4 дня.
В случае хорошего ответа на терапию рекомендуется наблюдение.
При отсутствии ответа в качестве терапии второй линии применяют циклоспорин А в дозе 12 мг/кг веса у взрослых и 15 мг/кг у детей в течение 3—8 мес.
Все больные АА нуждаются в заместительной трансфузионной терапии эритроиитарной и/иди тромбоиитарной массой.
Объем трансфузионной терапии определяется показателями периферической крови и клиническими проявлениями заболевания.
Противопоказаны трансфузии гемокомпонентов от потенциального донора костного мозга.
Кроме того, проводится антибактериальная и микостатическая терапия с целью профилактики или лечения инфекционных осложнений.
Прогноз при АА чрезвычайно серьезен.
Профилактика АА сводится к исключению бесконтрольного и неоправданного использования лекарственных препаратов, а также к улучшению экологической ситуации для снижения вероятности воздействия внешних неблагоприятных физических и химических факторов.
