Дифференциальная диагностика анемий в терапии

При выявлении синдрома анемии проводят дифференциальную диагностику между основными вариантами анемии. Были предложены алгоритмы диагностики анемий, основанные на морфологических изменениях эритроцитов (макро-, микро-, нормоцитоз; гипер-, гипо-, нормохромия; сфероцитоз, серповидноклеточность, овалоцитоз, мишеневидность и т.д.); на наличии в эритроцитах телец Жолли, колец Кебота, базофильной зернистости, телец Гейнца и др.; на характере нарушений эритропоэза (нормобластный, мегалобластный типы; клеточный, малоклеточный, «пустой» костный мозг); на характеристике регенераторных процессов (гипер-, гипо-, норморегенераторный); на наличии патологического гемоглобина (F, Н и др.), на особенностях иммунологических сдвигов (наличие антител к эритроцитам в сыворотке крови больного). Предложенные алгоритмы включают и некоторые клинические особенности: извращение вкуса, характерное для железодефицитной анемии; неврологические симптомы, характерные для В12-дефицитной, «свинцовой» анемии; кровоточивость (при апластической анемии); желтушность кожи и увеличение селезенки (характерно для гемолитической анемии); отечный синдром (при сопутствующей патологии почек, микседеме и т.д.).
Железодефицитные анемии отличаются от мегалобластых анемий рядом лабораторных и физикальных симптомов. Так, при мегалобластной анемии увеличен цветовой показатель, эритроциты отличаются большими размерами, наличием в них телец Жолли, колец Кебота (остатки ядерного вещества и ядерной оболочки); анемия сочетается с лейкопенией и тромбоцитопенией (при дефиците витамина В12 или фолиевой кислоты нарушается синтез ДНК во всех клетках крови); повышен уровень свободного билирубина (большие размеры эритроцитов снижают их способность к деформируемости и приводят к более быстрой гибели при прохождении через синусоиды селезенки, чем эритроцитов нормальных размеров). Костномозговое кроветворение совершается по мегалобластному типу; при дефиците витамина В12 или фолиевой кислоты темп пролиферации клеток резко замедляется, созревание ядра затормаживается, а гемоглобинизация происходит рано, так как нет дефицита железа и порфиринов. В связи с этим при незрелом ядре цитоплазма эритрокариоцита уже гемоглобинизирована.
При расспросе больных выявляются жалобы на чувство жжения в языке, нарушение координации движений (при фуникулярном миелозе). Объективно отмечаются легкая желтушность кожи с лимонным оттенком, небольшое увеличение селезенки (в которой происходит разрушение мегалоцитов).
В биохимическом анализе крови содержание сывороточного железа и другие показатели обмена железа остаются в норме. При исследовании желудочной секреции обычно определяется ахилия. Обследование больного с мегалобластной анемии должно быть направлено на выявление патологии ЖКТ; при этом, как правило, обнаруживают атрофический гастрит типа А, резкое снижение секреторной функции желудка, изредка – рак желудка (чаще фундального отдела, где локализуются добавочные железы, продуцирующие внутренний фактор Касла), болезни тонкой кишки с синдромом мальабсорбции (прежде всего, при нарушении всасывания витаминов группы В), болезни толстой кишки с дисбиозом (микрофлора толстой кишки вырабатывает дневной запас витамина В12); дифиллоботриоз.
Дефицит железа при мегалобластной анемии развивается редко – только при наличии причин, ведущих к сочетанному дефициту, например при резекции тонкой кишки, синдроме мальабсорбции, а также при повышенной регенерации эритроцитов у больных в процессе лечения витамином В12.
Необходимость дифференцировать железодефицитные анемии с гемолитическими анемиями возникает в тех случаях, когда гемолитический криз сопровождается резким усилением эритропоэза, расходуется много железа, развивается гипохромия эритроцитов и снижается уровень сывороточного железа. Если при этом не нарушена функция печени и свободный билирубин в гепатоцитах трансформируется в связанный, то нет характерного признака гемолиза – увеличения свободного билирубина в сыворотке крови. В этих случаях железодефицитные анемии дифференцируют с врожденной или приобретенной гемолитической анемией (прежде всего, с наиболее часто встречающейся – аутоиммунной гемолитической анемией), с талассемией и болезнью Маркиафавы-Микели. От врожденной гемолитической анемии железодефицитные анемии отличается анамнезом: как правило, врожденную гемолитическую анемию диагностируют с детства, когда обращают внимание на частую желтушность склер и кожи, деформацию скелета (башенный череп, высокое нёбо, укорочение мизинца). При объективном исследовании обычно обнаруживают спленомегалию, что не характерно для железодефицитной анемии.
При талассемии анемия гипохромная, цветовой показатель ниже 0,8, что дает основание дифференцировать ее с железодефицитной анемией. Отличительными признаками талассемии являются: повышенное содержание сывороточного железа и свободного билирубина; своеобразное изменение осмотической резистентности эритроцитов: раннее начало гемолиза и позднее окончание, поскольку при талассемии имеются популяции эритроцитов как с пониженной, так и с повышенной стойкостью. Своеобразна и форма эритроцитов: гемоглобин расположен в них в виде колец (мишеневидные эритроциты), увеличено содержание ретикулоцитов и сидероцитов. Патогенез заболевания связан с нарушением синтеза глобина: одни цепи глобина синтезируютея быстрее, другие – медленнее, в результате накапливаются те из них, которые синтезируются быстрее. Соответственно накоплению тех или других цепей различают а-, ß-, у-талассемию. Накапливающиеся цепи глобина повреждают мембрану эритроцитов, которая разрушается быстрее обычного.
При микросфероцитарной гемолитической анемии в основе патогенеза лежит нарушение скелета мембраны эритроцита вследствие дефицита белков актина и спектрина. Неполноценная мембрана эритроцитов способствует пассивному проникновению внутрь эритроцита натрия и воды. Эритроцит разбухает, приобретает шаровидную форму, а при прохождении через межсинусовые пространства селезенки из-за неспособности деформироваться с него постепенно «стесывается» часть массы, он становится маленьким, шаровидным и через несколько оборотов крови разрушается в межсинусовых пространствах. Этому способствует наличие в межсинусовых пространствах гипотонического раствора за счет пониженного содержания глюкозы и холестерина.
Аутоиммунная гемолитическая анемия патогенетически характеризуется наличием в организме антител против неизмененных антигенов эритроцитов или эритрокариоцитов. В основе снижения аутотолерантности эритроцитов лежит угнетение функции или количества Т-супрессоров. Различают аутоиммунную идиопатическую гемолитическую анемию (без видимой причины) и симптоматическую гемолитическую анемию (например, при системной красной волчанке (СКВ) или лейкозах). По серологическим признакам разграничивают аутоиммунную гемолитическую анемию с неполными тепловыми антителами, с тепловыми гемолизинами, с полными холодовыми агглютининами и парциальную красноклеточную анемию. В типичных случаях аутоиммунная гемолитическая анемия характеризуется желтухой, спленомегалией, увеличением свободной фракции билирубина в крови, повышенной регенерацией, повышенным содержанием сывороточного железа. Только в случаях гемолитического криза при повышенном расходовании железа его концентрация в крови снижается и анемия приобретает железодефицитный характер. В подобных случаях признаками аутоиммунной гемолитической анемии, отличающими ее от железодефицитной анемии, являются увеличение селезенки и серологические исследования.
При аутоиммунной гемолитической анемии с неполными тепловыми агглютининами прямая проба Кумбса положительная (эритроциты больного в присутствии антиглобулиновой сыворотки дают агглютинацию). Аутоиммунная гемолитическая анемия с тепловыми гемолизинами протекает с отрицательной пробой Кумбса, но нередка положительная перекрестная сахарозная проба: происходит аггрегация эритроцитов донора в присутствии сыворотки больного, содержащей гемолизины и глюкозу; кроме того, у больных иногда наблюдается тромбоз периферических и мезентериальных сосудов. Аутоиммунная гемолитическая анемия с полными холодовыми агглютининами отличается характерными клиническими проявлениями: посинение пальцев рук, ног, ушей, кончика носа на холоде, обострение болезни в зимние месяцы; в мазке крови, в пробирке наблюдается агглютинация эритроцитов, которая исчезает, если пробирку или стекло подогреть. При холодовой аутоиммунной гемолитической анемии отмечается гемолиз эритроцитов донора в присутствии сыворотки больного, разведенной в тысячи и миллионы раз при температуре +4 °С.
Парциальная красноклеточная анемия описана у взрослых и у детей. В патогенезе заболевания лежит образование антител к эритрокариоцитам. Для нее характерно снижение количества эритрокариоцитов в пунктате костного мозга до 5-20%, значительное снижение количества ретикулоцитов, гемоглобина, повышение содержания железа в сыворотке крови и отложение его во внутренних органах, за счет чего увеличиваются селезенка и печень и может развиться сахарный диабет. Таким образом, парциальная красноклеточная анемия отличается от железодефицитной анемии гиперсидеремией, уменьшением количества клеток красного ростка в пунктате костного мозга.
Гипохромная анемия наблюдается у больных с болезнью Маркиафавы-Микели. Патогенез этого заболевания связан с дефектом мембраны всех клеток миелоидного ростка, что обусловлено мутацией на уровне клетки – предшественницы миелопоэза. Вследствие этого дефекта эритроциты, нейтрофилы и тромбоциты легко разрушаются в присутствии комплемента или в сахарозной среде с низкой ионной силой; они обладают повышенной чувствительностью к действию антител агглютининов. Характерно одновременное наличие двух клонов эритроцитов: нормального и мутировавшего. Патологически измененные клетки отличаются малой продолжительностью жизни. При их гибели выделяется множество факторов, способствующих свертыванию крови, поэтому у больных с болезнью Маркиафавы-Микели часто наблюдается тромбоз.
Клиника. На фоне жалоб гипоксического характера отмечается склонность к тромбозу периферических вен, а также боль в животе, обусловленная тромбозом мезентериальных сосудов. Кожные покровы бледные с желтушным оттенком. Через 2-3 года от начала болезни появляется гемоглобинурия – выделение мочи черного цвета, обычно после ночного сна, вследствие гемолиза эритроцитов в сосудах почек.
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).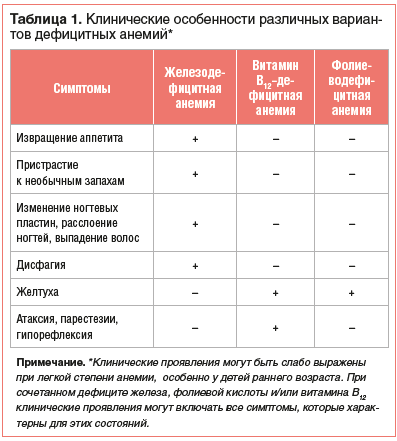
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).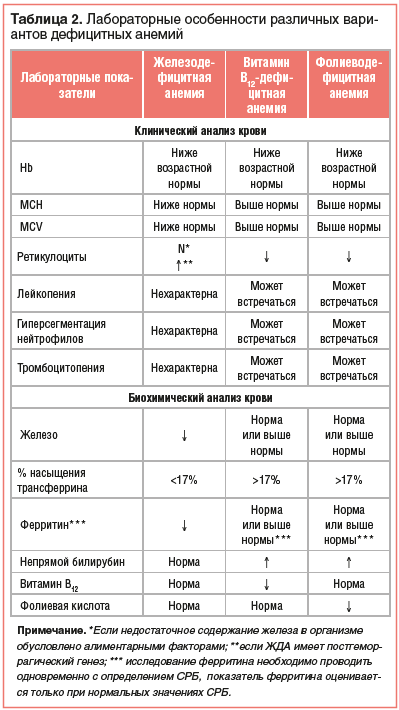
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
